鞘内注射诺西那生钠治疗Ⅰ型脊髓性肌萎缩症患儿的麻醉管理
2020-12-15郑碧琼林兰英
黄 庆, 郑碧琼, 林兰英
脊髓性肌萎缩症(spinal muscular atrophy,SMA)是一种运动神经元存活基因1缺失或突变引起的罕见的遗传性神经肌肉疾病。运动神经元功能紊乱导致进行性肌无力、呼吸功能不全,临床主要表现为进行性、对称性、肢体近端为主的广泛性弛缓性麻痹与肌萎缩,而智力发育及感觉均正常。SMA在活产婴儿中的发生率是1/6 000~1/10 000,人群携带率达1/40~1/60[1]。既往对于SMA并无有效的治疗方法。2019年10月10日,我国首个也是目前唯一一个获批的SMA特效治疗药物诺西那生钠(商品名:Nusinersen)注射液在北京、上海、福州、杭州、长春5个城市同步开启患者治疗,首批共计10位患者接受了诺西那生钠鞘内注射。本研究回顾性分析笔者医院两例确诊为Ⅰ型SMA患儿行诺西那生钠鞘内注射治疗的7次诊疗过程,探讨治疗过程中的麻醉管理要点。
1 对象与方法
1.1对象 2019年10月-2020年5月于笔者医院确诊为Ⅰ型SMA的患儿两例,共行诺西那生钠鞘内注射治疗7次。两例患儿的一般资料见表1。
病例1:出生后3月龄发病,抬头不稳,踢腿无力,7月龄确诊Ⅰ型SMA,23月龄起已于日本东京女子医科大学接受诺西那生钠治疗4次。至笔者医院首次治疗时38月龄,体质量12.3 kg,自主呼吸,抬头稳,会左右翻身,可双手支撑,俯卧时不能仰头,独坐时间较前延长,不能扶站,双手可抓握东西,双下肢可平移,不能抬离床面。
病例2:出生后2.5月龄发病,5月龄确诊Ⅰ型SMA,9月龄出现呼吸困难表现,病情逐渐加重,12月龄开始吞咽困难,需鼻饲饮食及无创呼吸机支持,21月龄行胃造瘘术。至笔者医院首次鞘内注射治疗时36月龄,体质量12.5 kg,能闭眼,双眼可追物,不能抬头、翻身,除面部表情肌外仅双上肢手指可轻微活动,双下肢完全不能活动,需持续无创呼吸机支持,口腔分泌物多,吞咽困难,约15 min需进行一次口腔分泌物吸引,食物由胃造瘘处饲入。

表1 两例Ⅰ型SMA患儿治疗前一般情况
1.2方法
1.2.1麻醉前评估 术前笔者所在团队进行了多学科协作诊疗(multi-disciplinary treatment,MDT):由神经内科医师、儿科医师及护士、麻醉科医师共同对患儿术前的临床表现、体格检查情况、营养状况、心肺功能、肝肾功能、凝血功能、腰椎X线检查、基因诊断情况等进行评估,协商制定麻醉方案、操作流程、应急预案等。与家属充分沟通,取得其知情同意。
两例患儿经过术前MDT评估,肝肾功能、凝血功能均无异常,无脊柱侧弯、椎间隙正常,无鞘内注射禁忌(表2)。结合患儿的呼吸功能、吞咽功能及肌力情况,笔者团队讨论后决定病例1在丙泊酚静脉麻醉下完成鞘内注射治疗,病例2在局部浸润麻醉下完成鞘内注射治疗。
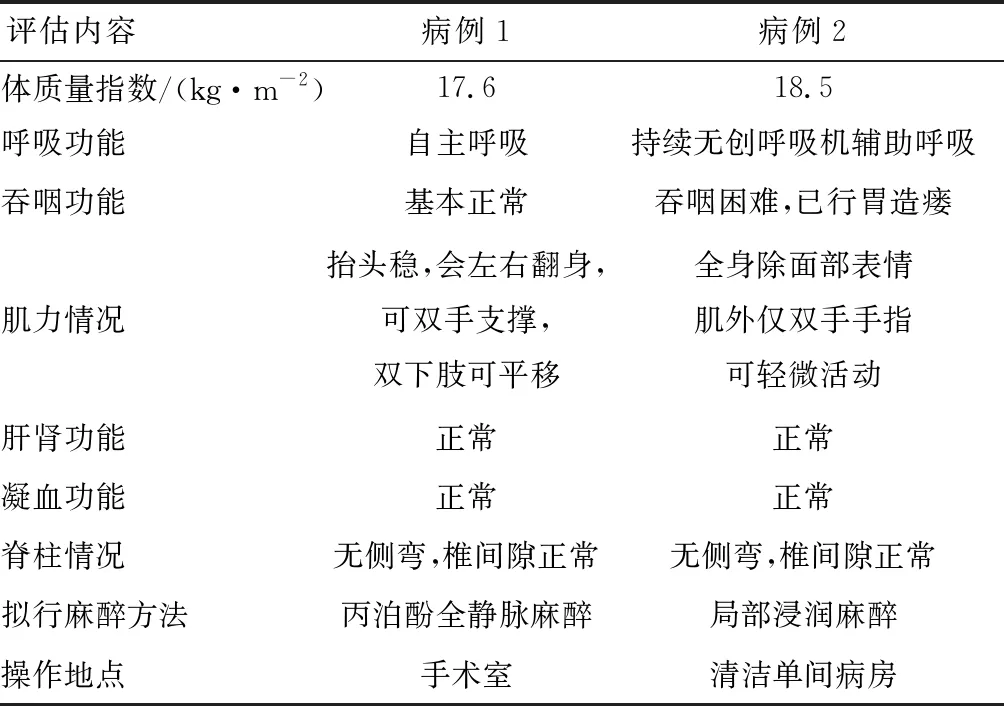
表2 两例Ⅰ型SMA患儿术前评估情况
1.2.2麻醉方法 病例1共进行2次鞘内注射治疗,均于丙泊酚(批号:19273050,德国贝朗公司)全静脉麻醉下完成,方法如下:患儿入手术室前予以静脉推注丙泊酚2.0 mg/kg,入睡后抱入手术室予以面罩给氧,监测心电图(electrocardiogram,ECG)、心率(heart rate,HR)、无创血压(noninvasive blood pressure,NIBP)、呼吸频率(respiratory rate,RR)、脉搏血氧饱和度(pulse oxygen saturation,SpO2)、呼气末二氧化碳(end-tidal carbon dioxide,ETCO2)及体温。术中以丙泊酚进行麻醉维持,穿刺点2%利多卡因(批号:71190612,上海禾丰制药有限公司)局部浸润麻醉,鞘内注射结束时停止丙泊酚泵注,患儿清醒后送恢复室观察0.5 h,呼吸循环均稳定后送返病房。
病例2共进行5次鞘内注射治疗,均于清洁单间病房内采用2%利多卡因局部浸润麻醉完成,全程无创呼吸机辅助呼吸,每10 min为患儿轻柔吸痰,保持呼吸道通畅,密切监测EEG,HR,R及SpO2,并让患儿观看熟悉的动画片以转移注意力。
2 结 果
2.1术中情况 两例患儿选择不同的麻醉方法,均顺利完成操作。病例1第1次操作丙泊酚维持量为300 μg·kg-1·min-1,由于摆体位时出现体动,后增加至500 μg·kg-1·min-1无再体动;第2次增加了脑电双频指数(bispectral,BIS)监测,丙泊酚维持量根据BIS值在300~500 μg·kg-1·min-1进行调节,维持BIS值50~60,操作过程中无体动。两次操作过程中呼吸循环平稳。病例2全程无体动,在每次进针行利多卡因局部浸润麻醉时HR短暂增快,并出现皱眉表情,很快即恢复,全程无创呼吸机辅助呼吸,术中最低SpO2为97%。两例患儿的术中情况见表3。
2.2并发症 病例1术后未出现恶心、呕吐、发热等并发症。病例2首次操作后6 h出现低热(36.7 ℃)以及呕吐数次,2周后第2次操作术后13 h 出现频繁呕吐,均予对症处理后好转,第3~5次术后未出现并发症。

表3 两例Ⅰ型SMA患儿鞘内注射术中情况
3 讨 论
SMA根据发病年龄和肌无力严重程度分为Ⅰ~Ⅳ型,其中60%的患者为严重致死的Ⅰ型[2]。患儿一般6月龄发病,表现为不能独坐,且由于严重肌张力减退及对称性肌无力导致无法支撑自己头部,通常于2岁内死于吸入性肺炎。近年来,随着呼吸系统疾病管理体系及支持疗法的完善,Ⅰ型患儿的平均存活时间有了显著提升。更令人欣喜的是,随着基因技术的快速发展,目前已经出现了特异性的治疗方法,美国食品与药品监督管理局2016年12月批准了特效治疗药诺西那生钠用于治疗SMA,给这类患儿的长期生存带来了希望。
诺西那生钠只能通过鞘内注射且极其昂贵,一旦从冰箱取出复温后必须及时使用。在笔者团队制定的操作流程中,腰椎穿刺(腰穿)成功并顺利抽出脑脊液后方能从冰箱取出药品交与家属签收,再经过3~5 min的复温(期间缓慢回抽4 mL脑脊液)及3~5 min的注射药物过程,预计操作总时间15~25 min。对于年龄较小的患儿,如何让患儿在操作期间安静配合,不出现可能导致针尖移位的体动,使药液能准确地完全注入鞘内,成为麻醉医师必须解决的问题。
笔者通过对两例Ⅰ型SMA的7次治疗过程,总结对Ⅰ型SMA患儿行诺西那生钠鞘内注射的麻醉管理要点:
3.1术前MDT SMA患儿全身的肌力情况均较差,尤其是Ⅰ型最为严重,常见呼吸功能不全甚至需要呼吸机支持。每次操作前进行MDT,详细评估术前情况,讨论并制定具体的麻醉方案、操作流程,研究各种可能发生的危急情况及应对预案,这对于操作顺利完成及尽量减少并发症的发生发挥了重要的作用。
3.2确定麻醉方式 对于SMA患者,全身肌力下降并可累及呼吸肌是与麻醉相关的最重要的病理生理特点,因此麻醉管理的重点和难点就是尽量减少对呼吸的干扰,维持呼吸功能。研究认为,对于小儿的腰穿,常规全身麻醉或镇静可减少儿童与手术相关的焦虑和疼痛,提高腰穿的总成功率[3]。腰穿疼痛刺激小,操作时间短,故非插管全麻完全可满足操作需要。2016年美国一项多中心研究中,共28位SMA患儿进行了73次的鞘内注射,均采用了非插管静脉麻醉[咪达唑仑,氯胺酮,芬太尼,瑞芬太尼和(或)丙泊酚]或非插管吸入麻醉(七氟醚,一氧化二氮),并未出现麻醉相关并发症[4]。
SMA是一种肌肉疾病,需考虑使用丙泊酚或卤化剂等麻醉剂增加恶性高热的风险。尽管有研究表明:在无家族史的情况下,麻醉剂引起SMA患儿横纹肌溶解的风险极小,其恶性高热的风险并不比正常人群高[5]。但也有学者指出,在儿童中使用全静脉麻醉的唯一绝对指征即为对恶性高热易感或者有明确家族史[6]。因此,对于SMA患儿,使用全静脉麻醉似乎是一种更好的选择。
病例1已经在日本接受了4次诺西那生钠负荷剂量治疗,均采用局部浸润麻醉。该患儿现肌力较前明显改善,可自主呼吸,会左右翻身,且家属代诉患儿在接受局部浸润麻醉下鞘内注射时已表现出焦虑、害怕。经MDT讨论后认为:如继续采用局部浸润麻醉的方法,不但难以避免患儿在操作过程中的焦虑和痛苦,而且难以保证操作过程中患儿保持良好的体位配合。因此,笔者团队在征得患儿家属同意后,决定在手术室采用丙泊酚全静脉麻醉,术中密切监测ETCO2和体温,并做好发生恶性高热的抢救预案。
病例2患儿术前已经需要持续使用无创呼吸机辅助通气,且患儿呼吸道分泌物多,无法有效吞咽与咳嗽,经MDT讨论后认为:无论是使用静脉麻醉还是吸入麻醉剂,均可能对其本已极其脆弱的呼吸功能带来严重影响。同时,患儿躯干完全不能活动,全身除面部表情肌外仅双手指可轻微活动,故不用担心操作中患儿会出现体动。因此,笔者团队在征得患儿家属同意后,决定在充分的局部浸润麻醉下完成操作。
3.3术中管理 病例1术前自主呼吸及吞咽能力可,能够自主翻身,术中管理的核心是维持合适的麻醉深度,既保证患儿操作过程中安静无体动,同时又尽量减少对患儿呼吸循环功能的影响。
使用丙泊酚镇静时,最安全的策略是从低剂量开始并根据镇静作用进行滴定。在Cho的研究中,使用2 mg/kg的丙泊酚静注并视镇静情况追加到每次0.5 mg/kg,直到足够的镇静深度即可对接受<30 min磁共振成像检查的儿童提供适当的镇静[7]。Bielsky在对8例Ⅱ型SMA患儿进行61次麻醉下诺西那生钠鞘内注射的研究中,丙泊酚的维持剂量为250~300 μg·kg-1·min-1[8]。因此,笔者采用2 mg/kg的丙泊酚作为诱导剂量,并以300 μg·kg-1·min-1进行维持。因患儿在摆体位时出现体动,故将维持量增加至500 μg·kg-1·min-1后,体动未再发生。分析与Bielsky的研究使用相同的维持剂量却出现镇静不足的可能原因:(1)使用的药物厂家不同,效价可能存在差异。(2)本研究中此例患儿存在营养不良(BMI为17.6 kg/m2)。Park等[9]的一项研究中,相对于正常BMI的患者,低BMI的克罗恩病患者在使用改良Marsh模型靶向输注丙泊酚时,以2.5~3.0 μg/mL的浓度要维持BIS在60以下所需的麻醉剂总量更大,这提示对于低BMI患者,要达到相同麻醉深度所需的静脉麻醉剂量更大。在行小手术的儿童中,BIS为镇静/镇痛深度提供了额外的、有用的监测指导工具[10]。因此,在第2次操作时,笔者增加了对BIS的监测,维持BIS值在60以下,操作全程无体动且呼吸循环平稳,苏醒时间迅速,提示对此类患儿使用BIS监测有助于维持合适的麻醉深度。
病例2术前需无创呼吸机维持呼吸,尽管局部浸润麻醉对呼吸及血流动力学影响小,但患儿口腔分泌物多且吞咽能力差,约15 min需进行一次口腔分泌物吸引,患儿的紧张、害怕及操作时引起的疼痛可能导致腺体分泌更加旺盛,易发生口腔分泌物梗阻上呼吸道。因此,尤其要关注呼吸状况,及时轻柔吸痰,并备好抢救设备。此类患儿一旦出现呼吸抑制,可行面罩加压辅助通气,尽量避免气管插管。另外,由于采用局部浸润麻醉,操作可于单间清洁病房内完成,在操作过程中可让父母陪同安慰或让患儿观看熟悉的动画片等缓解患儿紧张情绪。
3.4腰穿操作要点 由于麻醉科医师进行腰穿的经验较为丰富,国外许多报道均为麻醉科医师进行腰穿操作,也有部分由神经内科医师或小儿科医师完成。因此,建议根据对小儿腰穿的熟练程度进行选优,并预备候选人员。此外,由于大龄SMA患儿易伴有脊柱侧弯,可能带来穿刺困难。对此类患者,可床旁应用脊柱超声进行穿刺部位定位,有助于腰穿的成功,且可减少辐射暴露[11]。本研究两例患儿均未存在脊柱侧弯,故均采用左侧卧屈髋屈膝位,无借助床旁超声与X线辅助定位,均顺利完成鞘内注射。笔者的经验是操作者采取坐位,穿刺成功后,持针的左手肘部架于膝上,有利于保持手部的稳定,且保持腰穿成功后,穿刺针长时间稳定不移位。
3.5术后并发症预防 诺西那生钠鞘内注射主要不良反应有头痛、背痛和呕吐,亦可并发呼吸道感染、便秘、血小板减少症、凝血功能障碍,同时存在肾毒性风险[12]。病例2在首次鞘内注射术后6 h出现呕吐,经补液处理后缓解。笔者考虑呕吐原因与腰穿致脑脊液压力变化有关,故在后续操作中将推注药物时间从3 min延长至4 min,并在手术前日静脉补液,术后未再出现呕吐。此外,病例2患儿首次注射术后发热而其后几次术后未再发热,考虑与药物的免疫原性有关。随着治疗次数的增加,机体免疫系统对药物产生免疫耐受,不再发生抗原抗体反应[13]。本研究两例患儿年龄均较小,因此对于头痛、背痛无法评估。有学者认为,术后头痛均发生在术后72 h内,考虑低颅压综合征可能性大,但也不能完全排除诺西那生钠注射后引起脑血管反射性痉挛导致头痛[4]。
综上所述,Ⅰ型SMA患儿术前多存在呼吸功能不全、吞咽功能障碍及胃肠道功能障碍,行诺西那生钠鞘内注射时如何选择合适的麻醉方法及维持适宜的麻醉深度,尽量减少对患儿呼吸功能的影响是SMA患儿麻醉管理的核心。根据笔者经验:对于尚有四肢活动能力、不能配合且可能在穿刺中出现影响操作体动的患儿采取BIS监测下的丙泊酚静脉麻醉是一种安全有效的选择,不但可减少患儿体动导致注药不确切的风险,也可减少患儿的焦虑和痛苦。对于需要无创呼吸机辅助呼吸且躯干已经完全无活动能力的患儿,充分的局部浸润麻醉能够满足操作需求,且对患儿呼吸影响较小。
诺西那生钠鞘内注射治疗SMA才刚刚起步,截至2020年5月,全国已有30家医院参与“脊活新生”SMA患者援助项目。越来越多的SMA患者正在或准备接受诺西那生钠鞘内注射。本研究针对两例术前情况不同的患儿,选择不同的麻醉方式,均顺利完成治疗操作,为今后对类似病例的麻醉管理提供宝贵的经验。本研究的局限性在于病例数少、操作次数少,对于此类患儿的丙泊酚镇静合理剂量无法进行更进一步的研究,将来如果能对此类患儿进行BIS监测下的丙泊酚靶控输注,研究最佳的丙泊酚靶浓度及与BIS的相关性等,将大有裨益。
