重组人2型松弛素对人支气管上皮Bease-2B细胞上皮-间质转化的抑制作用的时间相关性研究
2020-12-14刘国清马继龙谢立波
刘国清 马继龙 谢立波
摘 要:目的:通过体外细胞实验探索重组人2型松弛素(RLN2)参与抑制转化生长因子-β1(TGF-β1)诱导支气管上皮细胞Bease-2B细胞的上皮-间质转化(EMT)过程。方法:本研究选取Bease-2B细胞株作为模式细胞,体外培养。1)通过观察细胞形态变化初步确定TGF-β1诱导浓度以及RLN2对TGF-β1诱导的Bease-2B细胞EMT的有效干预浓度;2)RLN2抑制TGF-β1诱导Bease-2B细胞EMT的时间:将细胞分别于TGF-β1诱导的同时和诱导24小时后加入RLN2培养24小时,及在TGF-β1诱导24小时后加入RLN2组分别作用24小时和48小时后:①通过观察细胞迁移能力推测RLN2不同作用时间对TGF-β1诱导的细胞EMT抑制效果;②通过Western bloting法检测各组间质标志ACTA2,上皮标志E-Cadhrin表达情况分析抑制效果与作用时间的关系。结果:1)观察细胞形态变化:与正常组比,10ng/mL TGF-β1诱导组Bease-2b细胞由铺路石状上皮形态逐渐变成梭形、针叶型,且细胞之间的间隙变大,胞间的连接变得松散;加不同浓度的RLN2抑制细胞48小时后,与单纯TGF-β1组相比,梭形形态的细胞减少,部分恢复铺路石状上皮形态,但细胞间连接仍然松散,其中TGF-β1同时加RLN2 80ng/mL组表现明显。2)迁移能力,各组与单纯TGF-β1诱导组比较平均迁移距离均减小,诱导24小时后加RLN2抑制组比诱导抑制同时进行的组的迁移距离大,诱导24小时后加RLN2培养48小时组比抑制24小时组迁移距离小。3)Western bloting检测分析抑制效果与时间的关系:单纯RLN2组和正常组比较E-Cadhrin和ACTA2蛋白的表达均无显著性差异;各组与单纯TGF-β1组比较E-Cadhrin表达量均增加,ACTA2蛋白的表达减少;诱导抑制同时进行的组与诱导24小时后加RLN2抑制组比较E-Cadhrin表达量增加,ACTA2蛋白的表达减少;诱导24小时后加RLN2培养48小时抑制组比抑制4小时组ACTA2蛋白的表达少,E-Cadhrin表达量无差别。结论:①TGF-β1可诱导支气管上皮细胞转分化为间质细胞。②松弛素可在一定程度上抑制TGF-β1诱导的EMT过程且与作用时间相关。③松弛素可能通过抑制TGF-β1诱导的EMT过程发挥抗纤维化作用。
关键词:2型松弛素;上皮间质转化;转化生长因子β1;Bease-2B细胞
儿童支气管哮喘、闭塞性细支管炎、反复呼吸道感染等疾病常导致气管、支气管及其周围的慢性炎症,长期反复的炎症刺激和上皮损伤最终会导致细支气管黏膜、黏膜下和管壁外周的纤维化和小气道的重塑[1],严重的气道重塑可致气道狭窄甚至阻塞,引起肺功能不全。覆盖于气道表层的上皮,在反复的损伤和不良刺激下会导致上皮细胞的完整性和固有特性被打乱和重排,发生形态和功能的改变,上皮细胞间质转化(EMT)就是其中之一,近年国内外研究表明肺泡上皮细胞-间质细胞转分化是气道纤维化的重要机制之一[2]。松弛素(RLN)是一类功能广泛的细胞因子,越来越多的证据表明RLN具有抗纤维化作用[3],其作用可能主要是通过抑制TGF-β1的活性,从而抑制成纤维细胞的增殖、分化,和抑制胶原的合成、分泌和沉积达到的。本研究通过TGF-β1诱导的支气管上皮细胞的体外上皮间质转化实验探讨重组人2型松弛素对支气管上皮细胞间质转化抑制作用的时间相关性。
1 材料
Bease-2B细胞购自中国科学院细胞典藏库,重组人2型松弛素美国Peprotech公司生产,重组人TGF-β1上海近岸蛋白科技公司生产,E-cadherin抗体、α-SMA抗体Proteintech公司生产,DMI3000B荧光倒置显微镜购自德国徕卡仪器公司。
2 方法
2.1 Bease-2B细胞的常规培养和实验前处理
采用含10%胎牛血清的RPMI1640完全培养基培养基,37℃恒温、5%CO2、饱和湿度的培养条件。常规培养细胞和传代。选择对数生长期的细胞,在传代过程中逐渐降低培养液的胎牛血清含量,选择适应4%FBS的培养基的细胞接种于六孔板常规培养,至细胞融合度达到70%左右时,换为含1%FBS的完全培养液培养12h,然后进行后续实验。
2.2 Bease-2B细胞的向间质细胞转化
通过文献得知,5ng/mL、10ng/mL的TGF-β1可以在体外诱导支气管上皮细胞转化为间质细胞[4,5];经过实验观察得出10ng/mL的TGF-β1培养48h及以上,可诱导支气管上皮细胞(Bease-2B)明显转化为间质细胞表型,即细胞从鹅卵石样逐步转变成梭形或长条形,转化成功率高。
2.3 显微镜观察不同浓度RLN2对TGF-β1诱导细胞转化的影响
经过查文献得知,以往松弛素在体外细胞实验中的浓度是10ng/mL、100ng/mL[6,7],本研究通过细胞实验和显微镜下观察细胞形态,初步确定80ng/mL的RLN2对TGF-β1诱导的上皮细胞转化的抑制明显,且对细胞存活干扰较小。
2.4 RLN2作用時间对TGF-β1诱导细胞迁移能力的影响
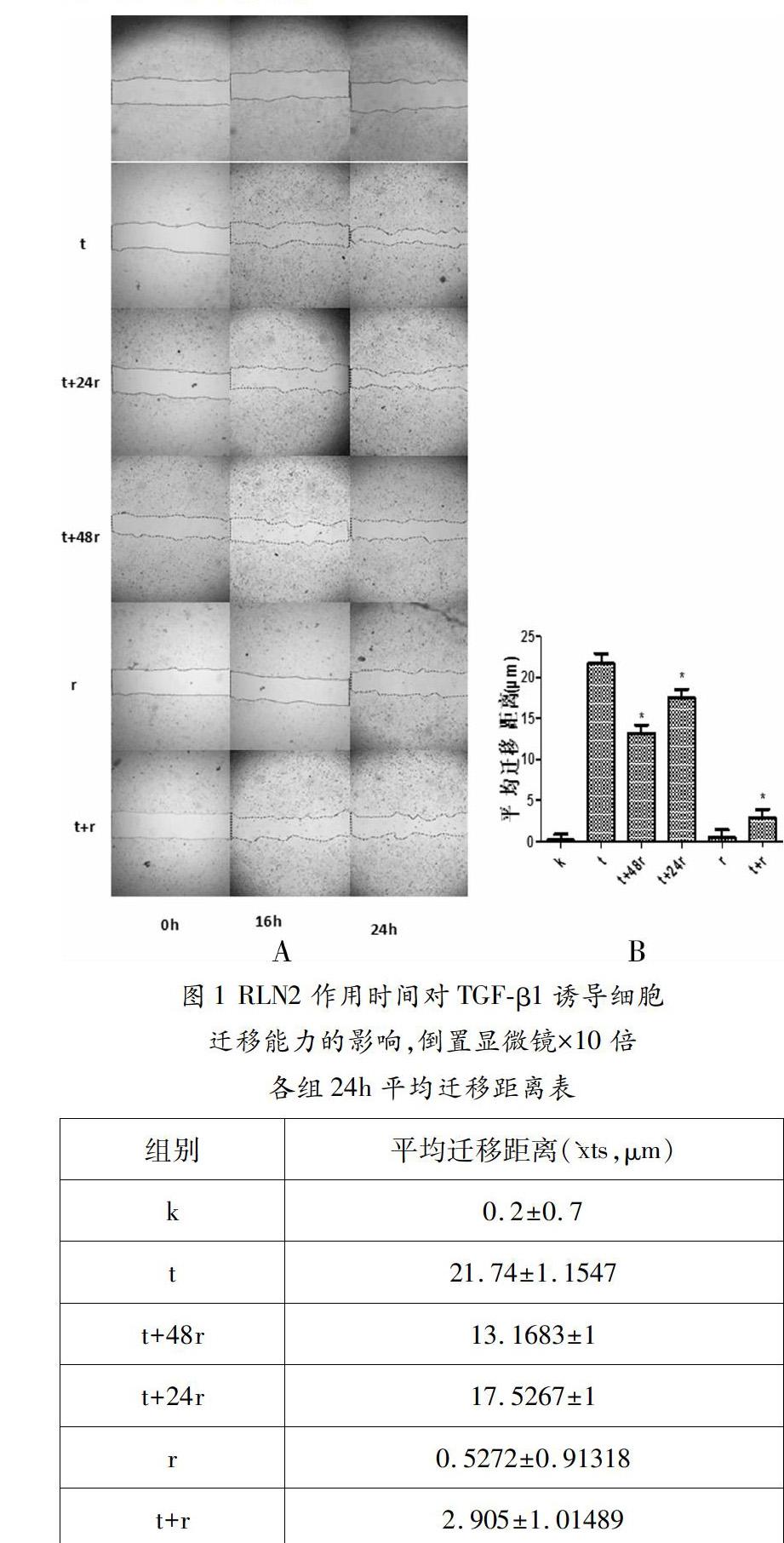
稳定传代饥饿处理好的细胞分六组并编号k、t、t+48r、t+24r、r、t+r,k组换为1%FBSRPMI1640培养基,t、t+48r、t+24r组换为含10ng/mL TGF-β1的1%FBS培养液,t+r组为含80ng/mL RLN2及10ng/mL TGF-β1的FBS培养液,r组只含80ng/mL RLN2的FBS培养液,连续培养24h后,用无菌200μL移液器枪头在细胞层垂直六孔板做3条平行划痕,t+24r、t+48r组改为含80ng/mL RLN2及10ng/mL TGF-β1的1%FBS培养液,其他组所换培养液不变,t+24r组继续培养24h,t+48r组培养48h,置于倒置显微镜下观察并照相记录,并用记号笔圈标显微镜在六孔板盖上的光斑,作为后续观察记录点,以后每隔8h观察记录一次,结果如图1A所示。利用ImageJ2软件,测量划痕俩侧细胞间距,对24h后细胞迁移的距离进行统计分析。
2.5 Western blotting法检测Bease-2B细胞在经过TGF-β1和RLN2处理不同时间后E-Cad、ACTA2蛋白的表达情况
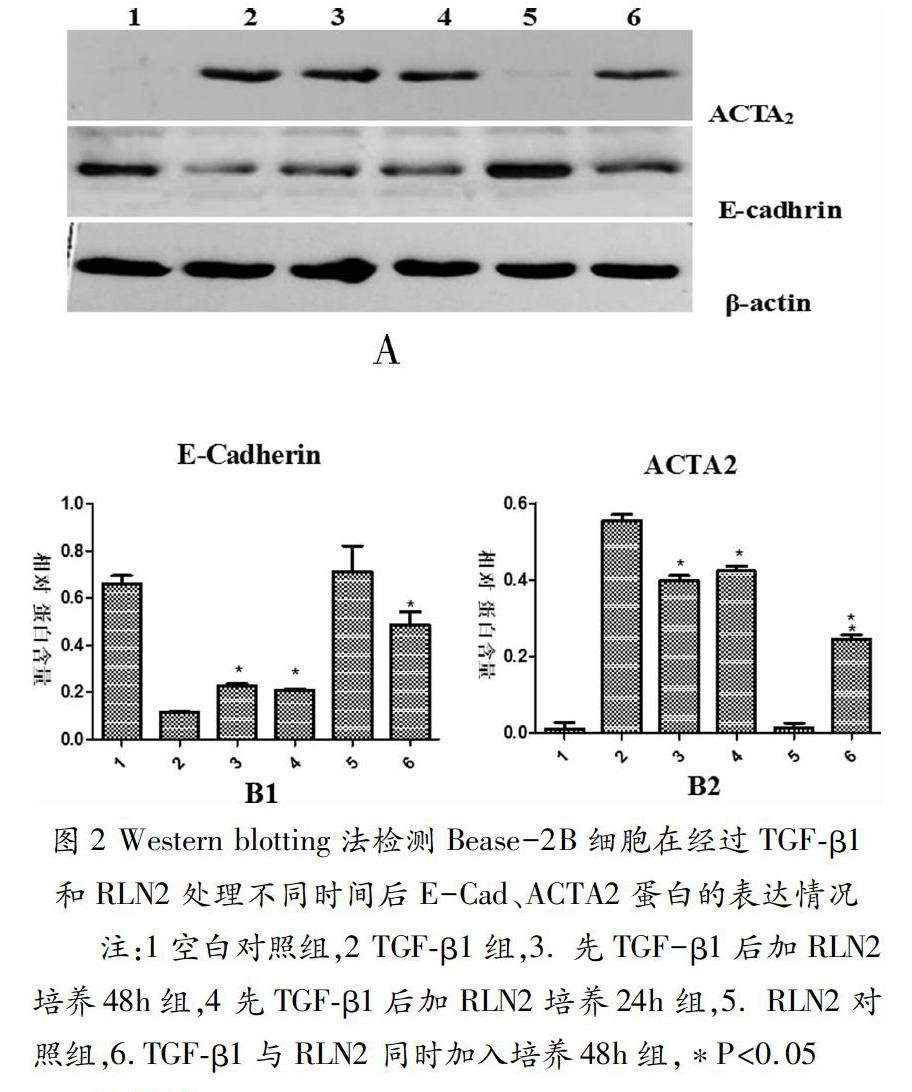
稳定传代饥饿处理好的细胞分六组并编号k、t、t+24r、t+48r、r、t+r,k组换为1%FBSRPMI1640培养基,t、t+24r、t+48r组换含10ng/mL TGF-β1的1%FBS培养液,t+r组换含80ng/mL的RLN2及10ng/mL的TGF-β1的1%FBS培养液,r组换含80ng/mL的RLN2的1%FBS培养液,连续培养24h后,t+24r、t+48r组改为含80ng/mL RLN2及10ng/mL TGF-β1的FBS培养液,其他组所换培养液不变,t+24r组持续培养24h,t+48r组继续培养48h。最后提蛋白进行Western blotting检测,结果见图2A,用ImageJ图像分析软件测条带的灰度后,分别用E-Cadhrin蛋白和ACTA2蛋白的灰度条带参数值除以β-actin蛋白条带的灰度参数值得出相对蛋白含量,结果见图2B。
图2 Western blotting法检测Bease-2B细胞在经过TGF-β1和RLN2处理不同时间后E-Cad、ACTA2蛋白的表达情况
注:1空白对照组,2 TGF-β1组,3. 先TGF-β1后加RLN2培养48h组,4 先TGF-β1后加RLN2培养24h组,5. RLN2对照组,6.TGF-β1与RLN2 同时加入培养48h组,*P<0.05
3 结果
3.1 RLN2作用时间对TGF-β1诱导细胞迁移能力的影响
各组的平均迁移距离分别为:0.20±0.70μm、21.74±115μm、13.17±1.10μm、17.53±1.00μm、0.52±0.91μm、291±1.01μm,单纯松弛素r组和空白组两者对照无显著性差异(P>0.05),各组跟单纯TGF-β1诱导的t组比较平均迁移距离均减小(P<0.05),诱导24小时后加RLN2抑制的t+48r组与诱导和抑制同时进行的t+r组比较迁移距离增加(P<0.05),诱导24小时后加RLN2培养48小时抑制的t+48r组与培养24小时抑制的t+24r组比较迁移距离减少(P<0.05),见图1B。另外在长时间的饥饿培养过程中由于细胞的死亡空白组的划痕间距有所增宽,而在相同培养时间里单纯应用RLN2的组细胞死亡数量较少,此现象可能是因为RLN2提高了细胞在饥饿培养中的耐受力。
3.2 Western blotting法检测Bease-2B细胞在经过TGF-β1和RLN2处理不同时间后E-Cad、ACTA2蛋白的表达情况
单纯RLN2组和空白对照组两者比较E-Cadhrin蛋白和ACTA2蛋白的表达无显著性差异(P>0.05);各组与单纯TGF-β1组比较E-Cadhrin蛋白表达量均增加(P<0.05),ACTA2蛋白的表达减少(P<0.05);诱导和抑制同时进行的t+r组与诱导48小时后加RLN2抑制的t+48r组比较E-Cadhrin蛋白表达量增加(P<0.05),ACTA2蛋白表达减少(P<0.05);诱导24小时后加RLN2培养48小时抑制的t+48r组与培养24小时抑制的t+24r组比较E-Cadhrin蛋白表达无差别(P>0.05),ACTA2蛋白表达减少(P<0.053)见图2。
4 讨论
目前肺部纤维化中的EMT的调控机制尚不完全清楚,TGF-β1是目前确认可以引起上皮间质转变的因素之一[2],成纤维细胞、上皮细胞等多种细胞均可以合成产生TGF-β1并依靠旁分泌和或自分泌的形式调控细胞的增殖、分化、迁移,细胞外基质的代谢、组织损伤修复等。在气道慢性疾病发展过程中,长期反复的上皮损伤和炎症刺激会诱导上皮细胞及病灶中浸润的炎症相关细胞分泌TGF-β1,TGF-β1受体激活后可抑制细胞上皮特征的基因表达,同时上调纤维化特异性基因的表达,进而影响细胞骨架与细胞黏附分子的功能,促使上皮细胞向间质细胞转化[8],最终上皮细胞失去其上皮表型,例如上皮细胞E钙粘素(E-Cadherin)、角蛋白等上皮细胞标志物表达丢失,并获得间质细胞的表型特征,例如-平滑肌肌动蛋白(ACTA2)等间质细胞标志物表达上调[9]。
松弛素是一类功能广泛的细胞因子,随着研究的深入,发现RLN具有较强的抗纤维化作用,其抗纤维化可能主要是通过抑制TGF-β1的活性,从而抑制成纤维细胞的增殖、分化,抑制胶原的合成、分泌和沉积达到的。目前已有大量的研究证实RLN在心脏、肝脏等全身多个器官有广泛的表达,并能抑制这些器官的纤维化的进展[10]。
本研究开始用不同剂量的松弛素用于TGF-β1对Bease-2B细胞的诱导过程,通过对细胞形态学上的观察发现,10ng/mL的TGF-β1诱导Bease-2B细胞24h后可观察到有大量细胞发生形态变化,诱导48h后细胞明显向间质细胞形态转化。在TGF-β1诱导同时加RLN2 80ng/mL的组抑制细胞形态变化最为明显,本研究分别在加入TGF-β1同时和加入TGF-β1 24h后加入RLN2,并且分别在RLN2作用达到24h和达到48h时检测细胞的迁移距离以及E-cadhrin、ACTA2两种细胞标志蛋白的表达情况。实验结果显示:各组与TGF-β1组比较迁移能力均较弱,E-Cadhrin表达量高,ACTA2蛋白的表达量低,可认为80ng/mLRLN2作用24h可以抑制TGF-β1对上皮细胞的诱导作用;与同加入TGF-β1和RLN2的组比较,在加入TGF-β1培养24h后再加入RLN2的两组,迁移能力均较强且E-Cadhrin表达量较低,ACTA2蛋白的表达量较高,说明在诱导早期加入的抑制转化效果要高于诱导后期;用RLN2作用48h和作用24h的两组比较,作用48小时的组迁移能力略强,ACTA2蛋白的表达量略减少(P<0.053),但两组E-Cadhrin的表达量无差别(P>0.05),说明RLN2对TGF-β1诱导上皮转化可能存在一定的时间依赖性,由于诱导上皮间质转化的实验是在细胞饥饿条件下进行的,随着饥饿培养的时间的延长,细胞耐受力下降,实验误差增大,所以对于RLN2抑制TGF-β1诱导上皮间质轉化的时间依赖性实验尝试尚有待于改良。
