结核分枝杆菌H37Rv株急性感染豚鼠模型的研究
2020-12-14康健许承明张薇柏银兰韩文东孙志平徐志凯王丽梅
康健 许承明 张薇 柏银兰 韩文东 孙志平 徐志凯 王丽梅
[摘要] 目的 建立結核分枝杆菌(Mtb)H37Rv株急性感染豚鼠模型的方法。 方法 18只豚鼠按随机数字表法分为6组:空白剂量组、皮下高剂量组、皮下低剂量组、滴鼻高剂量组、滴鼻中剂量组和滴鼻低剂量组,每组3只。皮下高、低剂量组采用腹股沟皮下注射的方式分别感染2×106 CFU/200 μL和1×106 CFU/200 μL的Mtb H37Rv PBS悬液。滴鼻高、中、低剂量组采用滴鼻的方式分别感染5×105、5×104 CFU/50 μL和5×103 CFU/50 μL的Mtb H37Rv PBS悬液。感染4周后,检测各组豚鼠的肺脾荷菌数和组织病理学改变情况。 结果 感染4周后,皮下高剂量组的肺、脾Mtb荷菌数均高于皮下低剂量组,差异有统计学意义(P < 0.05)。感染4周后,皮下高剂量组的肺Mtb荷菌数高于滴鼻高剂量组,差异有统计学意义(P < 0.05)。感染4周后,皮下高、低剂量组和滴鼻高剂量组豚鼠的肺组织有明显充血,肺泡壁间隔增厚,滴鼻中、低剂量组豚鼠的肺组织仅有轻微充血。感染4周后,各组豚鼠脾组织病理变化不明显。 结论 采用腹股沟皮下感染的方式成功建立H37Rv株急性感染豚鼠模型,为结核病新型疫苗和药物的研究奠定了基础。
[关键词] 结核分枝杆菌;豚鼠;动物模型;急性感染
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2020)10(c)-0020-04
Study on guinea pig model of acute infection with Mycobacterium tuberculosis H37Rv strain
KANG Jian1 XU Chengming1 ZHANG Wei2 BAI Yinlan1 HAN Wendong3 SUN Zhiping3 XU Zhikai1 WANG Limei1
1.Department of Microbiology and Pathogenic Biology, Air Force Military Medical University, Shaanxi Province, Xi′an 710032, China; 2.Department of Pediatric, Tangdu Hospital, Air Force Military Medical University, Shaanxi Province, Xi′an 710032, China; 3.the Third Level Biosafety Laborator, Fudan University, Shanghai 200032, China
[Abstract] Objective To establish a guinea pig model of acute infection with Mycobacterium tuberculosis (Mtb) H37Rv strain. Methods Eighteen guinea pigs were divided into six groups: blank-dose group, subcutaneous high-dose group, subcutaneous low-dose group, intranasal high-dose group, intranasal middle-dose group and intranasal low-dose group according to random number table method. There were three guinea pigs in each group. Subcutaneous high-dose group and subcutaneous low-dose group was infected with Mtb H37Rv PBS suspension of 2×106 CFU/200 μL and 1×106 CFU/200 μL respectively. Intranasal high-dose group, intranasal middle-dose group and intranasal low-dose group was infected with Mtb H37Rv PBS suspension of 5×105, 5×104 CFU/50 μL and 5×103 CFU/50 μL respectively. After four weeks of infection, the number of bacteria and histopathological changes of lung and spleen in each group were detected. Results After four weeks of infection, the number of Mtb in lung and spleen of subcutaneous high-dose group was higher than that of subcutaneous low-dose group (P < 0.05). After four weeks of infection, the number of Mtb in lung of subcutaneous high-dose group was higher than that of intranasal high-dose group (P < 0.05). After four weeks of infection, the lung tissues of guinea pigs in subcutaneous high-dose group, subcutaneous low-dose group and intranasal high-dose group were obviously congested and the alveolar wall were thickened; the lung tissue of guinea pigs in intranasal middle-dose group and intranasal low-dose group had only slight hyperemia. After four weeks of infection, the pathological changes of spleen tissue in each group were not obvious. Conclusion The guinea pig model of acute infection with Mtb H37Rv is established successfully, which provides the research foundation for novel tuberculosis vaccines and new drugs.
[Key words] Mycobacterium tuberculosis; Guinea pig; Animal model; Acute infection
目前,结核分枝杆菌(Mtb)感染所致的结核病(TB)仍是危害全球人类健康的重大传染病。目前全球每年约有150万人死于TB,新发TB患者约1000万例[1]。TB的致病机制、诊断、新型药物和疫苗研究成为当前世界各国重要的科学研究课题[2]。动物模型是研究人类疾病的重要工具,TB动物模型研究种类较多,包括小鼠、豚鼠、兔子、猴子和其他灵长类动物等,各种动物各有优缺点,能够模拟人类TB的不同特点[3-4]。豚鼠对Mtb高度敏感,感染后在肺部病理学上的特征与人类TB肺部特征表现较为相似,能够形成典型的肉芽肿炎性结构,并可发展为干酪样坏死,是建立TB动物模型的较佳选择[5-6]。Mtb感染豚鼠的方法较为普遍的是采用气溶胶和腹股沟皮下注射两种方法[7-9]。然而,由于目前我国尚缺乏能够进行Mtb气溶胶感染动物的生物安全三级实验室,但为了能更好地模拟Mtb自然感染的过程,本研究选择腹股沟皮下注射和滴鼻感染两种方式,采用Mtb标准株H37Rv,通过不同感染剂量和感染途径探索建立H37Rv急性感染豚鼠模型的制备方法,以期为TB新型疫苗和药物的研究提供研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株 Mtb H37Rv株来自陕西省结核病防治研究所,并在本实验室传代保存。
1.1.2 培养基 Middlebrook 7H9液体培养基、7H10固体培养基、培养基添加剂(OADC)均购自BD公司。
1.1.3 生化试剂 4%多聚甲醛(pH 7.4),0.4% PBS-Tween 80,L-抗坏血酸均购于上海生工,戊巴比妥钠购于西安科昊公司。
1.1.4 主要仪器 生物安全柜CELLGARD475(NuAire公司),换笼柜NU-602(NuAire公司),震荡破碎器MSD 220V(Densply公司),-80℃超低温冰箱(Sanyo公司),恒温培养箱(上海康华生化仪器制造有限公司)。
1.1.5 实验动物 SPF级Hartley雌性豚鼠18只,6周龄,体重200~300 g,购于中国食品药品检定研究所[许可证号SCXK(京)2009-0017]。动物实验均在复旦大学三级(BSL-3)生物安全实验室(认可编号:CNAS BL0021,卫:BSL3-010)中进行。豚鼠在独立通风笼具中饲养,自由取食饮水,饮水中添加6 mg/L浓度的L-抗坏血酸。每日记录观察豚鼠活动情况,记录体重一次。喂养动物房间通风良好,按昼夜节律采光12 h,保持室温18~22℃、湿度40%~70%。实验过程中供给专用豚鼠饲料及含有L-抗坏血酸饮水,并按实验动物使用的“3R”原则给予人道的关怀。
1.2 方法
1.2.1 Mtb菌液制备 Mtb H37Rv株保存菌种复苏后接种于7H9液体培养基,37℃静置培養3周,将培养后的菌液制备成分散的菌悬液后,1 mL分装,-80℃保存,使用前平板法做细菌CFU计数。
1.2.2 动物分组和感染 将豚鼠按随机数字表法分为6组,分别为空白剂量组、皮下高剂量组(2×106 CFU/200 μL)、皮下低剂量组(1×106 CFU/200 μL)、滴鼻高剂量组(5×105 CFU/50 μL)、滴鼻中剂量组(5×104 CFU/50 μL)和滴鼻低剂量组(5×103 CFU/50 μL),各组3只豚鼠[10-11]。将-80℃保存的Mtb H37Rv菌悬液在室温下自然溶解,按已知活菌数稀释浓度至各组应用浓度。各浓度菌悬液在使用前短暂超声分散菌体。皮下高、低剂量组采用腹股沟皮下注射的方式分别感染2×106 CFU/200 μL和1×106 CFU/200 μL的Mtb H37Rv PBS悬液。滴鼻高、中、低剂量组采用滴鼻的方式分别感染5×105、5×104 CFU/50 μL和5×103 CFU/50 μL的Mtb H37Rv PBS悬液。滴鼻组豚鼠首先经腹腔注射3%戊巴比妥钠250 μL/只麻醉后,仰卧,使其鼻孔向上,用移液器向双侧鼻孔各滴入25 μL菌液,保持豚鼠体位约1 min,使液体流入下呼吸道。
1.2.3 动物解剖和标本处理 感染后4周,各组豚鼠用3%戊巴比妥钠1.0 mL腹腔注射麻醉后解剖,无菌取豚鼠脾、肺,PBS冲洗,取脾和左肺尖部少量组织放入4%多聚甲醛固定液中保存,经脱水、石蜡包埋、切片及脱蜡等步骤后进行HE染色,观察脏器的组织病理改变情况。剩余脾肺组织分别置于细胞滤网上,加入10 mL的PBS,注射器针芯研磨,收集细胞悬液至15 mL离心管,混匀后做10-1、10-2、10-3系列稀释。分别取各稀释度细胞悬液100 μL涂布于7H10平板上,每个稀释度设两个复板,置于37℃孵箱培养3周后计数菌落CFU。按照下列公式计算脏器荷菌量(lgCFU)=log10[平板CFU数×计数部分脏器比重(全脏器重量/计数部分脏器重量)×研磨液稀释倍数(研磨液体积/涂布液体积)]。
1.3 统计学方法
采用Graphpad Prism 5软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
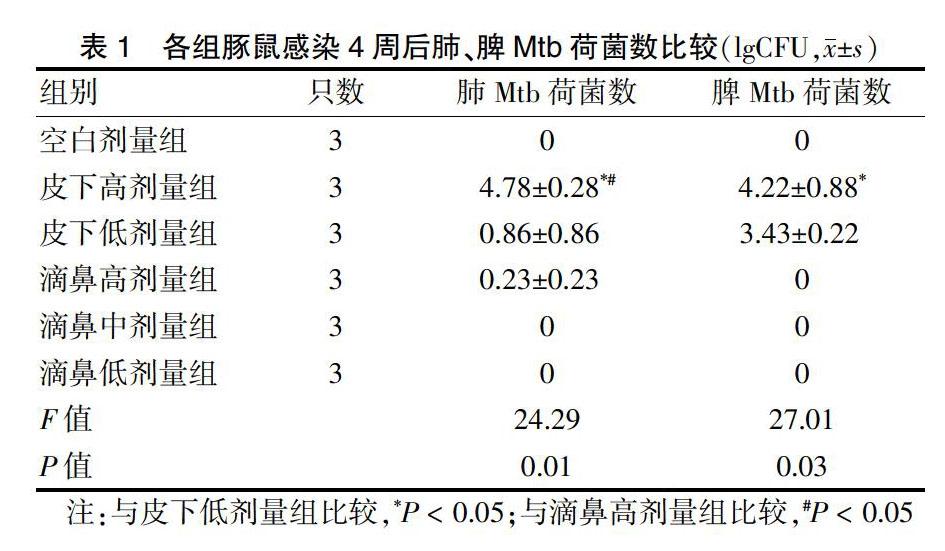
2.1 各组豚鼠感染4周后肺、脾Mtb荷菌数比较
感染4周后,皮下高剂量组的肺、脾Mtb荷菌数均高于皮下低剂量组,差异有统计学意义(P < 0.05)。感染4周后,皮下高剂量组的肺Mtb荷菌数高于滴鼻高剂量组,差异有统计学意义(P < 0.05)。见表1。
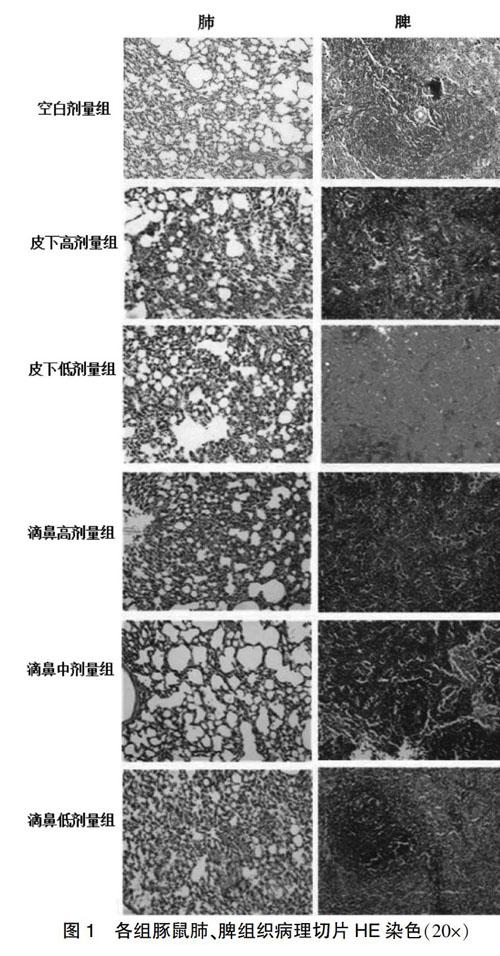
2.2 各组豚鼠肺、脾组织病理学结果
感染4周后,皮下高、低剂量组和滴鼻高剂量组豚鼠的肺组织有明显充血,肺泡壁间隔增厚,滴鼻中、低剂量组豚鼠的肺组织仅有轻微充血。感染4周后,各组豚鼠脾组织病理变化不明显。见图1。
3 讨论
动物模型的建立涉及多方面因素的影响,如动物品种、感染菌毒力、感染剂量、感染途径、感染时间以及操作者的技术经验等[12-13]。Mtb H37Rv株为Mtb的标准毒株,与其他Mtb毒株比较,用Mtb H37Rv株建立豚鼠Mtb感染模型,有利于模型在不同实验室间的重复性和一致性,并有利于TB新型药物和疫苗在动物模型中的评价比较研究[14]。
脏器荷菌量和脏器病理改变是目前TB动物模型的主要评价指标[15-16],尤其是对于豚鼠这类免疫检测试剂相对较少的动物。豚鼠是Mtb敏感动物模型[17-19],前期研究发现,当皮下感染剂量较高时,豚鼠感染模型的死亡率较高,不利于后期TB疫苗和药物的評价筛选(数据未发表),但当感染剂量较低时,豚鼠脾肺的脏器荷菌量又较低,疾病进程较慢,豚鼠饲养时间较长,体型变大,也不利于后续的实验研究。因此,为了建立Mtb H37Rv株急性感染豚鼠模型的方法,本研究设置了不同的感染剂量,经皮下和滴鼻两种途径进行感染,并在感染后4周对豚鼠的感染结果进行检测。结果提示,豚鼠经腹股沟皮下途径感染,剂量为4×105 CFU时,其脾、肺组织中的Mtb会发生显著增殖,且肺组织会发生明显的病理学改变,提示Mtb急性感染豚鼠模型制备成功。皮下低剂量组(剂量为4×105 CFU)感染豚鼠的脾肺中虽然也有一定的Mtb荷菌量,但数量较低,Mtb在组织中并未发生明显增殖。不过该结果也提示,采用皮下方式感染,豚鼠的脏器荷菌量与初始感染剂量能呈现较好的一致性。
与皮下注射感染的方式比较,经滴鼻途径的感染能更好地模拟Mtb自然感染[20-21]。本研究设置了高(5×105)、中(5×104)、低(5×103)三个剂量进行滴鼻感染,结果发现,只有当感染剂量达到5×105 CFU时,才可在豚鼠的肺脏中检测到少量的Mtb荷菌数,但脾组织中的Mtb荷菌数仍为0,提示豚鼠的呼吸道黏膜免疫系统对Mtb具有一定的抵抗。虽然本研究尚未建立H37Rv株经滴鼻方式急性感染豚鼠的合适剂量,然而实验过程中发现,经滴鼻方式感染豚鼠的个体差异较大,一致性较差,但经滴鼻方式感染,Mtb主要侵入豚鼠的肺部,较皮下感染能更好地模拟Mtb的自然感染。
另外,本研究还发现,采用皮下感染方式建立的豚鼠动物模型重复性和一致性较好。采用滴鼻方式感染豚鼠,虽然豚鼠感染个体的一致性较差,但能较好地模拟Mtb自然感染。因此,在制备Mtb感染豚鼠模型时,应根据实验目的选择合适的感染方式,如用于TB新型药物和疫苗的保护效果评价,感染动物模型的脏器荷菌量和病理学改变是关键的评价指标,选择腹股沟皮下感染的方式进行动物模型制备,有利于疫苗的评价筛选[22-23];而如果是进行TB的致病机制和保护性免疫的机制研究,则动物模型的感染途径应尽可能模拟Mtb的自然感染途径,如滴鼻,不仅可以诱发呼吸道局部黏膜免疫,而且可以刺激全身系统性免疫[24-25],有利于准确反映疫苗的免疫保护机制。
总之,本研究通过腹股沟皮下感染的方式成功建立了Mtb急性感染豚鼠的动物模型,为TB新型疫苗和药物的筛选评价提供了研究平台。由于实验条件等的限制,本研究未进一步探索通过滴鼻方式建立急性感染豚鼠动物模型的方法,还有望今后的进一步研究。
[参考文献]
[1] Global tuberculosis report 2017 [D/OL]. http://www.who.int/tb/en/.
[2] Gupta UD,Katoch VM. Animal models of tuberculosis [J]. Tuberculosis(Edinb),2005,85(5-6):277-293.
[3] Zhan L,Tang J,Sun M,et al. Animal models for tuberculosis in translational and precision medicine [J]. Front Microbiol,2017,8:717.
[4] 师长宏,徐志凯,范雄林.结核分枝杆菌感染的动物模型[J].国外医学:微生物学分册,2004,27(4):31-34.
[5] Kashino SS,Napolitano DR,Skobe Z,et al. Guinea pig model of Mycobacterium tuberculosis latent/dormant infection [J]. Microbes Infect,2008,10(14-15):1469-1476.
[6] Myllym?覿ki H,Niskanen M,Oksanen KE,et al. Animal models in tuberculosis research—where is the beef? [J]. Expert Opin Drug Discov,2015,10(8):871-883.
[7] 黎友伦,王国治,罗永艾.结核分枝杆菌潜伏感染动物模型及评价[J].中华结核和呼吸杂志,2005,28(8):552-554.
[8] 肖和平.耐药结核病化学治疗指南(2009)[J].中华结核和呼吸杂志,2010,33(7):485-497.
[9] 董江涛,张万江.结核分枝杆菌感染小鼠动物模型的建立及研究进展[J].中国病原生物学杂志,2011,6(8):621-623.
[10] 卢锦标,邓海清,陈保文,等.结核分枝杆菌潜伏感染豚鼠模型的建立和验证[J].中华微生物学和免疫学杂志,2013,33(12):900-905.
[11] Zhang Y,Yew WW,Barer MR. Targeting persisters for tuberculosis control [J]. Antimicrob Agents Chemother,2012,56(5):2223-2230.
[12] Wang P,Wang L,Zhang W,et al. Immunotherapeutic efficacy of recombinant Mycobacterium smegmatis expressing Ag85B-ESAT6 fusion protein against persistent tuberculosis infection in mice [J]. Hum Vaccin Immunother,2013,10(1):1-9.
[13] Steven C,Derrick,Idalia M,et al. Immunogenicity and protective efficacy of novel Mycobacterium tuberculosis antigens [J]. Vaccine,2013,31(41):4641-4646.
[14] 張昊凌,张志勇.结核分枝杆菌感染动物模型的研究进展[J].微生物与感染,2012,7(3):184-189.
[15] 王应辉,王洪海,曹健,等.潜伏性结核分枝杆菌感染动物模型[J].中国感染控制杂志,2011,10(4):312-315.
[16] 王豫萍,王和.结核分枝杆菌稳定L型致病性的研究[J].上海医学检验杂志,2001,16(z1):14-16.
[17] 路延之,王丽梅,康健,等.结核分枝杆菌亚单位疫苗Ag85b-ESAT-6+Hsp65-IL-2的安全性评价研究[J].中国人兽共患病学报,2016,32(11):945-951.
[18] 王平,王丽梅,张薇,等.结核分枝杆菌Ag85B-ESAT-6融合蛋白重组耻垢分枝杆菌对小鼠的免疫原性研究[J].中国防痨杂志,2012,34(3):145-149.
[19] 宁唤唤,路延之,康健,等.分枝杆菌持续感染小鼠模型的建立及其特征分析[J].中国病原生物学杂志,2017, 12(3):219-223.
[20] 黎友伦,陈保文,徐苗,等.结核分枝杆菌潜伏感染豚鼠模型的建立[J].中华结核和呼吸杂志,2010,33(9):684-687.
[21] 卢锦标,杨蕾,苏城,等.重组AEC/BC02疫苗联合化疗在豚鼠模型中的抗结核效果[J].中华微生物学和免疫学杂志,2018,38(6):414-419.
[22] 张晓东,王洪生.结核分枝杆菌感染动物模型的研究进展[J].国际皮肤性病学杂志,2012,38(3):190-193.
[23] 李定越,卢润生,蒋绍双.结核病实验动物模型[J].四川医学,2003,24(7):761-762.
[24] Hernfndez-Pando R,Pavon L,Orozcoe H,et al. Correlation between the kinetics of Thl,Th2 cells and pathology in a murine model of experimental pulmonary tuberculosis [J]. Immunology,1996,89(1):26-33.
[25] Dorhoi A,Reece ST,Kaufmann SH. For better or forworse:the immune response against Myeobacterium tuberculosis balances pathology and protection [J]. Immunol Rev,2011,240(1):235-251.
(收稿日期:2020-04-15)
[基金项目] “艾滋病和病毒性肝炎等重大传染病防治”科技重大专项(2012ZX10003008-007)。
通讯作者
