潜阳合剂抑制心肌成纤维细胞增殖的机制研究
2020-12-14陈婕阮小芬王肖龙
陈婕 阮小芬 王肖龙

[摘要] 目的 探討潜阳合剂抑制血管紧张素Ⅱ(Ang Ⅱ)诱导的心肌成纤维(RCF)细胞异常增殖的机制。 方法 将RCF细胞分成空白细胞组、Ang Ⅱ组、Ang Ⅱ+潜阳合剂组。Ang Ⅱ组选用经过Ang Ⅱ诱导24 h的RCF细胞异常增殖的细胞模型,Ang Ⅱ+潜阳合剂组选用经过Ang Ⅱ诱导后加入潜阳合剂干预的细胞模型。蛋白质印迹法分析并比较三组的转化生长因子-β1(TGF-β1)、胶原蛋白Ⅰ型(Collagen Ⅰ)、Collagen Ⅲ蛋白表达,定量聚合酶链反应检测并比较三组的TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因表达。 结果 Ang Ⅱ组TGF-β1、Collagen Ⅰ、Collagen Ⅲ蛋白表达水平高于空白细胞组(均P < 0.01)。Ang Ⅱ+潜阳合剂组的TGF-β1、Collagen Ⅰ、Collagen Ⅲ蛋白表达水平低于Ang Ⅱ组(P < 0.05或P < 0.01)。Ang Ⅱ组的TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因表达水平高于空白细胞组(均P < 0.01)。Ang Ⅱ+潜阳合剂组的TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因表达水平低于Ang Ⅱ组(P < 0.05或P < 0.01)。 结论 潜阳合剂可以通过降低TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因和蛋白的表达来抑制RCF细胞增殖,改善心肌纤维化。
[关键词] 潜阳合剂;血管紧张素Ⅱ;心肌成纤维细胞;心肌纤维化
[中图分类号] R285 [文献标识码] A [文章编号] 1673-7210(2020)10(c)-0004-05
Mechanism research of Qianyang Decoction inhibits the proliferation of cardiac fibroblasts
CHEN Jie RUAN Xiaofen WANG Xiaolong
Department of Cardiovascular Medicine, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
[Abstract] Objective To discussed the mechanism of Qianyang Decoction inhibits the abnormal proliferation of cardiac fibroblasts (RCF) cells induced by angiotensin Ⅱ (Ang Ⅱ). Methods The RCF cells were divided into blank cell group, Ang Ⅱ group and Ang Ⅱ+Qianyang Decoction group. In the Ang Ⅱ group, a cell model with abnormal proliferation of cardiac fibroblasts induced by Ang Ⅱ for 24 h was selected, and the Ang Ⅱ+Qianyang Decoction group was a cell model that was induced by Ang Ⅱ and intervened with Qianyang Decoction. Western blot was used to analyze and compare the transforming growth factor-β1 (TGF-β1), Collagen Ⅰ type (Collagen Ⅰ), Collagen Ⅲ protein expression among three groups, and quantitative polymerase chain reaction was used to detect and compare the TGF-β1 and Collagen Ⅰ, Collagen Ⅲ genetic expression among three groups. Results The protein expression levels of TGF-β1, Collagen Ⅰ and Collagen Ⅲ in Ang Ⅱ group were higher than those in the blank cell group (all P < 0.01). The protein expression levels of TGF-β1 and Collagen Ⅰ, Collagen Ⅲ in Ang Ⅱ+Qianyang Decoction group were lower than those in the Ang Ⅱ group (P < 0.05 or P < 0.01). The gene expressions levels of TGF-β1, Collagen Ⅰ and Collagen Ⅲ in Ang Ⅱ group were higher than those in the blank cell group (all P < 0.01). The gene expression levels of TGF-β1, Collagen Ⅰ and Collagen Ⅲ in Ang Ⅱ+Qianyang Decoction group were lower than those in Ang Ⅱ group (P < 0.05 or P < 0.01). Conclusion Qianyang Decoction can inhibits the abnormal proliferation of RCF cells by reducing the gene and protein expression level of TGF-β1, Collagen Ⅰ and Collagen Ⅲ, hence alleviate heart muscle fibrosis.
[Key words] Qianyang Decoction; Angiotensin Ⅱ; Cardiac fibroblasts; Heart muscle fibrosis
心肌纤维化是心室重构的主要病理过程,其主要发生机制是因为细胞外基质代谢紊乱、胶原过度沉积以及各种因素导致的心肌细胞和心肌成纤维(RCF)细胞增殖[1-2]。RCF细胞广泛存在于心脏组织中,起源于内皮,是目前公认的造成心脏细胞外基质代谢紊乱的主要细胞之一[3-6]。
肾素-血管紧张素-醛固酮系统(RAAS系统)在心肌纤维化演变过程中扮演主要角色。血管紧张素Ⅱ(Ang Ⅱ)是RAAS系统中的最为重要的活性效应物质,它可以通过血管紧张素Ⅱ受体1(AT1R)促进心肌细胞、RCF细胞的增殖和胶原的过度增生,从而导致心室重构[7-8]。
本课题前期研究发现,潜阳合剂可以通过降低Ang Ⅱ的水平来降低腹主动脉狭窄所致的高血压病大鼠的血压[9]。本研究根据前期实验的结果,通过体外培养大鼠的RCF细胞,在细胞和基因水平研究分析潜阳合剂对转化生长因子-β1(TGF-β1)、胶原蛋白Ⅰ型(Collagen Ⅰ)、胶原蛋白Ⅲ型(Collagen Ⅲ)的蛋白和基因的表达影响来抑制Ang Ⅱ诱导的RCF细胞增殖,为进一步探讨潜阳合剂抑制心肌纤维化的机制提供一定的依据。
1 材料与方法
1.1 细胞
大鼠RCF细胞(上海游望生物科技有限公司,编号:C1388)。
1.2 实验用药
潜阳合剂:由熟地黄、钩藤、女贞子、白蒺藜、桑葚、牡蛎、当归、珍珠母、首乌藤9味中药组成,由上海中医药大学附属曙光医院药剂科提供,批号:沪药制字Z05100449。
1.3 试剂
Collagen Ⅲ(Bioss,bs-0549R);TGF-β1(Bioss,bs-0086R);Collagen Ⅰ(Bioss,bs-7158R);Candesartan(AT1R抑制劑,Harvey-bio,139481-59-7);Ang Ⅱ(Sigma,SLBM2823V);羊抗兔-HRP(Biovol,BV-S8008);ECL化学发光试剂盒(CWBIO,00051403);Trizol Reagent(Invitrogen,15596-026);氯仿(国药化学集团,67-66-3);异丙醇(国药化学集团有限公司,67-63-0);75%无水乙醇(国药化学集团有限公司,64-17-5);DEPC H2O(Invitrogen,750024);逆转录酶SuperScript Ⅲ Reverse Transcriptase(Invitrogen,R250-01);荧光染料SYBR Green I(Invitrogen,CS7561);Rnase Inhibitor(Fermentas,E00381);Platinum Taq DNA Polymerase(Invitrogen,10966034);Platinum Taq DNA Polymerase(Invitrogen,10966034);100 mmol/L dNTPs(Invitrogen,1842 7013)等。
1.4 仪器
台式高速冷冻离心机(美国Beckman,型号:Allegra 21R);台式高速离心机(德国SORVAL,型号:SIGMA 3-15/3K15);Gel Doc2000成像系统;垂直电泳系统(Bio Rad);pH计(美国Mettler Toledo,型号:320-S);电子天平(美国AHOΜS,型号:AR5120);恒温水浴锅(日本SANYO,型号:BSG-28);雪花状制冰机(日本SANYO,型号:SIM-F140AY65-PC);超净工作台[中国苏净集团,型号:SW-CJ-1FD(垂直)];高速冷冻离心机(Heal Force,型号:Neofuge13R);生物安全柜(Heal Force,型号:HFsafe 1200 A2);荧光定量聚合酶链式反应(qPCR)仪(Bio Rad,型号:CFX96)等。
1.5 方法
1.5.1 细胞培养 大鼠RCF细胞,细胞密度4×104/mL,置于37℃,5%CO2细胞培养箱内含DMEM+10% FBS+1%双抗培养,48 h后再更换1次培养液继续培养,待RCF细胞生长至80%~90%后传代进行实验研究。
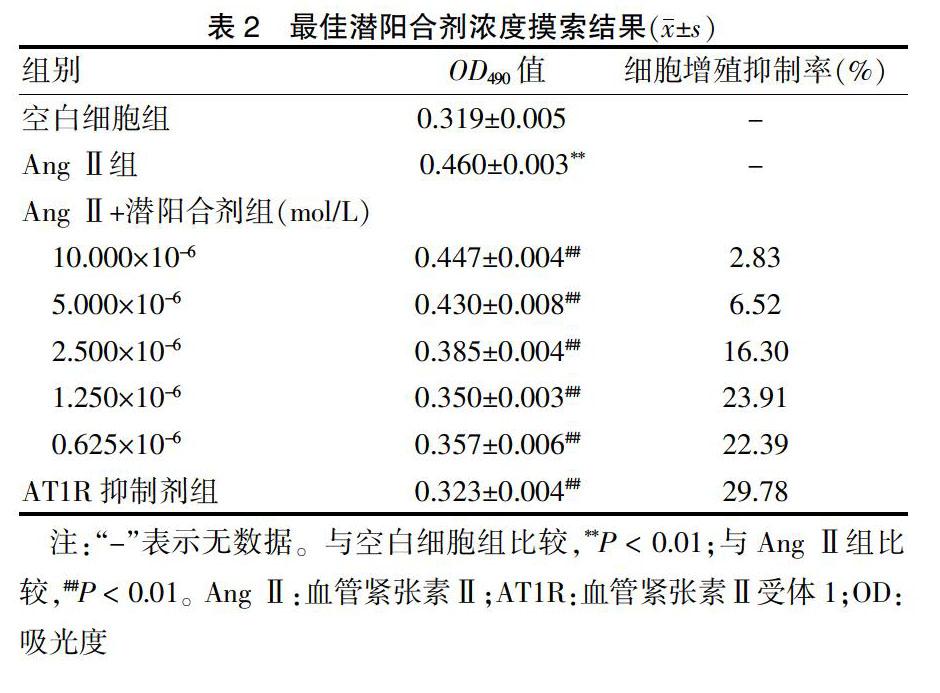
1.5.2 CCK8法摸索最佳潜阳合剂浓度 用96孔板每孔接种4×103个RCF细胞,于第2天换无血清饥饿处理过夜后换成1% FBS维持培养。将细胞分为空白细胞组、Ang Ⅱ组(800 nmol/L)[9]、Ang Ⅱ+潜阳合剂组(10.000×10-6 mol/L)、Ang Ⅱ+潜阳合剂组(5.000×10-6 mol/L)、Ang Ⅱ+潜阳合剂组(2.500×10-6 mol/L)、Ang Ⅱ+潜阳合剂组(1.250×10-6 mol/L)、Ang Ⅱ+潜阳合剂组(0.625×10-6 mol/L)、AT1R抑制剂组,添加适量CCK8溶液,用酶联免疫检测仪测定其吸光度(OD490)值。根据公式计算细胞增殖抑制率。细胞增殖抑制率=(AAng Ⅱ-A潜阳)/AAng Ⅱ×100%,观察潜阳合剂能拮抗Ang Ⅱ的作用的最佳浓度。
1.5.3 分组 本研究分为3组即空白细胞组、Ang Ⅱ组、Ang Ⅱ+潜阳合剂组。
1.5.4 蛋白质印迹法(Western blot)分析检测TGF-β1、Collagen Ⅰ及Collagen Ⅲ蛋白表达 BCA试剂盒(碧云天生物技术有限公司,P0012A)蛋白定量后上样,10% SDS-PAGE分离总蛋白,然后转移至PVDF膜上,1∶500稀释TGF-β1、Collagen Ⅰ及Collagen Ⅲ蛋白抗体分别进行Western blot分析,使用ECL化学发光试剂盒显像,凝胶图像分析系统分析各蛋白条带灰度值,并以Actin为内参标化各样品蛋白电泳条带的灰度值。
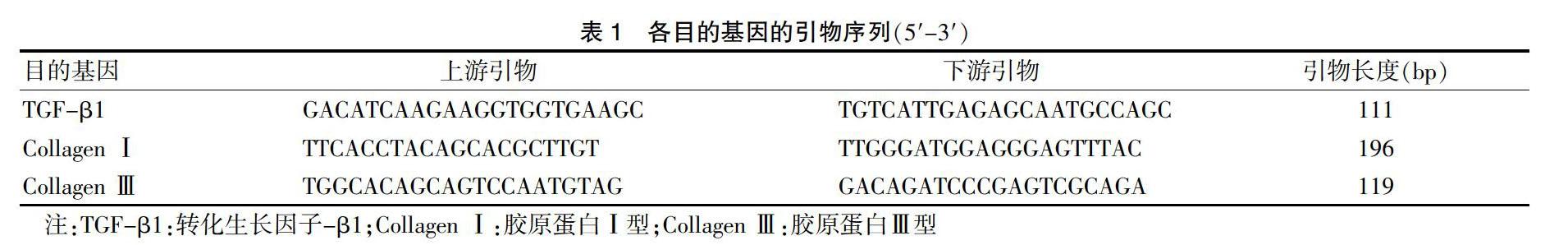
1.5.5 SYBR染料法qPCR检测TGF-β1、CollagenⅠ、Collagen Ⅲ基因 先提取RNA样品,质检后调整RNA浓度,按照实验目的稀释RNA至统一浓度后进行RNA反转录程序,再将获得的qPCR引物(见表1)与获得的cDNA模板进行qPCR扩增,检测细胞中目的基因的表达水平,目的基因的表达使用相对定量法。ΔCT值=样本待测基因CT值-相应内参基因CT值;ΔΔCT值=各组ΔCT值-对照组ΔCT值;各组待测基因的相对表达倍数值=2-ΔΔCT,以该值进行统计分析。
1.6 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 最佳潜阳合剂浓度摸索结果
1.250×10-6 mol/L潜阳合剂对细胞增殖抑制效果最好。见表2。
2.2 潜阳合剂对RCF细胞TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因表达的影响
2.3 潜阳合剂对RCF细胞TGF-β1、Collagen Ⅰ、Collagen Ⅲ蛋白表达的影响
Ang Ⅱ组TGF-β1、Collagen Ⅰ、Collagen Ⅲ蛋白表达水平高于空白细胞组(均P < 0.01)。Ang Ⅱ+潜阳合剂组的TGF-β1、Collagen Ⅰ、Collagen Ⅲ蛋白表达水平低于Ang Ⅱ组(P < 0.05或P < 0.01)。见图1、表4。
3 讨论
心室重构是各种损伤使心脏原来存在的物质和心脏形态学发生变化。心肌纤维化是心室重构发生的关键,它会使心室顺应性降低,舒张功能下降,使心脏电生理结构发生改变从而诱发心律失常,甚至猝死,所以改善高血压病和各种心脏疾病引起的心肌纤维化具有重要意义[10]。在心肌纤维化过程中,主要与Ang Ⅱ激活CRF细胞中的多种因子导致大量细胞外基质的沉积有关。
TGF-β1是一类多效应的细胞因子,是维持组织内稳态的关键因子,是调控细胞外基质的重要监督机构[11]。有文献报道[12],TGF-β1是促进心肌纤维化的重要细胞因子之一,它可以使正常的成纤维细胞的表型发生转化,改变成纤维细胞贴壁生长特性,使Collagen Ⅰ、Collagen Ⅲ胶原沉积。TGF-β1的表达增高是导致心肌纤维化的重要环节。并且有研究发现活化AT1R可以促进TGF-β1表达增加,并且激活TGF-β1受体,导致心肌纤维化[13-14]。同时Ang Ⅱ可以诱导Collagen Ⅰ、Collagen Ⅲ激活,最终加速心肌纤维化,导致心室重构。
课题组前期通过对腹主动脉缩窄致高血压病伴左室肥厚大鼠的心肌组织进行染色后发现,模型组心肌间质的Collagen Ⅰ、Collagen Ⅲ含量明显增多,而培哚普利组和潛阳合剂组的胶原组织较模型组减少[15]。此次通过分析潜阳合剂对TGF-β1、Collagen Ⅰ、Collagen Ⅲ的基因及蛋白的表达发现,潜阳合剂可以通过下调TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因的表达,降低TGF-β1、Collagen Ⅰ、Collagen Ⅲ蛋白的含量,从而抑制Ang Ⅱ诱导RCF细胞的异常增殖。
综上所述,潜阳合剂可以通过抑制Ang Ⅱ诱导RCF细胞异常增殖,改善心肌纤维化。通过阅读文献发现:c-Fos是TGF-β1的上游基因,c-Fos上调可引起促纤维化因子TGF-β1转录增加[16];miR-34a直接调控Smad4而控制TGF-β1的表达[17-18];miR-133a通过降低TGF-β1的过表达改善心脏功能[10,19];miR-663和miR-9都能抑制TGF-β1蛋白的表达和Collagen Ⅰ、Collagen Ⅲ的水平[20-21]。并且,有研究发现心肌纤维化的发生发展与多种基因的DNA甲基化和组蛋白修饰有关[22-23],miR-369-5p过表达可以降低DNA甲基转移酶3A(DNMT3A)的表达来抑制RCF细胞的增殖[24];SIRT2过表达可激活AMP活化蛋白激酶(AMPK)下游的LKB1基因从而抑制血管紧张素诱导的心肌纤维化[25]。所以,可以通过基因筛查进一步明确基因靶点和发生进展机制,为临床治疗高血压病所致的心肌纤维化的药物治疗提供理论依据。
[参考文献]
[1] Yang Z,Zhang X,Guo N,et al. Substance P Inhibits the Collagen Synthesis of Rat Myocardial Fibroblasts Induced by Ang Ⅱ [J]. Med Sci Monit,2016,22:4937-4946.
[2] Huang X,Kang Y,Jiang X,et al. Tandospirone enhances the anti-myocardial fibrosis effect of valsartan in spontaneously hypertensive rats [J]. Biomed Pharmacother,2020, 126:110073.
[3] 崔琳,王幼平,谢世阳,等.血管紧张素Ⅱ对原代培养大鼠心肌成纤维细胞增殖及转分化的影响[J].中西医结合心脑血管病杂志,2017,15(21):2680-2684.
[4] 王欣,任卫东.与心肌纤维化相关的细胞因子和生长因子[J].医学综述,2019,25(9):1694-1699.
[5] Tallquist MD. Cardiac Fibroblast Diversity [J]. Annu Rev Physiol,2020,82:63-78.
[6] Bao Q,Zhang B,Suo Y,et al. Intermittent hypoxia mediated by TSP1 dependent on STAT3 induces cardiac fibroblast activation and cardiac fibrosis [J]. Elife,2020,9:49923.
[7] 丁雪峰,周京敏,朱凌倜,等.芪苈强心提取物阻断Smad3信号通路抑制血管紧张素Ⅱ诱导的心脏成纤维细胞转分化[J].中国分子心脏病学杂志,2014,14(6):1144-1148.
[8] Ames MK,Atkins CE,Pitt B. The renin-angiotensin-aldosterone system and its suppression [J]. J Vet Intern Med,2019,33(2):363-382.
[9] 高俊杰,吳琼,王肖龙,等.潜阳合剂对腹主动脉缩窄致高血压模型大鼠血压的影响[J].上海中医药杂志,2015, 49(6):74-77.
[10] Yu BT,Yu N,Wang Y,et al. Role of miR-133a in regulating TGF-β1 signaling pathway in myocardial fibrosis after acute myocardial infarction in rats [J]. Eur Rev Med Pharmacol Sci,2019,23(19):8588-8597.
[11] Vivar R,Humeres C,Anfossi R,et al. Role of FoxO3a as a negative regulator of the cardiac myofibroblast conversion induced by TGF-β1 [J]. Biochim Biophys Acta Mol Cell Res,2020:118695.
[12] Ahn MS,Eom YW,Oh JE,et al. Transient receptor potential channel TRPV4 mediates TGF-β1-induced differentiation of human ventricular fibroblasts [J]. Cardiol J,2020,27(2):162-170.
[13] 肖一佳,沈祥春,李杰平,等.心肌纤维化与TGF-β-Smad信号系统[J].中国新药杂志,2016,25(2):182-186
[14] 李同,商黔惠,刘婵,等.转化生长因子β1/Samds表达在高盐饮食致Wistar大鼠心肌纤维化中的作用及替米沙坦干预[J].中华高血压杂志,2013,21(7):648-653.
[15] 高俊杰,吴琼,陈铁军,等.潜阳合剂对腹主动脉缩窄致高血压左室肥厚的影响[J].中西医结合心脑血管病杂志,2015,13(6):746-749.
[16] Xin Z,Kejing W,Fen H,et al. MicroRNA-101 protects cardiac fibroblasts from hypoxia-induced apoptosis via inhibition of the TGF-β signaling pathway [J]. Int J Biochem Cell Biol,2015,65:155-164.
[17] 吴艳,刘婷婷,冯凯,等.微小RNA调控心肌纤维化研究进展[J].药学研究,2018,37(5):278-281.
[18] 曹帅.微小RNA与心肌纤维化关系的研究进展[J].心血管病学进展,2016,37(6):647-651.
[19] 张松林,范粉灵,魏峰,等.微小RNA-133b对心肌纤维化的影响[J].中国医学科学院学报,2019,41(5):589-594.
[20] Wu X,Zhu J,Wei Y,et al. MicroRNA-663 participates in myocardial fibrosis through interaction with TGF-β1 [J]. Exp Ther Med,2019,18(4):3172-3176.
[21] Jin X,Yu LL,Yu CX. Effect of miR-9 on myocardial fibrosis in rats via TGF-β1/Smads signaling pathway [J]. Eur Rev Med Pharmacol Sci,2019,23(16):7083-7088.
[22] 汪波,占贞贞,曾麒燕.心肌纤维化的表观遗传调控研究进展[J].中国比较医学杂志,2019,29(3):92-97.
[23] He Y,Ling S,Sun Y,et al. DNA methylation regulates α-smooth muscle actin expression during cardiac fibroblast differentiation [J]. J Cell Physiol,2019,234(5):7174-7185.
[24] Tao H,Dai C,Ding JF,et al. Epigenetic aberrations of miR-369-5p and DNMT3A control Patched1 signal pathway in cardiac fibrosis [J]. Toxicol,2018,410:182-192.
[25] Tang X,Chen XF,Wang NY,et al. SIRT2 acts as a cardioprotective deacetylase in pathological cardiac hypertrophy [J]. Circul,2017,136(21):2051-2067.
(收稿日期:2020-03-25)
[基金项目] 国家自然科学基金青年科学基金项目(81803885);上海市高级中西医结合人才计划项目[ZY(2018-2020)-RCPY-2004];上海市中医临床重点实验室(14DZ2273200)。
[作者简介] 陈婕(1990.12-),女,硕士;研究方向:中西医结合心血管内科。
[通讯作者] 王肖龙(1965.1-),男,硕士,主任医师,博士生导师;研究方向:中西医结合心血管内科。
