药用复合膜中苯二胺含量测定及限度标准研究*
2020-12-13吴红洋范能全
张 璞,吴红洋,曹 汐,范能全
(重庆市食品药品检验检测研究院,重庆401121)
20世纪80年代至今,我国开发了多种适宜片剂、胶囊、颗粒剂等药品的包装材料,其中药用复合膜发展迅速,成为固体制剂主要的包装形式[1-4]。药用复合膜是通过黏合剂复合而成的多层结构,由塑料薄膜、铝箔、黏合剂及油墨组成[5]。我国目前用得最多的黏合剂为聚氨酯类黏合剂。聚氨酯由多羟基化合物和芳香族异氰酸酯聚合而成,生产过程中为了获得更好的黏接性能,通常会适当过量使用芳香族异氰酸酯组分[6],但过量的芳香族异氰酸酯水解后会释放产生芳香胺类物质。苯二胺是芳香胺中常见的一种,对人体健康有潜在危害[7]。药用复合膜包装药品时,存在迁移进入药品而影响药品安全的风险,是药用复合膜使用过程中的重大安全隐患。目前,国内外有关苯二胺含量的检测标准和文献主要集中在染发剂和化妆品[8-11],现行国家药品包装材料标准未对黏合剂中的初级芳香胺如苯二胺进行控制。本研究中对初级芳香胺中苯二胺的测定方法进行了研究,并对样品中苯二胺的残留量进行质量控制。现报道如下。
1 仪器与试药
1.1 仪器
GC2010 Plus型气相色谱仪(日本Shimadzu公司);XPE205型电子天平(MettlerToledo公司,精度为0.01mg);KQ-500DE型超声波清洗器(昆山市超声仪器有限公司,功率为500 W,频率为40 kHz)。
1.2 试药
邻苯二胺(批号为K1827010,纯度为99.5%,规格为25 g),对苯二胺(批号为L1829016,纯度为99.0%,规格为100 g),间苯二胺(批号为C1906096,纯度为99.5%,规格为100 g),均购自Aladdin公司;甲醇为色谱纯(安徽时联特种溶剂股份有限公司,批号为6508JW21);试验用水为Milli-Q超纯水(美国EMDMillipore公司);药用复合膜(A公司,批号分别为20170215,20171220,20170225;B公司,批号分别为20170301-06,20170301-07,20170301-08;C公司,批号分别为170301,170401,170502)。
2 方法与结果
2.1 色谱条件
色谱柱:岛津Rtx-5毛细管色谱柱(30 m×0.25 mm,0.25μm);温度:进样口为200℃,气化室为220℃,FID为300℃;流速:载气高纯度氮气为0.8 mL/min,氢气为40mL/min,空气为400mL/min,尾吹为30mL/min;柱温:程序升温,初始温度为100℃,保持1min,以20℃/min的速率升至200℃,保持0 min,再以20℃/min的速率升至280℃,保持10 min;分流比:5∶1;进样量:1μL。
2.2 溶液制备
对照品溶液:分别取邻苯二胺、对苯二胺和间苯二胺各0.25 g,精密称定,置100 mL容量瓶中,加甲醇溶解,并定容至刻度,摇匀,作为对照品贮备液。精密量取对照品贮备液2.0 mL,置50 mL容量瓶中,加甲醇至刻度,摇匀,作为对照品中间贮备液。精密量取对照品中间贮备液适量,加甲醇稀释成每1 mL含1,2,5,10,20,50,100μg的混合对照品溶液。
供试品溶液:取样品适量,裁取表面积0.03 m2(约1.3 g),剪成3 mm×30 mm大小,置100 mL具塞锥形瓶中,加适量甲醇,超声(功率为500 W,频率为40 kHz)提取30 min后取出,冷却至室温后转移至50 mL容量瓶中,用甲醇定容至刻度,用0.22μm滤膜过滤,即得。
2.3 方法学考察
专属性试验:精密吸取空白溶剂(甲醇)及2.2项下2种溶液各1μL,按拟订色谱条件进样检测,色谱图见图1。结果邻苯二胺、对苯二胺和间苯二胺对照品的理论板数分别为140 022,157 670,190 333。供试品溶液色谱图中,均未检出与对照品溶液保留时间相同的色谱峰;空白溶剂色谱图中,在与对照品溶液相同保留时间处无干扰峰,表明该方法专属性良好。
线性关系考察:分别取各质量浓度的混合对照品溶液各1μL,注入气相色谱仪,以进样质量浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归,得邻苯二胺、对苯二胺、间苯二胺的回归方程,Y邻=3 026.03X邻-5 053.46(r=0.999 5,n=7),Y对=2 936.18X对-5 564.23(r=0.999 5,n=7),Y间=2 988.44X间-5 150.78(r=0.999 6,n=7);邻苯二胺、对苯二胺、间苯二胺质量浓度分别在0.996 8~99.680 0μg/mL,0.991 4~99.140 0μg/mL,1.003 8~100.380 0μg/mL范围内与峰面积线性关系良好。
精密度试验:精密吸取2.2项下质量浓度为10μg/mL的对照品溶液适量,按拟订色谱条件重复进样6次,记录峰面积。结果邻苯二胺、对苯二胺与间苯二胺峰面积的RSD分别为1.68%,1.74%,1.90%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取同一对照品溶液,室温下分别放置0,3,6,8,12 h时按拟订色谱条件进样测定,记录峰面积。结果邻苯二胺、对苯二胺与间苯二胺峰面积的RSD分别为1.60%,1.37%,1.97%(n=5),表明对照品溶液在12 h内测定结果稳定。
加样回收试验:取已知邻苯二胺、对苯二胺与间苯二胺含量的样品9份,各裁取0.03 m2,分别精密加入混合对照品适量,依法制备供试品溶液,进样测定,记录峰面积,并计算含量。结果见表1。
检测限与定量限:取2.2项下混合对照品溶液倍比稀释,进样测定,当信噪比(S/N)为3时为检测限,S/N为10时为定量限。邻苯二胺、对苯二胺与间苯二胺的检测出限分别为0.797 4,0.793 1,0.803 0μg/mL,定量限分别为0.996 8,0.991 4,1.003 8μg/mL。
2.4 样品含量测定

图1气相色谱图
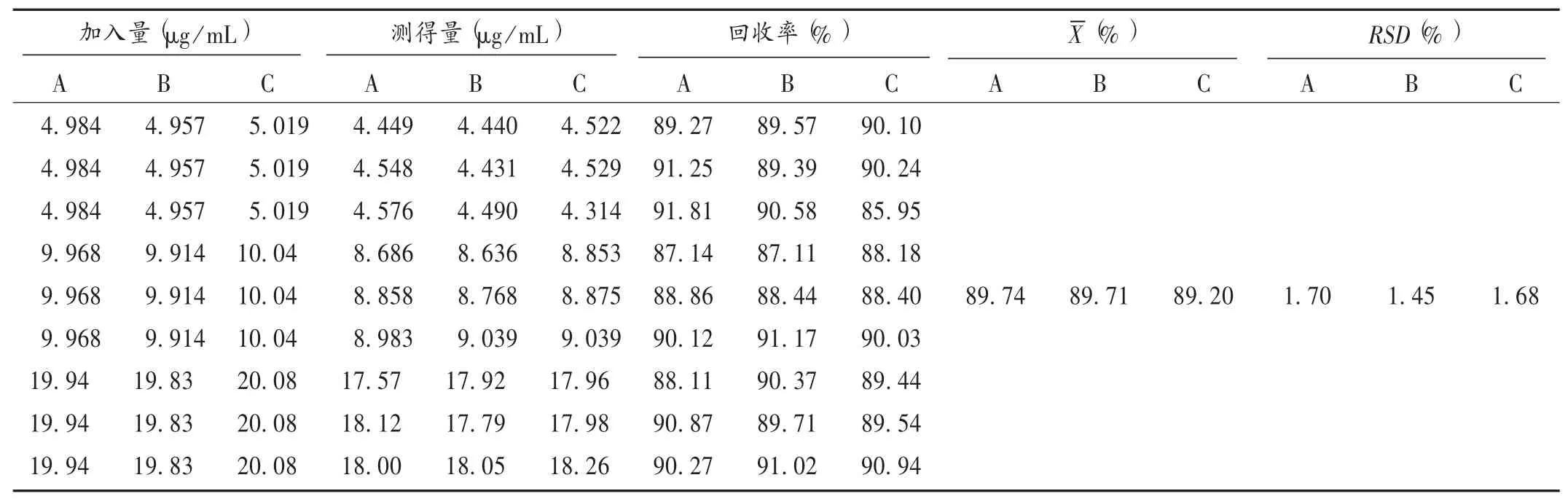
表1加样回收试验结果(n=9)
取9批样品,各2份,依法制备供试品溶液,按拟订色谱条件进样测定,结果所有样品中均未检出邻苯二胺、对苯二胺、间苯二胺。
3 讨论
各国药典均未收载药用复合膜中苯二胺的测定方法及限度,故无法直接查阅苯二胺限度的相关标准。在制订本品苯二胺限度标准时,拟根据《药品与包装材料相容性研究相关指导原则解读-试验结果的评估》[12-13]中建议的采用允许日暴露量(PDE)的评估方法进行评估,并结合每日最大摄入量计算得药用复合膜中苯二胺的限度。
查阅TOXNET数据库可知,邻苯二胺、对苯二胺与间苯二胺的大鼠经口急性毒性的半数致死量(LD50)分别为510,80,280 mg/kg,欧盟原料药委员会在其发布的《原料药工厂中清洁验证指南》中收载了由LD50计算NOEL的公式(NOEL=LD50/2 000)[14],根据人用药品注册技术要求国际协调会(ICH)Q 3C残留溶剂指导原则中有机溶剂PDE值的计算方法[15]:PDE=NOEL×体质量调整/(F1×F2×F3×F4×F5),式中NOEL为未观察到作用水平,F1~F5为一系列安全系数值。通过计算得到邻苯二胺、对苯二胺与间苯二胺的PDE值分别为51,8,28 mg/d。目前,市场上药用复合膜包装颗粒剂最多。颗粒剂按最常见规格为每袋10 g,1次10 g,每日3~4次,空袋的质量按1 g计,得到邻苯二胺、对苯二胺与间苯二胺的限度分别为1.275%,0.2%,0.7%。考虑到药用复合膜包装各种制剂的实际情况和临床上的联合用药,为提高用药安全性,故将苯二胺的限度值暂订为0.05%,并根据后期毒性研究试验结果对现暂订苯二胺浓度限度标准作进一步修订。
本研究中建立了采用气相色谱法测定药用复合膜中苯二胺含量的方法,并制订了限度标准。按该方法进行测定,结果均符合规定。为更好地控制产品质量,建议在药用复合膜中增加苯二胺的残留量测定。
