医疗器械上市许可持有人不良事件报告质量分析
2020-12-12丁思吉王晓瑜丁皓
丁思吉 王晓瑜 丁皓
(1.上海理工大学医疗器械与食品学院,上海 200093;2.上海市药品和医疗器械不良反应监测中心医疗器械不良事件监测与评价部,上海 200040;3.上海健康医学院医疗器械学院,上海 201318)
近年来,医疗器械在骨科疾病、心血管疾病等领域的应用为病人提供了风险更小、收益更高的治疗方式,显著改善了疾病的预后。但医疗器械在使用过程中也存在一定的风险,须对其使用进行严格监管[1]。2019年1月1日起实施的《医疗器械不良事件监测和再评价管理办法》突出体现了对落实医疗器械上市许可持有人主体责任的要求[2]。目前一些医疗器械上市许可持有人提交的部分医疗器械不良事件报告存在缺项、漏项、填写错误等问题,还存在一些不符合医疗器械不良事件定义的报告[3],如产品使用前发现的包装破损等,降低了报告的可利用度[4]。通过对国家医疗器械不良事件监测信息系统中的医疗器械上市许可持有人不良事件报告质量进行分析,提出改善对策,以期提升报告质量。
1 资料与方法
1.1 资料
收集2019年国家医疗器械不良事件监测信息系统中医疗器械上市许可持有人提交的医疗器械不良事件报告210份进行分析。所选报告均符合医疗器械不良事件定义,剔除使用单位、经营企业错报误报的报告、以及医疗器械上市许可持有人未完成调查的报告。
1.2 评分标准
借鉴2016年国家药品不良反应监测中心发布的《可疑医疗器械不良事件报告评分标准》,结合2019年新实施的《医疗器械不良事件监测和再评价管理办法》对医疗器械上市许可持有人的工作要求和《上海市个例医疗器械不良事件报告指南(试行)》(以下简称“报告指南”)制定评分表[5]。各评分项的描述得分分为:完整且准确、较完整、空缺或错误三类,对应的得分系数参考2016年评分标准,分别为1.0、0.5、0。报告质量等级分为优(100.0≥分数≥90.0)、良(90.0>分数≥75.0)、合格(75.0>分数≥60.0)、不合格(<60.0分)。
1.2.1 不良事件基本信息评分项
见表1。
1.2.2 不良事件调查评价与处置
见表2。
1.3 统计学处理
对210份报告进行逐一评分后,使用统计软件SPSS 20.0进行统计分析,统计量为最大值、最小值、均值、中位数。
2 结果
医疗器械上市许可持有人报告质量如表3所示,各类器械中位得分分别为80.0分、67.5分、79.0分,整体平均分为(76.1±8.4)分。报告质量等级为优的共8份,占3.8%;等级良的报告最多,共126份,占60.0%;合格报告71份,不合格报告5份。图1直方图显示75(含)~89分的报告数量最多,而优秀报告数量偏少,报告总体质量仍有改进空间。主要问题为使用过程描述、调查情况、控制措施描述不完整。

图1 医疗器械上市许可持有人不良事件报告表得分情况

表1 不良事件基本信息评分项
在210份报告中,仅38份报告完整阐述了使用过程,约占18.1%。部分报告未描述使用过程中不良事件对患者造成的影响、采取的措施以及结果。
根据评分标准,调查情况应包括医院使用情况、生产记录调查、投诉趋势分析、设备维护维修等。其中,调查情况中未对医院使用情况进行描述的共89份,占42.4%;未进行投诉或不良事件趋势分析的共143份,占68.1%。
未采取控制措施但理由阐述不充分的共14份,占6.7%。例如,部分医疗器械上市许可持有人选择不采取控制措施,理由是该不良事件为偶发事件,有源产品未调查历年投诉或不良事件趋势分析;无源产品未调查问题批次产品的投诉和不良事件情况,因而无法明确是否为偶发事件。
3 讨论
3.1 加强不良事件监测工作制度建设
我国医疗器械不良事件监测工作处于起步阶段,正逐步规范化、制度化[6],仍需加强不良事件监测制度建设。包括以下几个方面:(1)医疗器械上市许可持有人应把不良事件监测工作纳入质量管理体系中,建立、健全不良事件监测工作制度,配备稳定的专业监测队伍。医疗机构、经营企业将不良事件报告反馈医疗器械上市许可持有人,医疗器械上市许可持有人可通过调查,完善产品使用情况,此部分是医疗器械上市许可持有人对不良事件评价的核心环节,对未来防止同类不良事件的发生有重大指导作用。医疗器械上市许可持有人应尽到对不良事件进行调查和原因分析的义务,详细阐述事件调查结果,这也是不良事件报告制度的意义所在[7]。(2)医疗器械不良事件的发生不可预测,不能单纯以报告数量的多少来评定不良事件监测工作的成果。应将报告数量和质量共同纳入考核体系,对于报告数量多且质量高的医疗器械上市许可持有人,应给予一定的鼓励;对于报告数量多但质量较低的,应对上报人员加强报告填写相关的培训;对于报告数量较少的,应提高其监测意识,医疗器械上市许可持有人不能仅分析来自于医疗机构或经营企业的反馈信息,还应主动加强对不良事件信息的收集工作。(3)建立完善的培训制度,包括线上和线下两种形式[8]。线上可采取定期发布不良事件监测相关报告、视频的方式;线下可采取定期组织培训讲座的形式,由省级不良事件监测(ADR)中心负责对各市、区级ADR中心人员进行培训,各市、区级ADR中心人员对辖区内医疗器械上市许可持有人、使用单位、经营企业培训。(4)增加基层不良事件监测人员数量。医疗器械不良事件的原因通常比较复杂,涉及医学、信息技术、电子技术等诸多交叉学科,具有设计复杂、结构精密等特点,需要具有生物医学工程专业背景的专业人员对不良事件进行分析评价,提升不良事件监测工作的效率。
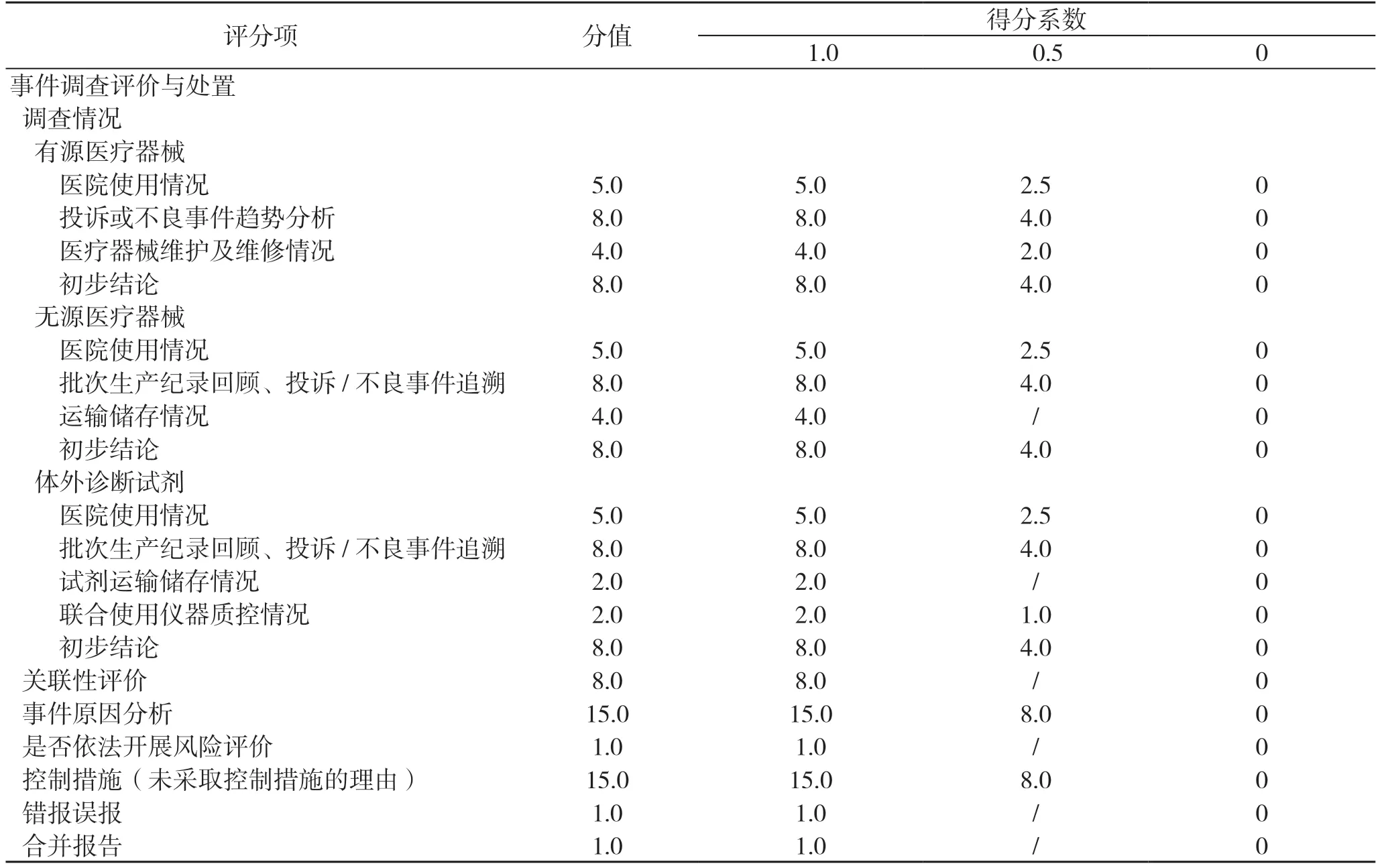
表2 不良事件调查评价与处置评分项
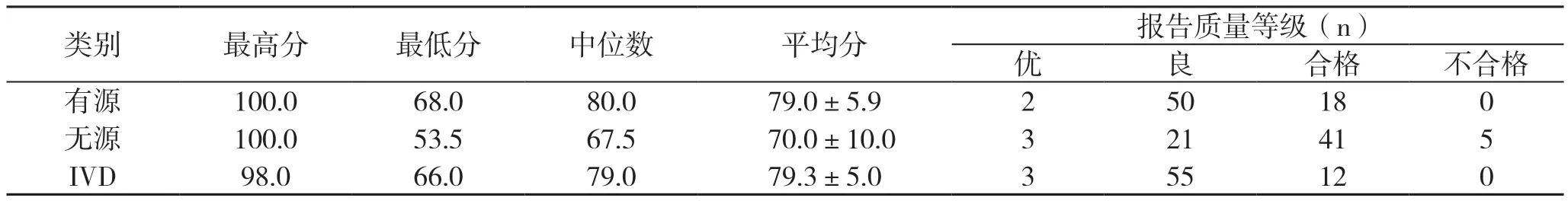
表3 医疗器械上市许可持有人各类器械不良事件报告表得分情况
3.2 完善报告填写指导文件
2019年12月,上海市发布了医疗器械不良事件报告填写指南。2020年6月,发布了《血液透析类医疗器械不良事件报告指南(试行)》,对报告填写具有一定的指导作用。但目前国家有关部门尚未公布统一的报告填写指导性文件,地方性指南难以向全国推广。未来应发布全国统一的报告填写指南,明确报告填写要求,减少不符合不良事件定义的报告以及报告中漏项、填写错误等问题[9]。
3.3 加强监测意识
不良事件报告是一项长期工作,短期内难以获得直接的经济效益。一方面,部分医疗器械上市许可持有人对不良事件上报、监测工作重视程度不够,还未建立成熟的不良事件监测团队[10]。不良事件上报监测工作通常由少数人负责,人力资源紧张,导致不能按时完成上报工作。根据监测系统中2019年全年不良事件报告的来源进行统计,医疗器械上市许可持有人上报的报告仅占8.29%。应明确医疗器械上市许可持有人上报的主体责任,提升对不良事件上报的重视程度,营造出医疗器械上市许可持有人上报为主的态势。另一方面,部分医疗器械上市许可持有人监测人员对医疗器械不良事件相关法规不熟悉。当出现因医疗器械原因导致的不良事件时,医疗器械上市许可持有人认为上报不良事件会影响企业的声誉,存在瞒报或漏报情况,但法规中已明确规定,不良事件报告不可作为医疗事故的证据,若医疗器械上市许可持有人熟悉法规,此类漏报将会减少。
3.4 优化监测系统功能
2019年1月1日,国家医疗器械不良事件监测信息系统正式启动,满足了不良事件在线报告的需求,但功能上仍存在一些不足,需要进行优化:(1)医疗器械上市许可持有人无法查看使用单位或经营企业的报告人,只能查看使用单位的名称与联系方式,会出现医疗器械上市许可持有人联系使用单位的联系人而联系人却不知情的情况。建议增加使用单位或经营企业的报告人联系方式的填写项,并在医疗器械上市许可持有人评价不良事件时对其开放使用。(2)对于无法联系上报人、产品信息不全或有误的报告,医疗器械上市许可持有人既无法完成调查,又无法更改使用单位填写错误的内容,降低了报告的可利用度。建议增加医疗器械上市许可持有人和省级监测机构,尤其是医疗器械上市许可持有人退回个例不良事件报告至使用单位、经营企业的功能。(3)医疗器械的使用单位通常为医疗机构,其对不良事件造成的伤害更为敏感。有时会将一般伤害的事件误判为严重伤害。建议增加医疗器械上市许可持有人对伤害类型进行更改的功能,由监测机构最终审核是否采纳医疗器械上市许可持有人评价的伤害类型。
