国外UDI发码机构编码规则对比分析
2020-12-12张湘媛张培茗黎聪
张湘媛 张培茗 黎聪
(上海健康医学院医疗器械学院,上海 201318)
医疗器械唯一标识(unique device identification,UDI)能够提高医疗器械管理效率,方便对医疗器械进行识别,进而提升医疗器械可追溯性[1]。UDI采用国际统一标准有助于提升全球供应链透明度和运营效率,推动信息共享交换,实现有效监管;有助于企业不良事件报告和开展再评价,以及不良产品的及时召回,实现产品全程追溯;有助于提升患者用械安全,提高医疗服务水平。
在UDI系统中,编码规则既不是由监管机构制定,也不是完全由制造商制定,而是引入了第三方发码机构,发码机构负责制定相应的编码规则,采用不同发码机构的编码规则制定的UDI可以同时在市场上并存。因此,对比分析不同发码机构的编码规则对于识别UDI有重要意义,并为制造商选择适合的发码机构提供建议。
1 发码机构现状
美国食品药品监督管理局(Food and Drug Administration,FDA)对发码机构的定义是指经FDA认可、管理发行唯一器械标识符系统的组织[2]。每个发码机构都有一个独特的器械唯一标识符格式,作为其认证发证机构过程的一部分,由FDA审查和批准。美国UDI规则在很大程度上依托国际标准和全球公认的发码机构,FDA要求UDI的发码机构能够符合《联邦法规21章》(2I CRF-唯一器械标识)“第§830.100-发码机构认证”的要求,FDA授权了三大机构国际物品编码协会(Globe Standard 1,GS1)、保健业商务通信委员会(Health Industry Business Communications Council,HIBCC)以及国际血库自动化委员会(International Council for Commonality in Blood Banking Automation,ICCBBA)负责发行UDI,这些授权机构负责代办FDA授权,审查全美企业提交的UDI申请具体信息,依据规定对申请进行评价。
欧盟医疗器械法规(2017/745)“第27条UDI系统”中对发码机构做了详细的要求,包括发码机构需要具有法人资格、须符合相应的国际标准等基本要求,同时还要求在授权后应能够运营其UDI分配系统至少10年等具体要求[3]。2019年6月,欧盟官方杂志OJEU发布了适用于《医疗器械法规(EU)2017/745(MDR)》和《体外诊断医疗器械法规(EU)2017/746 (IVDR)》的医疗器械UDI的发码机构,欧盟共认可四家UDI发码机构,除FDA认可的三家发码机构外,增加了德国制药市场信息服务提供商(Informationsstelle fur Arzneispezialitaten GmbH,IFA GmbH)作为发码机构,也是其中唯一一家欧盟本土的发码机构。
对四家发码机构的基本情况进行对比可以看出(表1),四家发码机构的制造商覆盖全球,其中GS1诞生最早且应用领域和覆盖范围最广,HIBCC和IFA GmbH专注于医疗相关领域,ICCBBA专注于输血和生物组织等领域。
2 四家发码机构的特点
在国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)的UDI指南文件中,规定了UDI可以由医疗器械生产厂商任意在国际标准中进行选择,作为自己产品UDI的编码标准。ICCBBA标准是用于全球血液制品的一种标准,HIBCC标准原是美国一个医疗产品专用编码标准(HIBCC标准在中国没有分支机构)。全球超过100个国家的医疗产业条码标准采用GS1标准,采用全球贸易项目代码(global trade item number,GTIN)作为医疗产品识别码的国家超过65个。当UDI采用GS1标准时,产品标识(DI)由GS1标准体系中的GTIN,即商品条码表示,而生产标识(PI)则用GS1标准体系的应用标示符(AI)表示[4]。
HIBCC采用的医疗产业条码技术,1986年体系建立的时候,GS1还没有建立标准体系。当GS1建立EAN-13/EAN-128的条码标准时,HIBCC已在美国被广泛采用。但由于其技术上固有的一些缺陷,如某些字段的定义不够清楚、无法确定产品的包装层级,使得该编码方式在美国以外很少使用,HIBCC的特点是能一次性买断编码,无需后期的维护费用。而GS1的费用是一次性加入费用与每年的维护费,因此费用相对较高[5]。
ICCBBA采用的ISBT-128编码技术,被世界上大多数血站广泛使用,对管理来源于人类细胞和组织的产品(HCT/P)有其独特的优势,其数据结构可包含捐献者的人类白细胞抗原(human leukocyte antigen,HLA)组织分型信息等。ISBT-128码也是世界卫生组织对人类来源医疗产品标识和编码唯一认可的全球标准。
IFA GmbH是德国药房、药品批发商和制药行业的联合清算实体。以标准化的质量保证信息作为中立承包商,协助医疗保健市场的参与者。IFA GmbH代表其供应商收集并维护有关医药产品,医疗器械和其他药品的经济、法律和后勤数据,并将这些数据作为IFA GmbH信息服务发布。同时,IFA GmbH是制药中心编号(pharmazentralnummer,PZN)和药房产品编号(pharmacy product number,PPN)的国家发行机构。2019年6月6日欧盟委员会决定实施(EU) 2019/939,IFA被欧盟委员会任命为UDI的分配机构,这意味着,IFA的编码系统还可用于根据法规(EU) 2017/745 (MDR)和(EU)2017/746 (IVDR)标记医疗器械。PZN是德国药品市场中医药产品、医疗器械、其他医药典型产品的一对一识别密钥。IFA GmbH为使用PZN进行产品识别的制造商提供其编码系统和PPN,指定PPN在全球范围内使用PZN以及其他每个国家的产品编号,确保任何国家的产品编号在全球都是独一无二的[6]。

表1 美国和欧盟发码机构
3 发码机构编码规则的对比分析
根据美国和欧盟的法规,制造商负责UDI的编码和赋码工作,标识应具有“全球唯一性”,四家发码机构在符合国际编码标准的前提下,实施自己的编码规则。UDI编码采用数字、文字和符号进行组合,产生不同的编码,确保UDI的唯一性,保证医疗器械在该政府管辖区域内实现追溯。各发码机构在制定UDI编码规则时结合自身机构的特点进行制定,下面对编码规则进行详细分析[7]。
3.1 GS1的UDI编码规则
GS1的编码规则规定,使用括号及其中的数字作为数字分隔符,用来表示其后数字的含义,分隔符后是其含义对应PI,包括生产日期、失效日期、批号等。比如“(01)”代表产品标识(DI)、PI包括“(11)”代表生产日期、“(17)”代表效期、“(10)”代表批号、“(21)”代表序列号,数字分隔符后跟的标识符内容的数据类型有数字或者字母数字,不同标识符的可编码位数也不同(表2)。在一个完整的GS1的UDI编码中,如果将5个数字分隔符和可编码位数都算上,UDI编码人工可读位数最多可由76位字母和数字组成。
3.2 HIBCC 的UDI编码规则
HIBCC的UDI编码有两种结构形式,主要结构和次要结构,主要结构是UDI的DI部分,即产品标识,包含标签商信息、商品信息、包装信息和校验码。次要结构是UDI的PI部分,即生产标识,包含批号、生产日期、效期和序列号,每块信息对应不同的数字分隔符,比如“仅含批号”会由一个美元符号“$”代替,数据类型为字母数字,可编码的字符范围为18位。再比如,“$$4”代表的是“跟批号的效期”,批号用字母数字表示,具体信息如表3所示。
将主要数据和次要数据结合,构成一个完整的UDI,使用不同数据分隔符,后表示器械期效、日期等信息。以“*+A99912345/$$52001510X33*”为例,其中,“+”代表供应商标签标志符,“A999”代表标签商识别代码,“1234”代表商品代号,“5”代表包装形式,“/”作为隔开主要数据和次要数据的符号,“$$5”代表跟批号的效期,效期用朱利安日期(YYJJJ)表示,“20015”含义为2020年的第15天,批号为10X3,校验码为3条码,以星号“*”开始和结束,开始和结束码不计入编码中。
3.3 ICCBBA的UDI编码规则
ICCBBA的UDI编码规则中DI包含厂商信息、厂商定义的商品信息、标准化的产品描述信息。PI由唯一捐献识别码、序列号、效期、生产日期以及批号中的一种或多种信息组成。PI必须包含捐献识别号和产品区分号(即序列号),而效期、生产日期和批号除非出现在产品标签上,则必须包含在内,否则自行选择。每一类信息也会对应不同的数字分隔符,比如序列号用“=,”表示,效期用“=>”表示,生产日期用“=}”表示等等(如表4所示)。

表2 GS1的UDI编码规则

表3 HIBCC的编码规则
不同标识符的数据类型、可编位数也不同。需要特别注意的是血袋的关于UDI编码规则(如表5所示),区别于一般医疗器械,血袋的UDI可编位数较少,仅含设备标识符和批号。
3.4 IFA GmbH的UDI编码规则
对于IFA GmbH(图1所示)就是UDI-DI。PPN由三部分组成:产品注册机构代码(PRA)、制药中心编码(PZN)和校验码。“11”代表产品注册机构代码,由IFA管理和分配,数据类型为数字字母,可由数字0~9加上字母A~Z构成。“12345678”为制药中心编码,数据类型同样为数字字母,最大字符长度为18位,可由数字0~9加上字母A~Z组成。最后,“42”为两位校验码。
UDI中常用的PI要有四种:序列号(SN)、批号(LOT)、效期(EXP)和生产日期(MFD)。按照IFA编码规则,这四种识别码的指示符分别为:S、1T、D、和16D。其中,序列号和批号的数据类型为数字字母,而效期和生产日期为数字(如表6所示)。

图1 PPN码
另外,欧盟法规引入了一个新的标识符Basic UDI-DI,在《Guidance on Basic UDI-DI and Changes to UDI-DI》法规中明确基本UDI-DI是EUDAMED数据库中器械相关信息的主访问要素,IFA编码系统对于编制基础UDI-DI也提出了明确要求,一个完整的Basic UDI-DI会由四部分组成:发行机构代码(IAC)、制造商代码、器械组代码和校验码[8]。
根据IFA编码规则编制的UDI标签(如图2所示)。其中,“12345678”为制药中心编码;UDIDI即PPN为“111234567842”,关于UDI-PI信息,“ABC12345”为批号,效期为2024年12月31日。
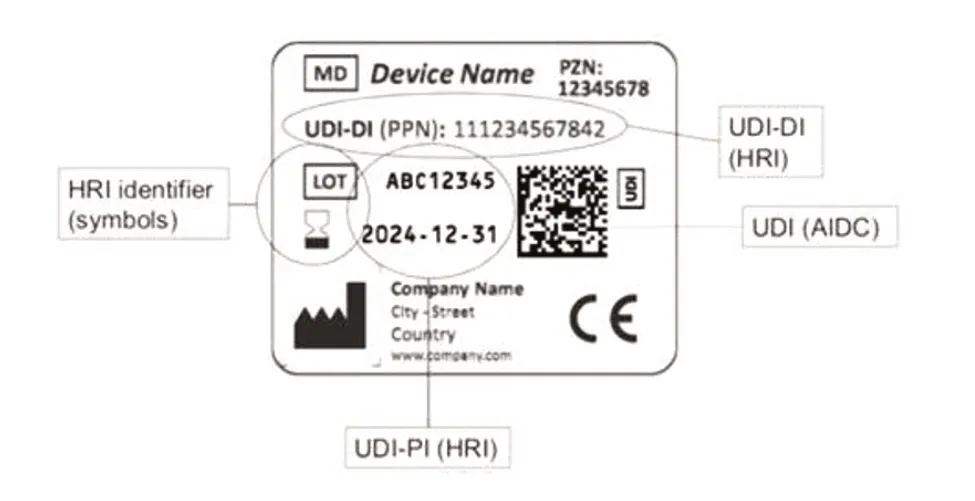
图2 IFA的编码标识
3.5 四家发码机构编码规则对比
从以上不同发码机构UDI编码规则介绍可以看出,在国际统一标准下,GS1、HIBCC、ICCBBA完整的编码由DI、PI组成(如表7所示),IFA GmbH编码由Basic UDI-DI对具有某些相同属性的制造商产品进行分组编码,特定医疗器械UDI由DI、PI部分组成。
GS1条码标示只有数字分隔符,HIBCC、ICCBBA有字母、数字、符号,另外,HIBCC码起始和结束带有“*”,此符号不计入编码。PZN码中直接标示出批号、期效等信息,与GS1、HIBCC、ICCBBA格式有很大区别。四家编码机构,都是由一维码、二维码、射频码等载体结合字符的形式,体现产品的关键信息,都经过欧盟认证资质,也是收费的。

表4 ICCBBA的编码规则

表5 血袋的UDI编码规则
Basis UDI-DI用于连接具有相同预期目的、风险级别和基本设计和制造特征的设备在相关文档(如:证书,包括自由销售证书)、欧盟符合性声明、技术文件、安全和(临床)性能总结中被引用。为了符合欧盟法规Basic UDI-DI要求,GS1、HIBCC、ICCBBA分别制定新的应用标识符。实际上在欧盟医疗器械法规(MDR)下进行CE认证的产品需要两个UDI-DI:一个是未获得认证前,将产品信息上传到EUDAMED数据库时需要用到的Basic UDI-DI全球型号代码(Global Model Number,GMN);另一个 UDI-DI则是与FDA一样,产品获得认证后用于销售流通的真正UDI-DI(GTIN)。
Basic UDI-DI(GMN)与UDI-DI(GTIN)的对应关系可以是1对1,也可以是1个Basic UDI-DI(GMN)对应多个UDI-DI(GTIN)。这可以对应成:在实际应用中,同一产品不同的规格型号、认证证书是一样的,但销售时的包装是不一样的[9]。
4 总结
四家UDI发码机构的编码标准被各自的国际组织领导,每个组织由分布在各国的机构形成一个统一的管理系统,国际标准组织通过分配厂商的代码来维持厂商代码在全球唯一性。在厂商代码全球唯一性基础上,每个厂商自行分配到产品的代码,各环节对医疗器械的精准识别,在医疗器械全生命周期监管中发挥重要作用。发码机构针对不同的应用领域,覆盖不同的国家,形成一个在全球各国市场上可以统一使用的唯一器械标识,以区分全球市场上医疗器械供应链中的产品。
目前,UDI建设尚未完成,由于各国医疗器械监管和产业环境不同,以及多方利益相关者的参与,使得全球医疗器械UDI体系建立变得困难,UDI制度实施是一个漫长的过程。医疗器械唯一标识基于通用的国际标准,监管机构应鼓励医疗器械制造商选择通用的编码标准,例如GS1、HIBCC、ISBT-128等,制造商根据其产品类型、产品目标市场、不同发码机构的服务等因素,选取适合的发码机构,最终由制造商创建医疗器械唯一标识标签按照其代码发布机构的规则进行操作。UDI的全面实施是各方协调的过程,走国际化协调道路,采用国际标准能够快速与国际市场接轨,有利于我国医疗器械唯一标识系统的实施,更有利于产品监管和医疗器械产业发展。
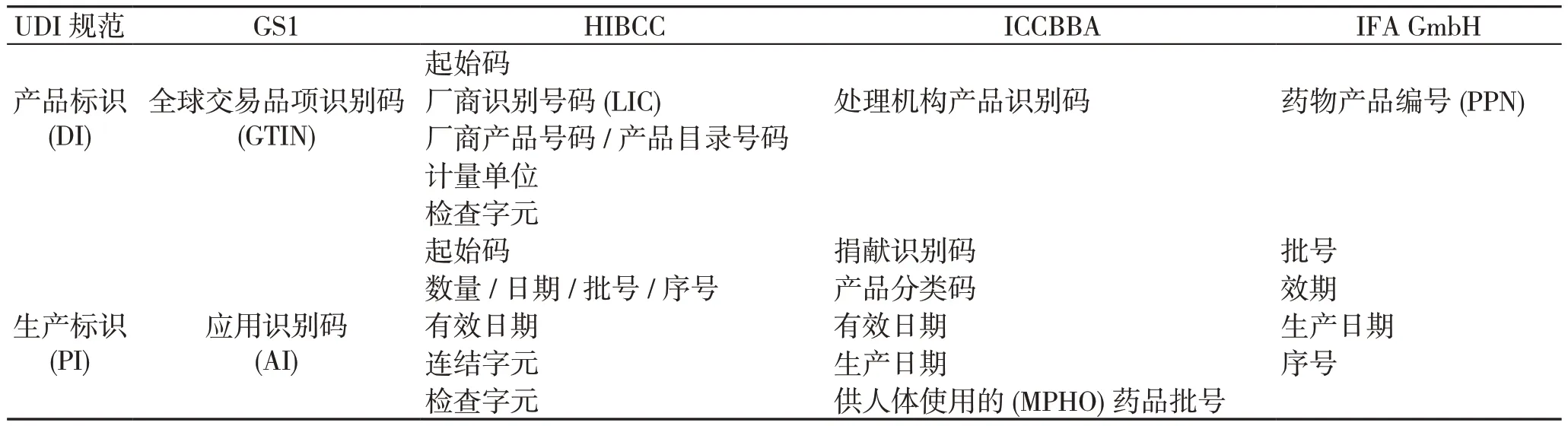
表7 UDI规范与四家发码机构UDI标准对应表
