柑橘皮的营养成分及体外降解率测定
2020-12-11杜秦娇孔倩茹
杜秦娇,孔倩茹,孙 莉,王 磊,郑 琛
(甘肃农业大学 动物科学技术学院,甘肃 兰州 730070)
柑橘(Citrus)为芸香科柑橘属植物,柑橘产量居世界百果之首[1]。在世界上146个国家及地区均有栽培,我国是柑橘的重要产地之一,资源十分丰富。我国柑橘年产量可达3 816.8万t,橘片罐头占柑橘加工制作业的80%以上,是我国传统的出口产品之一,但加工剩余的柑橘皮尚未作为饲料广泛用于饲喂家畜,研究具有高营养价值的饲料来节省饲料资源显得尤为重要。柑橘的皮、脉络和果核都含有丰富的糖分、粗脂肪、维生素、氨基酸和矿物质等营养成分。但目前,在我国仅有少量柑橘皮作为陈皮以供药用,其余大部分被当作垃圾丢弃,既浪费资源,又污染环境,柑橘皮的处理已经成为柑橘加工企业的头号难题。罗巧慧[2]等认为,将柑橘皮作为饲料饲喂畜禽,均有较高的饲喂价值,此外,柑橘皮含有大量的可消化无氮浸出物和果胶,能为反刍动物等家畜提供一定的能量,可作为反刍动物饲粮中的能量饲料部分替代。因此,本项目在对新鲜和风干柑橘皮进行养分测定的基础上,通过体外产气试验评价柑橘皮的产气状况和体外养分降解率,以期为柑橘皮在反刍动物饲养中的应用提供基础数据。
1 材料与方法
1.1 试验样品的采集和制备
购买新鲜柑橘皮保留,经自然风干制成风干样品,再用植物粉碎机(型号:FZ102)粉碎并通过孔径为0.425 mm的标准筛制样,分析样品密封保存备用。
1.2 试验仪器与药品
1.2.1 试验仪器 植物粉碎机(FZ102)、电热恒温鼓风干燥箱(DHG-9070A)、陶瓷纤维马弗炉(TM-3012P)、电子天平(AL104)、移液枪(TopPette)、分光光度计(756PC)、恒温水浴锅(XMT-DA)、水浴恒温振荡器(SHA-B)、气相色谱仪(Aglient,6890N)、低速离心机(SC-3610)、酸度计(PB-10)、台式高速冷冻离心机(TGL-16M0)等。
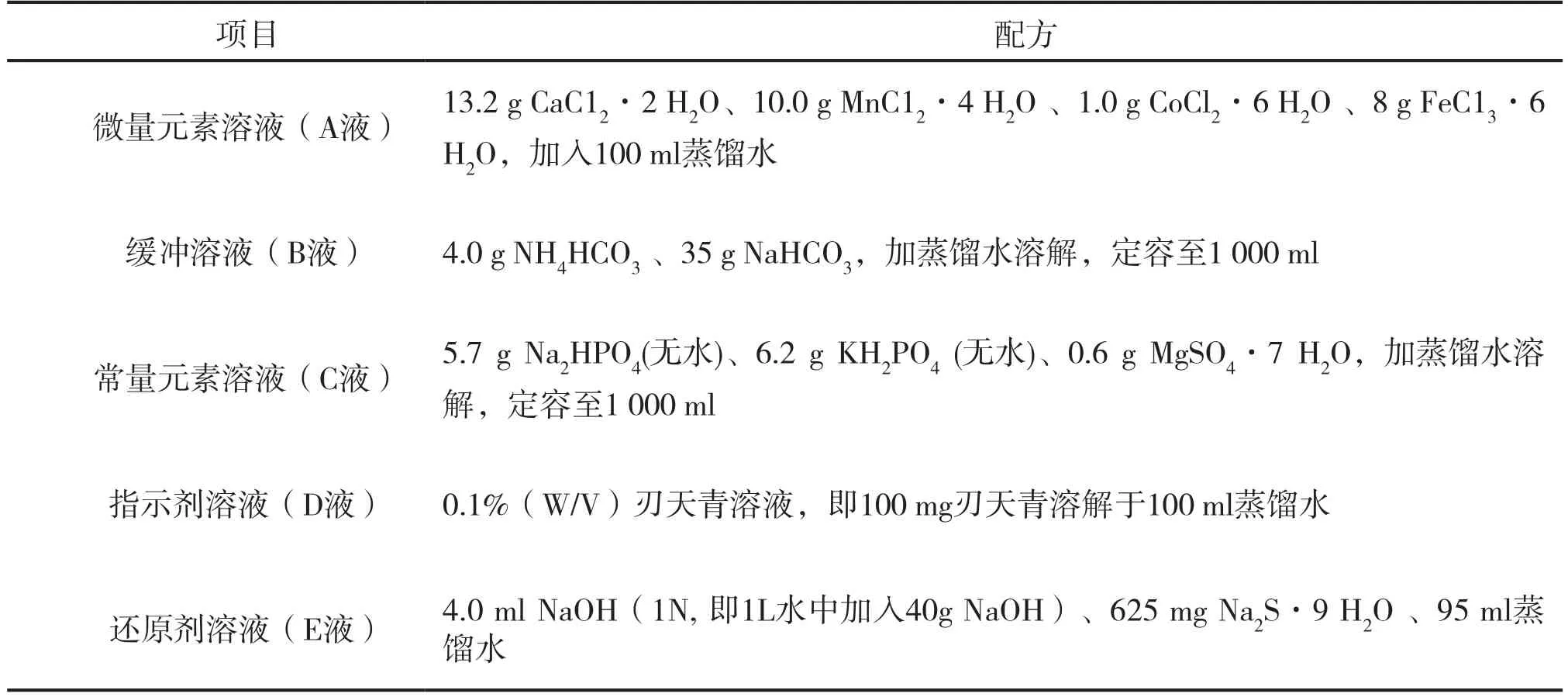
表1 人工瘤胃缓冲液的A、B、C、D、E各溶液配方
研钵、铝盒、烧杯、容量瓶、刻度移液管、离心管、万用电炉、滤纸、纱布、针管、医用氧气袋、二氧化碳气体罐、气体样品采集袋、干燥器、自制72孔有机玻璃支架、保温壶。
1.2.2 试验药品 氯化钙、氯化铁、氯化钴、氯化锰、碳酸氢铵、无水磷酸氢二钠、磷酸氢钾、碳酸氢钠、硫酸镁、硫化钠、40% 氢氧化钠、刃天青。
1.3 试验方法
1.3.1 人工瘤胃缓冲液的制备 进行体外模拟瘤胃发酵培养,人工瘤胃的缓冲液按照Menke和Steingass[3]方法配制,见表1。配方为:400 ml蒸馏水、0.1 ml微量元素溶液(A液)、200 ml缓冲液(B液)、200 ml常量元素溶液(C液)、1.0 ml刃天青溶液(D液),用CO2气体饱和并且升温至39℃后,加入40 ml还原溶液(E液),继续通入CO2,至溶液由淡蓝色逐渐转变为无色。
1.3.2 瘤胃液的采集 于屠宰场屠宰绵羊时收集3只以上绵羊的新鲜瘤胃液,经4层纱布过滤,转移到预热处理过的保温壶中,迅速带回实验室置于39℃恒温水浴箱中保存,连续通入CO2,待用。
1.3.3 体外培养程序 人工瘤胃体外培养采用Menke等的体外产气法进行[3]。准确称取干物质含量为0.2 g的柑橘皮,置于体外产气注射器中,加入始终依靠CO2气体饱和的瘤胃微生物培养液30 ml,尽快排出注射器中气体,用胶管及胶管夹封住注射器前端,记录注射器活塞的初始刻度读数(ml)。在39℃恒温水浴锅上平稳放置自制72孔有机玻璃支架,将注射器头朝下插入支架孔中连续培养(水浴锅内水面高度必须要淹没注射器内培养液高度)[4]。分别培养3 h、6 h、12 h、24 h。每个时间段9个重复。每批样品做3个空白对照,记录注射器活塞的位置读数(ml)。
1.4 测定指标
1.4.1 营养成分的指标及测定方法
干物质(DM):100~105℃烘干法;
粗蛋白质:凯氏半微量定氮法;
粗脂肪(EE):索氏浸提法;
粗纤维:酸碱消煮法;
粗灰分:550~600℃高温氧化法;
无氮浸出物=1-粗蛋白质-粗脂肪-粗纤维-粗灰分-水分
1.4.2 产气量的测定及计算 分别在培养3 h、6 h、12 h、24 h时记录产气量,同时将产气结束后的注射器内的培养液转移到100 ml离心管中离心冻存待用。

式中:t是指发酵开始后的某一时间(h);GPt是指样品在t时刻的产气量(ml);Vt是指样品发酵t小时后培养管刻度读数;Vo是指样品在开始培养时空白培养管刻度读数[5]。
1.4.3 pH的测定 培养结束后获得的培养液,立即用高精度酸度计(PB-10型)测定培养液的pH值。
1.4.4 干物质降解率的测定及计算 将产气结束后的残液转移至离心管中,在低速离心机中离心10 min,弃上清液,保留残渣。将离心管在105±2℃ 烘箱中烘3 h后取出,在干燥器中冷却30 min,称重至恒重。
干物质降解率(W%)的计算:
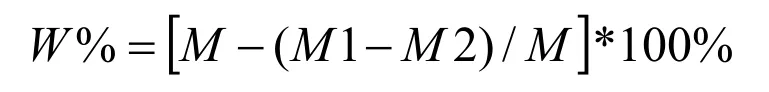
式中:M为试样的质量(g);M1为残渣和消化管的质量(g);M2为消化管的质量(g)[6]。
1.4.5 甲烷的测定 在产气结束后,将注射器针头的夹子松开,迅速将注射器中的气体注入气体样品采集袋中,立即测定气体样品中的甲烷含量。使用气相色谱仪(Aglient,6890N )测定气体样品中甲烷的含量。色谱柱为AT·SE-30 毛细管柱(中国科学院兰州化学物理研究所)。色谱条件为:进样口温度为 100℃;N2流量为1.7 ml/min;分流比 15:1;恒温模式(100℃3 min);FID250℃;FID 空气、H2和N2流量分别为 450 ml/min、40 ml/min 和 45 ml/min[7]。
1.4.6 挥发性脂肪酸的测定 将冻存的培养液在室温下解冻,用低速离心机(5 000 r/min)离心10 min。用移液枪吸取1 ml转移至1.5 ml离心管中,加入0.2 ml 2EB去蛋白溶液摇匀。冰水浴30 min,在高速冷冻离心机(10 000 r/min 4℃)离心10 min[8]。使用气相色谱仪测定样品中挥发性脂肪酸的含量。色谱柱选用HP 19091N-213毛细管柱。色谱条件:进样口温度220℃;N2流量2.0 ml/min;分流比 40∶1;恒温模式(120℃3 min,然后10℃/min至180℃,保持1 min);FID250℃;FID 空气、H2和N2流量分别为 450 ml/min、40 ml/min 和 45 ml/min[7]。
1.5 数据统计分析
试验数据经Excel整理后,用SPSS17.0软件进行单因素方差分析,差异显著时,采用Tukey法进行多重比较,P< 0.05作为差异显著的判断标准。
2 结果与分析
2.1 柑橘皮的营养水平
从表2可以看出,柑橘皮渣常规养分含量为:粗蛋白质(CP)6.6%含量较低,粗脂肪(EE)2.3%,粗纤维(CF)9.7%含量较低,粗灰分(Ash)3.1%,无氮浸出物(NFE)57.3%含量较高,钙(Ca)0.57%、磷(P)0.21%,钙磷比接近2∶1。
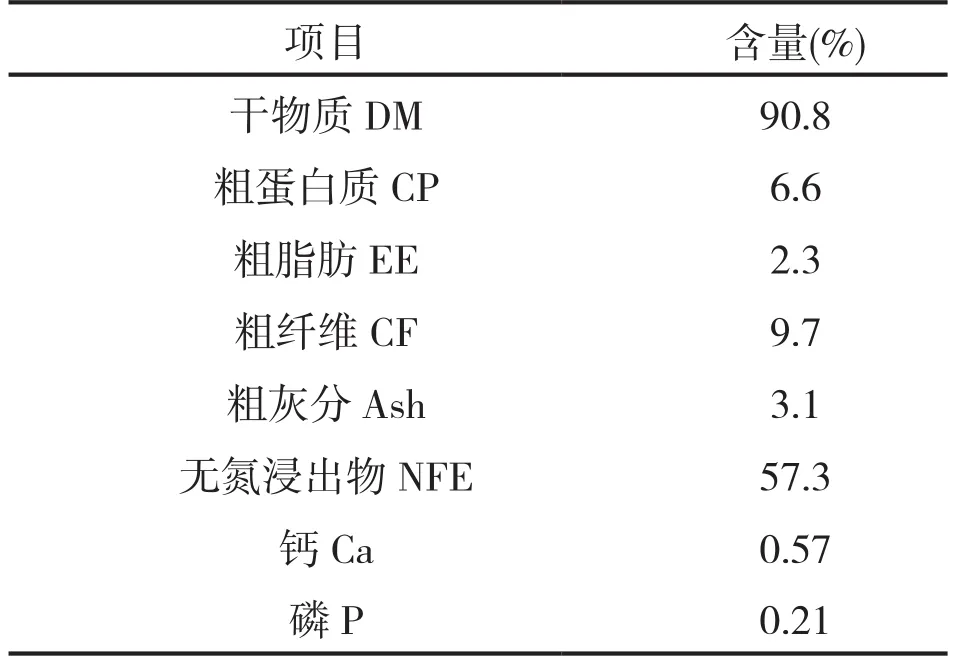
表2 柑橘皮的营养水平(风干基础)
2.2 产气量、甲烷产量及干物质降解率
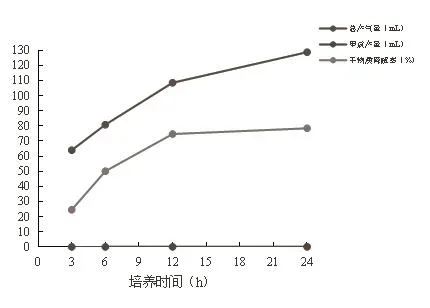
图1 体外培养总产气量、甲烷产量及干物质降解率动态变化

表3 体外发酵产气量、甲烷产量及干物质降解率
从表3及图1可以看出,培养24 h的产气量显著高于培养3 h、6 h、12 h的产气量,培养12 h的产气量显著高于培养3 h、6 h的产气量,培养6 h的产气量显著高于培养3 h的产气量。随着时间的延长,甲烷产量逐渐增加。培养24 h、12 h的干物质降解率显著高于培养3 h、6 h的干物质降解率,培养6 h的干物质降解率显著高于培养3 h的干物质降解率。
2.3 体外培养液pH和挥发性脂肪酸(VFA)浓度
从表4、图2和图3可以看出,培养3 h、6 h、12 h、24 h的pH没有差异显著,且各处理组培养液的pH在6.53~6.62范围内。培养24 h的TVFA、乙酸百分比例显著高于培养3 h、6 h、12 h的TVFA、乙酸百分比例,培养12 h、6 h的TVFA、乙酸百分比例显著高于培养3 h的TVFA、乙酸百分比。培养24 h的乙酸:丙酸比显著高于培养3 h、6 h、12 h的乙酸:丙酸比,培养12 h的乙酸:丙酸比显著高于培养3 h、6 h的乙酸:丙酸比,培养6 h的乙酸:丙酸比显著高于培养3 h的乙酸:丙酸比。培养3 h的丙酸百分比例显著高于培养6 h、12 h、24 h的丙酸百分比例,培养6 h的丙酸百分比例显著高于培养12 h、24 h的丙酸百分比例。培养12 h、24 h的丁酸百分比例显著高于培养3 h、6 h的丁酸百分比例。培养24 h的异戊酸百分比例显著高于培养3 h、6 h、12 h的异戊酸百分比例,培养12 h的异戊酸百分比例显著高于培养3 h、6 h的异戊酸百分比例。培养3 h、12 h、24 h的戊酸百分比例显著高于培养6 h的戊酸百分比例。产出的挥发性脂肪酸含量处于较高水平。随着时间的延长,TVFA、乙酸、丁酸、异戊酸、戊酸的百分比含量逐渐升高,丙酸百分比下降。
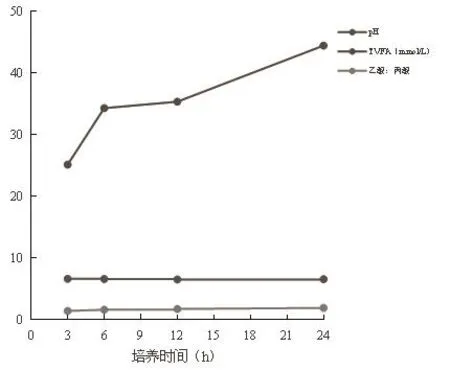
图2 体外培养pH、TVFA及乙酸:丙酸动态变化
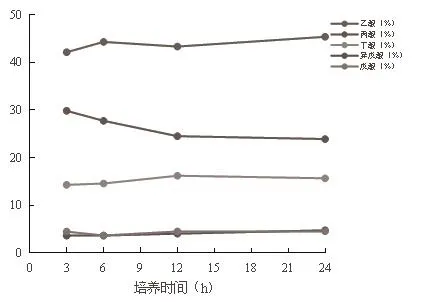
图3 体外培养乙酸、丙酸、丁酸、异戊酸及戊酸百分比例动态变化

表4 体外培养液pH和VFA浓度
3 讨论
3.1 柑橘皮的营养成分分析
饲料是动物机体生长发育所需的营养来源,为指导动物生产实践中饲料营养分配合理,保障动物机体正常的生长发育[9],需要对饲料进行营养成分分析。通过对柑橘皮营养成分含量的概略养分分析,以干物质(DM)90.8%为基础计算,柑橘皮中含无氮浸出物(NFE)63.1%,粗蛋白质(CP)含量7.27%、粗纤维(CF)含量10.68%,且根据柑橘皮的纯养分分析,其钙磷比接近2∶1[10],属于能量饲料。与罗巧慧等提供的参考数据:无氮浸出物(NFE)55.3%~71.6%,粗蛋白质(CP)6.4%~10.7%,粗纤维(CF)7.8%~18.5%,钙(Ca)0.34%~1.68%、磷(P)0.07%~0.27%[2]对比都处于参考范围之内。所以柑橘皮能被用作反刍动物的饲料原料,部分替代其饲粮中的能量饲料[11]。
3.2 产气量、甲烷产量及干物质降解率的数据分析
一定时间段的产气量可以反映饲料被瘤胃微生物的消化利用情况,评定饲料的营养价值[12]。甲烷是瘤胃微生物利用碳水化合物发酵后的产物,甲烷的产量的高低能反映出饲料能量在反刍动物体内损失的多少,同时,甲烷作为温室气体,能吸收红外线,破坏大气中的臭氧层,大量排放会污染空气,危害环境[13]。通过本试验所测得的数据表明:柑橘皮在人工瘤胃中降解速度比较快,表明可降解有机成分比较多,导致产气量较高。若将柑橘皮作为反刍动物的能量饲料使用,由于瘤胃中干物质降解率较高,为反刍动物提供较多养分,能有效节省饲料饲喂量,降低成本。并且与其他能量饲料相比[14]柑橘皮产生的甲烷较少,因此将柑橘皮作为饲料饲喂反刍动物有利于环保。而调控反刍动物瘤胃内甲烷生成的主要影响因子有日粮组成、植物成分、抗生素含量、化学益生素含量等[15],柑橘皮在瘤胃发酵过程中有抑制甲烷产生的作用,表明柑橘皮中含有部分植物成分、抗生素以及其他化学益生素,在发酵过程中调控降低甲烷生成,关于柑橘皮中具体调控甲烷生成的影响因子及其作用机理还需做进一步研究来论证。
3.3 pH和挥发性脂肪酸的数据分析
瘤胃液pH是评价反刍动物瘤胃内酸中毒的指标之一[16],通过测定反刍动物瘤胃pH可为研究饲料饲养效果,提高生产性能建立稳固基础[17]。本试验中,培养液pH处在有利于瘤胃微生物的生长、发育和发酵的pH范围(5.5~7.5)内[18],表明柑橘皮在反刍动物消化过程中不会大幅改变瘤胃内酸碱环境。瘤胃发酵产生的挥发性脂肪酸通过瘤胃上皮吸收进入动物机体,是反刍动物获得能量的最主要来源[19],瘤胃发酵过程中产生的挥发性脂肪酸含量的多少直接影响反刍动物的生长发育。本试验中,挥发性脂肪酸产量较高与干物质的降解率较高相互印证,且各组分比例相对适中,乙酸:丙酸比例较为合理。挥发性脂肪酸作为瘤胃微生物发酵的终产物,是供应反刍动物进行能量代谢的主要形式[3],而本试验中丙酸百分比例较高,说明把柑橘皮作为反刍动物饲料使用,能使更高含量的丙酸通过瘤胃上皮吸收,用于机体自身生长发育,从而发挥效用。
4 结论
柑橘皮干物质中粗蛋白质(CP)含量7.27%、粗纤维(CF)含量10.68%,属于能量饲料;体外培养总产气量和干物质降解率较高,丙酸百分比例较高,有利于改善反刍动物瘤胃发酵。
