PAMAM修饰的磁性碳纳米管固定化脂肪酶在生物柴油制备中的应用研究
2020-12-11范艳利杨玉民牛江秀
范艳利, 杨玉民, 牛江秀
(洛阳师范学院食品与药品学院, 河南洛阳 471934)
生物柴油作为一种可再生、 环境友好及易于生物降解的生物燃料, 可以缓解与化石燃料有关的能源危机和环境污染问题[1]. 目前, 生物柴油的制备方法主要有化学法、 酶催化法等[2]. 然而, 化学方法由于能量需求高、 催化剂难回收及环境压力大等原因受到限制. 近年来, 酶(脂肪酶)催化法受到越来越多的关注, 因为这种工艺是在温和的条件下进行的, 并且对于含有大量脂肪酸的原料也可以使用[2]. 同时, 酶固定化能有效地提高脂肪酶的稳定性和重复使用性[3].
近年来, 各种磁性纳米复合材料被广泛应用于酶的固定化方面, 如磁性纳米颗粒、 磁性纳米管和磁性石墨烯等[4]. 这些材料减少了传质阻力、 简化了工业废物处理, 而且通过简单的磁体可以实现酶的回收再利用[5]. 磁性碳纳米管(m-CNTs)具有纳米级尺寸、 高比表面积、 大量极性官能团、 丰富的孔结构、 有效热传导性以及生物相容性等优点, 已成为研究热点[6]. 然而, m-CNTs不能为脂肪酶固定化提供足够的活性位点. 有研究报道, 树枝状分子功能化的磁性多壁碳纳米管(m-MWANTs-PAMAM)可以提供大量的活性位点, 以提高葡萄糖淀粉酶的固定化率[5].
固定化脂肪酶催化短链醇与油脂反应制备生物柴油已有大量报道[7], 其中反应介质对酶的催化性能有较大影响, 研究较多的是叔丁醇体系[8]和无溶剂体系[9]. 有机溶剂不仅影响反应体系的传质, 而且对酶的结构和活性有很大影响. 在不同溶剂中酶表现出不同的催化活性、 操作稳定性、 底物选择性和动力学特性. Lu等[10]研究了Candidasp. 99-125在12种不同溶剂中催化甘油三油酸酯甲醇分解反应的性能, 发现影响酶催化的根本原因是有机溶剂的疏水性, 研究结果显示, 正辛烷作为介质时, 生物柴油产率最高, 接近50%. 在大多数亲水性有机溶剂体系中, 如苯酚、 苯二酚、 N, N-二甲基甲酰胺, 固定化酶RML催化制备的生物柴油得率都不是很高. 有报道已经证明, 相对疏水性有机溶剂(logP> 2)作为生物柴油生产的反应介质时, 酶表现出较高的活性[11]. 然而, 也有研究表明, 溶剂和生物柴油得率之间不呈线性关系, 它们之间的关系近似S形曲线[10]. 此外还发现, 固定化酶RML在叔丁醇体系中表现出良好的催化性, 这可能是因为甘油和甲醇在叔丁醇溶剂中具有良好的溶解度. 故可以削弱甘油和甲醇对脂肪酶活性和稳定性的消极影响, 脂肪酶在这种反应介质中表现出相当较好的稳定性. 总体来看, 固定化酶RML催化制备生物柴油得率都低于50%, 可能由于固定化酶RML的催化活性受到过量甲醇的抑制(这个试验时甲醇是一次性添加的). RML是一种1,3-特异性脂肪酶[12], 通常以游离、 固定化和全细胞形式作为催化剂用于生物柴油的制备[13].
本文通过共价结合将RML固定于三代树枝状分子PAMAM功能化的磁性多壁碳纳米管(m-MWANTs-G3)上, 用于制备生物柴油, 并对反应条件进行优化, 以提高转化率.
1 材料与方法
1.1 材料
1.1.1 主要仪器
GC-9790型气相色谱仪; 安捷伦HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm); 氢离子检测器(FID); N2000气相色谱工作站; MWCNTs(纯度大于95%, 直径为20~40 nm, 长度小于5 μm, 购自深圳纳米港有限公司).
1.1.2 试剂
RML(初始比酶活为4.61×103U/g-protein, 蛋白含量为3.7 mg/mL), 购自Sigma公司(St. Louis, MO, USA); 无水甲醇、 正壬烷、 异辛烷、 正辛烷、 正庚烷、 正己烷等有机试剂均为分析纯; 去离子水、 m-MWCNTs-G3复合材料为实验室自制; 大豆油购自本地超市, 油的成分见表1; 十七烷酸甲酯、 硬脂酸甲酯、 油酸甲酯、 棕榈酸甲酯、 亚麻酸甲酯、 亚油酸甲酯均为气相色谱标准品, 均购于Sigma-Aldrich公司.
1.2 方法
1.2.1 m-MWCNTs-G3复合材料的活化
将0.1 g m-MWCNTs-G3分散于无水乙醇中, 加入一定量的25%戊二醛, 置于恒温摇床(200 rpm)中30℃条件下反应10 h, 得到醛基活化的m-MWCNTs-G3(m-MWCNTs-G3-GA). 用无水乙醇和去离子水分别洗涤数次, 最后在60℃真空下干燥24 h, 备用.
1.2.2 脂肪酶的固定化
将100 mg m-MWCNTs-G3-GA加入到磷酸盐缓冲液(0.05 M, pH=7.0, 4.5 mL)中, 再加入0.5 mL酶液, 超声作用使之分散均匀. 置于35℃、 200 rpm的恒温水浴摇床中振荡反应2.5 h, 然后用磁铁分离固定化酶, 并用过量的缓冲溶液洗涤数次, 洗去非特异性吸附和未结合的脂肪酶. 收集残液以检测蛋白质含量.
1.2.3 生物柴油制备
将2.19 g大豆油加入带塞子的50 mL锥形瓶中, 加入一定质量的固定化酶, 微量磷酸盐缓冲液和适量醇(所有计量都基于油重), 摇床转速200 rpm, 在一定反应温度条件下密封振荡反应. 定时取样, 离心后用气相进行检测分析. 另外, 为了减弱醇对酶的伤害, 采取醇三次等量添加的方式. 所有试验重复三次.
1.2.4 生物柴油检测
在12000r/min条件下对所取样品离心处理5 min, 取上清10 μL, 加入300 μL内标物(1 mg/mL十七碳酸甲酯和正己烷混合溶液)和290 μL正己烷有机溶剂, 混匀; 取1 μL样品进样.
INNOWAX毛细管柱, 30 m×0.25 mm×0.25 μm, 柱子温度以3 ℃/min的速率从初始温度180℃升高到230℃, 在230℃维持3 min; 进样口温度和检测器温度分别为230℃和280℃.
生物柴油得率通过以下公式计算[14]:
2 结果与分析
2.1 大豆油成分分析
通过GC-MS对大豆油进行定量检测, 分析结果如表1所示.

表1 GC-MS分析大豆油中脂肪酸的组成
2.2 脂肪酶的固定化
RML游离氨基与醛基化的复合材料m-MWCNTs-G3(如图1所示)通过共价结合实现固定化. 为了更直观地观察酶是否结合到载体上, 将RML酶用绿色荧光(FITC)进行染色, 借助共聚焦荧光显微镜观察RML酶的固定化情况. 如图2所示, 图中的a、 b和c分别表示明场、 暗场和叠加场, 通过叠加场可以很清楚地看到FITC标记的RML酶固定到了载体上.

图1 m-MWCNTs-G3的结构图
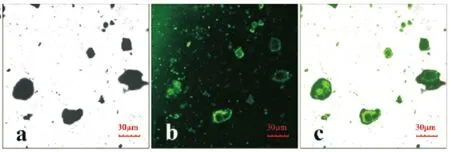
图2 FITC标记的固定化酶的共聚焦荧光图片(a: 明场, b: 暗场, c: 叠加场)
2.3 m-MWCNTs-G3固定化脂肪酶催化制备生物柴油
将固定化脂肪酶RML&m-MWCNTs-G3用于催化生物柴油的制备. 对影响大豆油转酯制备生物柴油的因素: 加水量、 醇的添加策略、 有机溶剂、 醇油比等进行优化, 以获得最大转化率.
2.3.1 加水量对生物柴油制备的影响
在酶催化反应中, 水对酶的稳定性和催化活性有重要的影响[15]. 水不仅参与转酯反应过程进而影响反应平衡[16], 同时脂肪酶是一种界面酶, 在水-油界面具有独特的特性, 在很大程度上其活性依赖于界面面积. 然而, 过量的水使酶的“柔性”变大, 影响酶的催化活力, 同时可能发生水解副反应. 表2列出了在对应的正辛烷体系中, 不同加水量的条件下生物柴油得率的情况. 可以清楚地看出, 在有机溶剂体系中, 为了维持酶的活性, 一定量的水是必须的. 反应得率不仅依赖于溶剂的类型, 而且明显依赖于加水量. 随着加水量的增加, 生物柴油得率有所提高. 当加水量为10%时, 得率最高; 继续增加加水量, 得率开始降低.
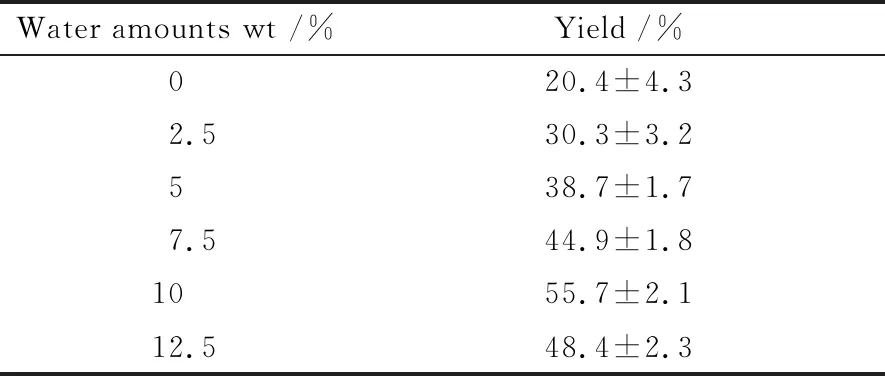
表2 在不同的水含量条件下生物柴油得率a
2.3.2 有机溶剂添加量对生物柴油制备的影响
通过试验, 最适有机溶剂是正辛烷, 加水量为10%. 在这些反应条件下, 研究有机溶剂添加量对生物柴油制备的影响, 其最适添加量如图3所示. 正辛烷添加量为15%时, 生物柴油得率最高. 同时, 数据显示, 在有机溶剂体系中不管选择甲醇还是乙醇作为底物, 其生物柴油的得率都高于无溶剂体系. 另外, 甲醇作为底物时, 其生物柴油得率(脂肪酸甲酯, FAME)都高于乙醇作为底物时的生物柴油得率(脂肪酸乙酯, FAEE), 表明甲醇更适合作为酶的底物, 这一结果和以前报道的结果相符[17-18]. 因此, 在后面的试验中选取甲醇作为底物.

图3 正辛烷加入量对生物柴油得率的影响
a反应条件: 将10 wt%的固定化酶加入2.19 g大豆油中, 其中含有20 wt%正辛烷有机溶剂, 醇油摩尔比为4∶1, 甲醇分三次加入, 分别在0, 4 h和8 h加入, 在200 rpm, 40℃的条件下反应12 h. 取平均值,±代表标准偏差(SD).
2.3.3 醇油比对生物柴油制备的影响
在上述条件下, 研究了醇油比对固定化酶催化制备生物柴油得率的影响, 结果如图4所示.
醇在酯交换反应中有双重作用: 一方面, 它作为底物参与反应. 酯交换反应是一个可逆反应, 理论上, 完全转酯化生成脂肪酸甲酯需要3摩尔当量的甲醇, 但实际反应中过量的甲醇可以促进反应向正方向移动, 从而提高生物柴油的得率; 另一方面, 当反应体系中甲醇过量时, 甲醇对酶表现出毒性作用, 从而抑制酶的催化活力. 对于不同的酶, 其催化转酯反应所需的醇油比也不同. 对于固定化酶RML而言, 最适醇油比为5∶1(见图4).
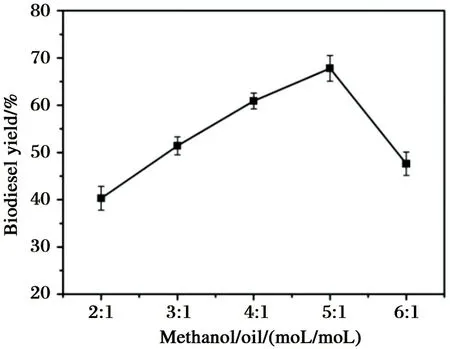
图4 醇油比对生物柴油得率的影响
2.3.4 反应温度对生物柴油制备的影响
在上述条件下, 研究了反应温度对固定化酶催化制备生物柴油得率的影响, 如图5所示. 为了防止脂肪酶的热失活, 酶催化反应通常是在较低的温度下进行. 另一方面, 提高温度可以增加分子之间的碰撞频率, 促使反应向吸热方向移动[19]. 从图5可以看出, 在50℃时, 获得最高生物柴油得率, 温度进一步升高, 其生物柴油得率呈现下降的趋势.

图5 温度对生物柴油得率的影响
2.3.5 固定化酶添加量对生物柴油制备的影响
固定化酶添加量对生物柴油制备的影响结果如图6所示. 在制备生物柴油其他条件最优的情况下, 加入不同量的固定化脂肪酶. 随着加酶量的增加, 生物柴油的得率也提高, 固定化酶RML添加量为6%时, 获得最高生物柴油得率, 加酶量继续增加, 生物柴油的得率不仅没有提高, 反而导致生物柴油得率降低. 这主要是由于过量的加酶量容易使酶团聚, 从而增大传质阻力.
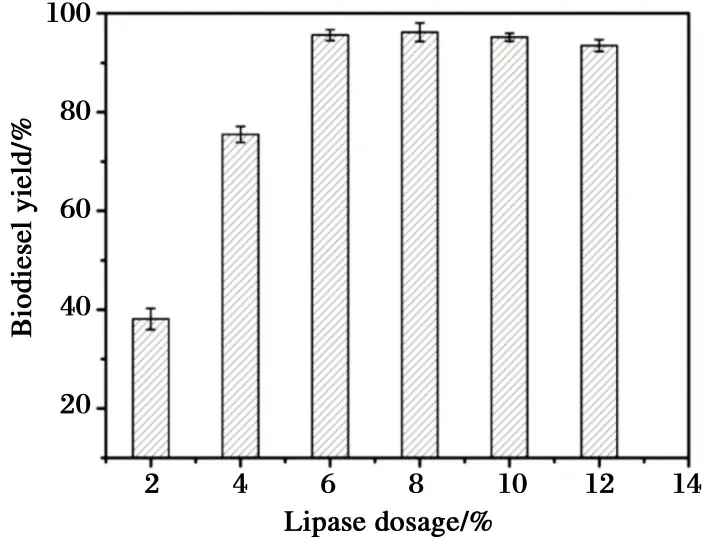
图6 加酶量对生物柴油得率的影响
2.3.6 固定化酶的操作稳定性
酶固定化的目标之一是容易回收和再利用. 重复使用性是评价固定化酶效果的一个重要参考因素. 为了研究固定化酶在生物柴油制备中的重复使用性, 每一批次反应结束后用磁铁回收固定化酶, 再用相应的溶剂清洗后投入下一批次新的反应液中. 固定化酶RML每一批次的反应时间为36 h, 其他反应条件不变, 研究了固定化酶的重复使用性, 结果如图7所示. 固定化酶RML在重复了10个批次之后生物柴油得率为80.5%, 说明固定化酶具有良好的稳定性. 在重复使用过程中, 由于固定化酶活力下降以及脂肪酶的脱落导致生物柴油得率降低. 相比物理吸附, 共价交联可以有力地减少酶的脱落. 然而, 由于甲醇和副产物甘油在正辛烷中的低溶解度, 随着批次的增加, 它们吸附在固定化酶的表面, 增大了传质阻力, 从而导致生物柴油得率的降低.

图7 固定化酶的重复利用
3 结论
本研究通过共价结合将脂肪酶RML固定于磁性纳米复合材料m-MWCNTs-G3上, 并将固定化酶用于催化大豆油与甲醇的转酯反应制备生物柴油. 实验结果表明, 在优化条件下, 固定化酶RML对大豆油表现出了良好的催化效果和稳定性. 研究结果有望在其他的领域, 如手性药物拆分、 不饱和脂肪酸富集等中也有广泛的应用价值.
