慢病毒介导的AP-1基因沉默对卵巢癌SKOV3细胞增殖和凋亡及Survivin表达影响的研究
2020-12-11杨定英肖雁冰蒋成素
杨定英,肖雁冰,涂 皎,蒋成素
(遵义医科大学附属妇幼保健院,贵州 遵义 563000)
在我国,卵巢癌发病率居女性生殖系统肿瘤第三位,而死亡率位于女性生殖道恶性肿瘤之首,是严重威胁女性健康的恶性肿瘤[1]。近年来,肿瘤基因靶向沉默策略是肿瘤防治的新方向。RNA干扰(RNA interference,RNAi)是一种由小分子 RNA(Small interference,siRNA)介导的靶向沉默目的基因技术,能特异性、高效性地抑制目的基因表达,进而抑制肿瘤细胞生长。
Survivin 是凋亡抑制因子(Inhibitorof apoptosis proteins,IAPs)家族的成员之一[2],其抑制细胞凋亡和调节细胞周期的双重功能与肿瘤的发生相关[3-5],表达量随着临床分期和组织学分级的升高而增加[6-7],是判断卵巢癌预后的重要因子[8],高表达与预后不良、对化疗药物耐药及放射治疗不敏感密切相关[9]。干扰Survivin表达或功能,可达到抑制肿瘤细胞生长、迁移和侵袭能力,增加肿瘤细胞对化疗药物敏感性[10-12]。激活蛋白-1(Activator protein-1,AP-1)是一类基因编码的核转录因子,1987年美国科学家 Lee 等[13]首次发现,是由含碱性亮氨酸拉链(Basic leucine-zipper,bZIP)结构的Jun蛋白家族、Fos蛋白家族等形成的高度保守的同源或异源二聚体[14],是调节细胞生存和死亡的关键转录因子之一[15],对基因表达大都起正性调控作用,与细胞的增殖、凋亡有关。研究显示,卵巢癌组织中AP-1及Survivin阳性表达率和阳性信号表达强度均明显高于正常卵巢组织、卵巢良性及交界性肿瘤,说明AP-1及Survivin对卵巢癌的发生、发展可能起着促进作用[16]。但AP-1是否调控卵巢癌细胞的增殖和凋亡,其调控是否与Survivin的表达相关,目前尚未见报道。
本研究目的在于通过RNAi 技术靶向沉默卵巢癌SKOV3细胞中AP-1基因的表达,观察SKOV3细胞增殖及凋亡情况,并通过实时荧光定量PCR及Western blot检测SKOV3细胞Survivin mRNA及蛋白表达水平,探讨AP-1基因基因沉默对卵巢癌SKOV3细胞增殖、凋亡的调控,以期为卵巢癌的治疗提供一种新的策略。
1 材料与方法
1.1 细胞及主要主要试剂 SKOV3细胞由湖南丰晖生物科技有限公司代购;DMEM培养基及胎牛血清购自美国Gibco公司;转染试剂Polybrene购自美国Sigma-Aldrich公司;质粒小提及质粒大提试剂盒购自中国TIANGEN BIOTECH公司;MTT细胞增殖检测试剂盒购自北京碧云天公司;AnnexinV-APC/7-ADD双染细胞凋亡检测试剂盒购自中国北京百奥莱博公司;SYBR® Green Realtime PCR Master Mix及ECL化学发光试剂盒购自中国GENVIEW;AP-1抗体、Survivin抗体、β-actin、GoatAnti-Mouse IgG/HRP及Goat Anti-rabbit IgG/HRP购自英国Abcam。
1.2 制备RNA干扰慢病毒 从Genebank获得AP-1特异性mRNA碱基序列,应用Invitrogen 公司的BLOCK-i T RNAi Designer,设计3对shRNA干扰靶序列,在 NCBI网站上检索出人基因数据库,将其与设计好的基因组数据进行比对,确保设计的靶序列基因与其他基因不同源,最终确定3条干扰靶序列shRNA。根据靶序列设计出3条siRNA序列,阴性对照组(negtive control,NC)序列为将其中一条序列打乱后获得。将筛选出的siRNA和NC序列分别设计合成为shRNA,即AP-1-shRNA-1:CGGACCTTATGGCTACAGTAA,AP-1-shRNA-2:GGAACAGGTGGCACAGCTTAA,AP-1-shRNA-3:CGCAAACCTCAGCAACTTCAA。根据设计的shRNA酶切位点,用Hpa I和Xho I 酶将PLL3.7载体双酶切。在1%琼脂糖凝胶中将上述酶切后的线性化载体进行电泳,将电泳后含有载体的凝胶切下后称重,胶融化后过滤,利用T4 DNA连接酶连接shRNA干扰片段与线性化载体,并转化DH5α感受态细胞,进行质粒提取、酶切鉴定及PCR 测序鉴定。将各组慢病毒感染SKOV3细胞后用流式细胞仪检测SKOV3细胞感染阳性率,实时荧光定量PCR和Western Blot验证AP-1基因的沉默效果。
1.3 慢病毒包装和病毒滴度的测定 慢病毒包装:①配制转染混合液:转染每一皿293T细胞需要 Opti-DMEM 1 mL、AP-1-shRNA-1/2/3质粒或shRNA-NC质粒5 μg、psPAX2质粒5 μg、pMD2G质粒3 μg及PEI试剂50 μL 。②涡旋震荡转染混合液,室温静置20 min,按1 mL/皿加入293T细胞,培养8 h后更换转染混合液为新鲜DMEM培养基,培养48 h后收集病毒液,并重新添加等量的DMEM培养基,再培养 24 h后,再次收集病毒液。③将收集好的病毒液混在一起,4 ℃、4 000 rpm离心10 min,过滤除菌。④对离心后的病毒液进行分装,冻存于-80 ℃备用,留取少量进行病毒测定。
病毒滴度测定:①将293T细胞按1×104个细胞/孔 (100 μL)接种于96孔板,培养 24 h。②每种病毒原液准备10个1.5 mL EP管,每管加入完全培养基90 μL,第一个管中加入10 μL病毒原液后混匀,吸取第一个管中的混合液体10 μL加入第二个管中混匀,再吸取第二个管中混匀的液体10 μL加入第三个管中混匀,以此类推,直到最后一管。③吸去96孔板中细胞培养液,加入②稀释好病毒液90 μL,培养72 h。④荧光显微镜下观察,并计数最后两个带有荧光的荧光细胞克隆个数,分别假设为X与Y,则滴度(TU/mL)=(X+Y×10)×1 000/2/X孔的病毒液的含量(μL)。
1.4 慢病毒感染SKOV3细胞 ①将SKOV3按5×104个细胞/孔(100 μL)接种于24孔板。②将AP-1-shRNA-1/2/3/和AP-1-sh RNA-NC从-80 ℃冰箱取出后置冰上自然融化。按照MOI=20(即每个细胞对应20个病毒)感染SKOV3细胞,需要病毒液体积=需感染细胞数目×MOI/病毒滴度,DMEM 培养基补足至1 mL,加入1 μL的1 000×polybrene(10 mg/mL)后混匀,封闭孔板,1 800 rpm离心1 h。③撕掉孔板封口膜后培养12 h,收集细胞于小培养瓶中培养。④取 2×105个细胞于EP管中,Staining Buffer洗1遍,用200 μL Staining Buffer重悬细胞放入流式管中,以不感染病毒组为对照组,上机检测阳性率。若阳性率达到90%以上,即为感染成功。
1.5 细胞分组 筛选出沉默AP-1效果最佳的慢病毒后,将SKOV3细胞分为Control组(SKOV3细胞),shRNA-NC 组(感染空载体慢病毒SKOV3 细胞),sh-AP-1组(感染慢病毒SKOV3细胞)。
1.6 MTT检测SKOV3细胞增殖 取Control组、shRNA-NC 组、sh-AP-1组SKOV3细胞以2×104/孔的密度接种到 96 孔板。每组细胞任选3个孔分别在0、24、48、72 h时加10 μL MTT溶液(5 mg/mL),培养4 h,吸出上清,每孔加入150 μL二甲基亚砜(DMSO),于酶标仪490 nm波长测定各孔的OD值,计算出每组细胞OD490的平均值。根据公式[细胞增殖率=(实验组)- (空白组)OD 平均值/(对照组)-(空白组)OD 平均值×100%]来计算细胞增殖率。
1.7 流式细胞术检测SKOV3细胞凋亡 取Control组、shRNA-NC 组、sh-AP-1组SKOV3细胞以1.5×105/孔的密度接种到 6孔板中。在相应时间点收集细胞,遵循细胞凋亡检测试剂盒的规程,取适量样本悬浮于5 mL流式管中,加入5 μL Annexin V-APC、5 μL 7-AAD混匀,避光反应15 min,流式细胞术检测细胞凋亡。用ModFitLT软件进行细胞凋亡相对定量分析,计算出细胞各时相百分比和凋亡率。
1.8 实时荧光定量PCR检测SKOV3细胞Survivin mRNA表达 引物的设计与合成由湖南丰晖生物公司完成,Survivin-184(F):5′-GGACCACCGCATCTCTACAT-3′ ,Survivin-184(R):5′-CCTTTGCATGGGGTCGTCAT-3′;GAPDH-127(F):5′-CCAGGTGGTCTCCTCTGA-3′ ,GAPDH-127(R):5′-GCTGTAGCCAAATCGTTGT-3′ 。向Control组、shRNA-NC 组、sh-AP-1组SKOV3细胞中加入Trizol裂解液提取总RNA,测定总RNA浓度。将 RNA反转录为cDNA,反应体系10 μL∶0.2 μL cDNA 、上、下游引物混合液(10 μmol/L) 0.6 μL、MasterMix(2×)5 μL、H2O;反应条件:热启动95 ℃ 3 min、95 ℃变性15 s、60 ℃退火30 s,72 ℃ 延伸30 s ,共40循环,延伸完全 72 ℃ 10 min。通过软件计算得到Survivin mRNA的值。
1.9 Western Blot检测SKOV3细胞Survivin 蛋白表达 向Control组、shRNA-NC 组、sh-AP-1组SKOV3细胞中加入 PMSF裂解液以提取蛋白,通过 BCA 蛋白质测定试剂盒对蛋白定量后,取 50 μg 蛋白样品变性处理后SDS-PAGE电泳、转膜及免疫反应,最后进行化学发光,显影,定影。以β-actin蛋白作为内参,利用灰度值分析软件Image J进行灰度测量,以 Survivin/β-actin 表示蛋白的相对表达量。
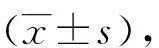
2 结果
2.1 重组干扰载体酶切及测序鉴定结果 PLL3.7载体只有一个EcoR I酶切位点,设计干扰shRNA序列时加入了EcoR I酶切位点。如果干扰片段准确连接至PLL3.7载体上,则载体中有两个 EcoR I酶切位点,酶切会出现2个条带;若干扰片段未能连接,酶切后只有1个条带。如图1所示,AP-1-shRNA-1/2/3以及AP-1-shRNA-NC均有2个条带,将条带正确的质粒送测序公司测序,如图2,对比分析可知,重组干扰载体AP-1-shRNA-1/2/3及AP-1-shRNA-NC成功构建。
M:DL10 000 Marker;1:载体PLL3.7;2:AP-1-shRNA-NC;3:AP-1-shRNA-1;4:AP-1-shRNA-2;5:AP-1-shRNA-3。 图1 重组干扰载体AP-1-shRNA经EcoR I单酶切鉴定
A:AP-1-shRNA-1测序结果比对图谱;B:AP-1-shRNA-2测序结果比对图谱;C:AP-1-shRNA-3测序结果比对图谱;D:AP-1-shRNA-NC测序结果比对图谱。图2 重组干扰载体AP-1-shRNA测序鉴定
2.2 慢病毒滴度测定 病毒进入293T细胞后,可以在荧光显微镜下观察到细胞呈绿色荧光,可据此来判断病毒包装情况。图3为病毒进入293T细胞后72 h在荧光显微镜呈现出来的效果,各组慢病毒滴度均大于2.0×108TU/mL。

ABCD为荧光显微镜下观察;EGFH为荧光显微镜下明场观察;I为各组慢病毒原液滴度。 AE:AP-1-shRNA-NC组;BG:AP-1-shRNA-1组;CF:AP-1-shRNA-2组;DH:AP-1-shRNA-3组。图3 荧光显微镜(72 h)下观察各组慢病毒感染293T细胞
2.3 慢病毒感染SKOV3细胞阳性率测定 如图4示,各组病毒感染SKOV3细胞的阳性率均大于90%,可以用于后续实验。

A:Control;AP-1-shRNA-NC;C:AP-1-shRNA-1;D:AP-1-shRNA-2;E:AP-1-shRNA-3。图4 各组慢病毒感染SKOV3细胞阳性率
2.4 AP-1-shRNA在mRNA及蛋白水平沉默AP-1效果 从实时荧光定量PCR结果来看(见图5 ):3组AP-1-shRNA均能在mRNA水平沉默AP-1表达,沉默效率接近40%~60%,大小排序为:AP-1-shRNA-3(58.8%)>AP-1-shRNA-2(51.0%)和AP-1-shRNA-1(50.2%)。从Western Blot结果来看(见图6):3组AP-1-shRNA均能在蛋白水平沉默AP-1,其强弱度排序为:AP-1-shRNA-3>AP-1-shRNA-2>AP-1-shRNA-1。3组病毒中AP-1-shRNA-3沉默AP-1效果最佳。
2.5 MTT法检测SKOV3细胞增殖情况 结果如图7示,sh-AP-1组细胞增殖率明显低于Control及shRNA-NC组。
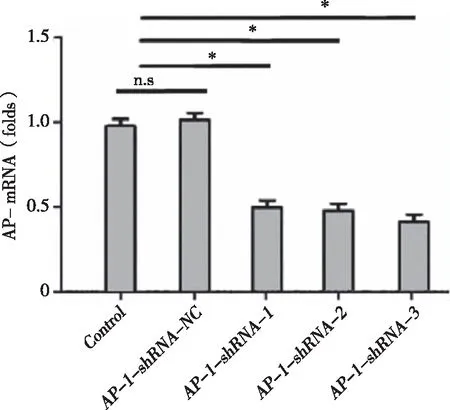
*:P<0.05;n=3。图5 各组慢病毒在mRNA水平沉默AP-1效果检测
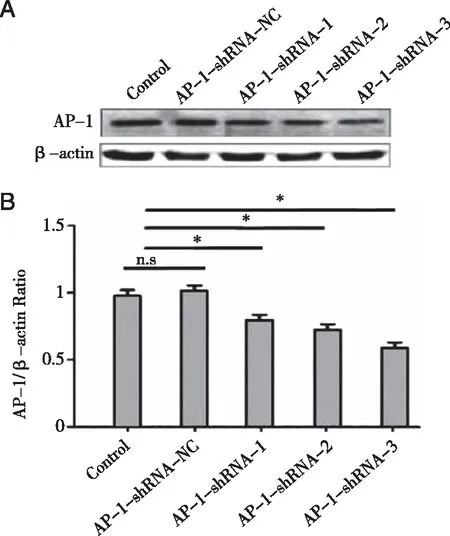
A:AP-1蛋白免疫印迹图;B:AP-1蛋白相对定量统计图。*:P<0.05;n=3。图6 各组慢病毒在蛋白水平沉默AP-1效果检测
2.6 流式细胞术检测细胞凋亡 如图8及表1示,在同一时间点,sh-AP-1组细胞凋亡率明显高于Control及shRNA-NC组(P<0.05)。
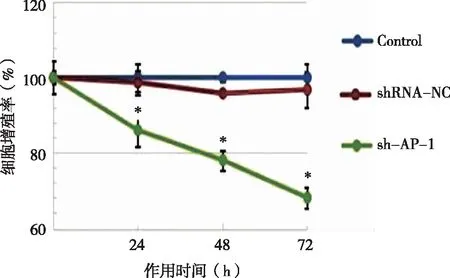
*:sh-AP-1组分别与Control组及shRNA-NC组比较,P<0.05,n=3。图7 沉默AP-1基因后SKOV3细胞增殖率检测
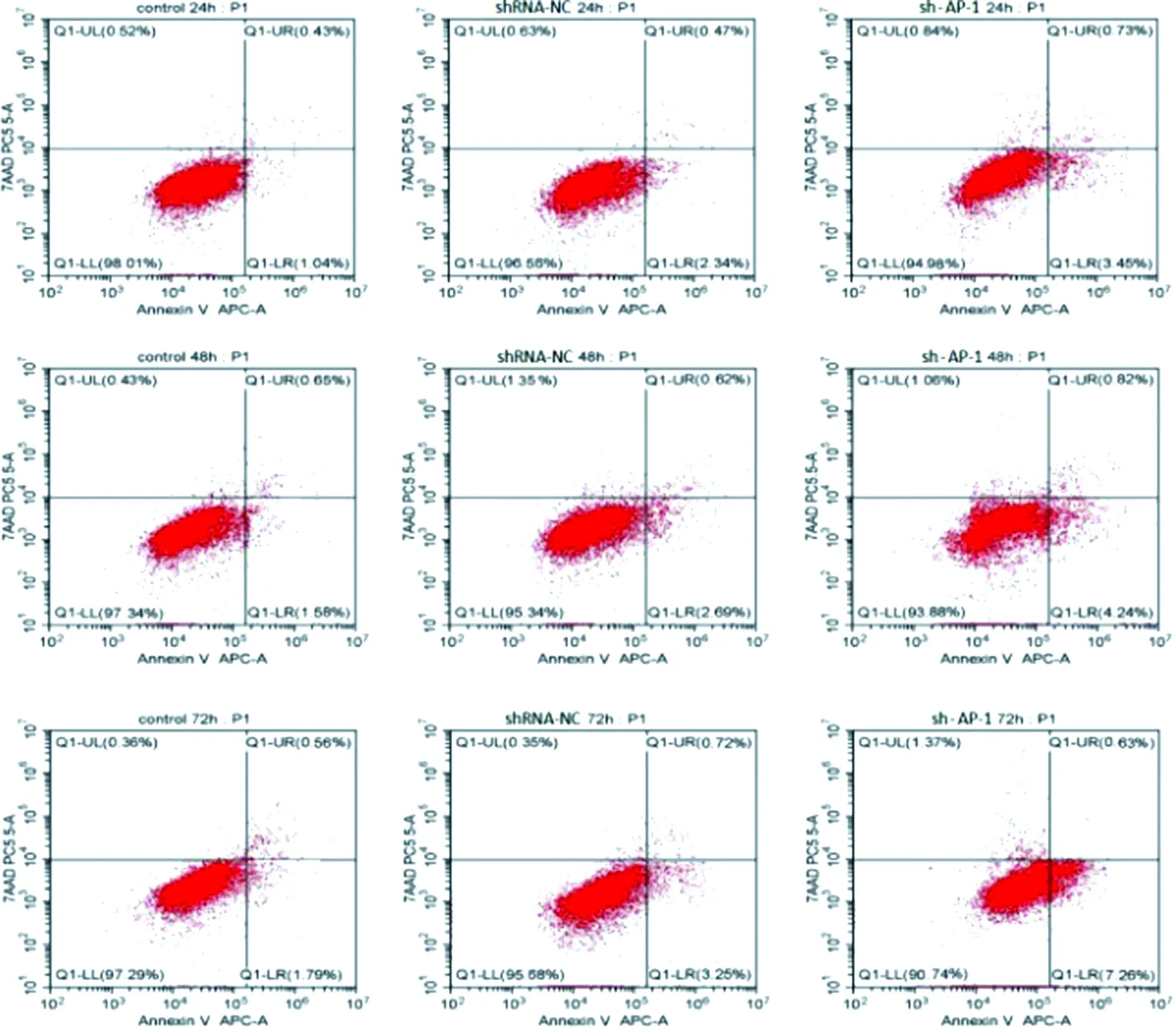
图8 沉默AP-1基因后SKOV3细胞凋亡率检测
表1 沉默AP-1基因后在不同时间点SKOV3细胞凋亡率
2.7 实时荧光定量PCR检测SKOV3细胞Survivin mRNA表达情况 如图9示,sh-AP-1组细胞Survivin mRNA低于Control及shRNA-NC组(P<0.05)。

图9 沉默AP-1基因后SKOV3细胞Survivin mRNA表达情况(n=3)
2.8 Western Blot检测SKOV3细胞Survivin 蛋白表达水平 如图10示,sh-AP-1组Survivin蛋白表达量较Control及shRNA-NC明显降低(P<0.05)。
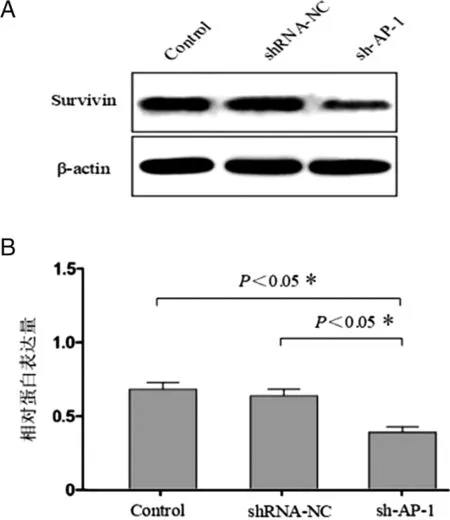
A: Survivin 蛋白免疫印迹图;B:Survivin 蛋白相对定量统计图;n=3。图10 沉默AP-1基因后SKOV3细胞Survivin 蛋白表达情况
3 讨论
卵巢癌是引起女性生殖系统恶性肿瘤死亡的最常见原因,其发病隐匿,侵袭力强,预后差。随着生物医学的发展,诱导肿瘤细胞凋亡是肿瘤防治的重要策略。如:miR-148b-3p可通过上调PTEN基因的表达而抑制前列腺癌PC-3细胞的增殖和迁移,延缓前列腺癌的进展[17]。米诺环素对人类胶质瘤U87和LN229细胞体外增殖及凋亡有明显抑制作用,并呈剂量依赖性[18]。目前利用基因调控来诱导肿瘤细胞凋亡是肿瘤防治的重要策略,而RANi技术是其中的热点之一。RANi技术是由小分子RNA(siRNA)介导的靶向沉默目的基因,能特异性、高效性地抑制目的基因表达,进而抑制肿瘤细胞生长,是靶向治疗临床肿瘤策略的新方向。同样,慢病毒载体具有感染性高、整合效率强、稳定性较瞬时转染率高等优势,是研究基因功能的主要手段之一[19]。本实验采用RNAi技术成功构建AP-1基因稳定沉默的慢病毒系统,具有RANi技术及慢病毒载体在基因功能研究中的双重特点。
AP-1是由含碱性亮氨酸拉链结构的Jun蛋白家族、Fos蛋白家族、ATF和JDP蛋白家族形成的高度保守的同源或异源二聚体[14],通过调节细胞增殖、分化、凋亡、转化和迁移等过程,参与肿瘤等多种疾病的发生,其在卵巢癌[20]、甲状腺癌[21]等多种恶性肿瘤中表达增加、活性增强,其存在大大加快了肿瘤发生发展的过程。Elliott等[22]研究表明,过表达Jun-D可显著促进细胞增殖,抑制其靶基因表达可能是阻止前列腺癌发生、进展的有效途径。AP-1通过增强新型神经营养因子MANF表达抑制肝癌细胞的增殖和迁移[23]。本实验首先通过筛选得到AP-1基因的3条siRNA序列,进而分别设计合成为3条shRNA,经过酶切及测序鉴定证明慢病毒系统构建成功。利用实时荧光定量PCR及Western blot筛选出对AP-1沉默效果最佳的慢病毒进行后续实验。经MTT检测SKOV3细胞增殖率发现,在同一时间点,对照组与空载体组细胞增殖率差异不明显,病毒组细胞增殖率明显受到抑制。流式细胞术检测细胞凋亡结果表明:对照组与空载体组细胞凋亡率差异不明显,病毒组细胞凋亡率高。结合细胞增殖及凋亡检测结果表明,沉默AP-1基因可使体外培养的卵巢癌SKOV3细胞增殖抑制、凋亡增加,这从细胞水平初步证实了AP-1参与了卵巢癌SKOV3细胞增殖、凋亡的调控。AP-1在各种癌细胞中表达水平高,早期检测有助于相关疾病的诊断、进展和复发的预测以及预后的评估[24],其活性的调控主要通过转录水平的调控、磷酸化的调控和相互结合蛋白质的调控3个方面来实现[25-26],阻断AP-1活性可以实现抗肿瘤作用,抑制AP-1的表达有望治疗某些相关疾病。因此,本实验为利用基因调控技术靶向治疗卵巢癌的设想及进一步相关研究奠定了初步基础。
Survivin是凋亡抑制蛋白家族中最强细胞凋亡抑制因子之一,是调控细胞增殖和凋亡的重要因素,在卵巢癌中高表达,表达水平随着卵巢癌临床分期和组织学分级升高而升高,干扰Survivin表达或功能,可抑制肿瘤细胞增殖、诱导细胞凋亡。本实验通过实时荧光定量PCR和 Western blot检测发现,沉默AP-1基因后卵巢癌SKOV3细胞Survivin mRNA及蛋白表达下调。
AP-1是一种顺序特异性转录激活因子,Survivin是一种凋亡抑制因子,目前关于AP-1和Survivin的关系不明确。从本实验结果可以看出,AP-1基因表达水平高,体外培养的卵巢癌SKOV3细胞Survivin表达水平高,其抗凋亡能力强;沉默AP-1基因后,体外培养的卵巢癌SKOV3细胞增殖被抑制、凋亡增加,相应细胞Survivin表达降低,这说明AP-1很可能参与了Survivin在卵巢癌组织中的表达,并且具有能够上调Survivin表达的重要作用,进一步实验研究可通过双荧光素酶报告基因检测系统及定点突变技术分析AP-1对Survivin基因启动子转录活性的影响。
