异鼠李素调控AKT-FOXO1通路改善胰岛素抵抗HepG2细胞糖代谢作用机制
2020-12-10包桥桥李梦茹陈金娇刘洪章刘树英
包桥桥,李梦茹,黄 榕,陈金娇,刘洪章,刘树英
(吉林农业大学生命科学学院,吉林长春 130118)
胰岛素抵抗是Ⅱ型糖尿病的主要特征之一,是导致高血压、冠心病的重要原因[1]。其症状主要表现为由胰岛素调控的促进脂肪细胞、肌肉细胞和肝细胞的糖代谢能力下降,机体代偿性地分泌过高浓度胰岛素来维持机体血液中葡萄糖含量稳态的现象[1-2]。作为胰岛素信号通路的重要组成部分,AKT-FOXO1信号通路对胰岛素抵抗起关键性作用[3]。通过调节AKT的磷酸化和FOXO1的核转移促进肝糖原合成,抑制肝糖原分解,从而改善胰岛素抵抗[4-5]。
异鼠李素是沙棘黄酮中的主要活性成分之一,也存在于多种植物当中[6-9]。已有研究表明,异鼠李素能够改善糖尿病及其并发症,具有降血糖[10-11]、调血脂[12]、改善胰岛素抵抗[13],是一种潜在的治疗糖尿病及其并发症的药物。但在对于异鼠李素在改善胰岛素抵抗作用机制方面的研究尚存在不足。Jiang等[14]通过研究证明异鼠李素可调节PI3K-AKT信号通路,然而目前能否通过AKT-FOXO1信号通路改善胰岛素抵抗并未证实。
本研究通过异鼠李素作用于高浓度胰岛素诱导制备人肝癌HepG2细胞胰岛素抵抗模型[15-16],检测细胞糖代谢水平变化,且从蛋白表达水平衡量异鼠李素调控AKT-FOXO1信号通路的作用效果,揭示异鼠李素改善胰岛素抵抗机制。
1 材料与方法
1.1 材料与仪器
异鼠李素(98%) 上海源叶生物科技有限公司;Hepg2细胞 中国科学院细胞库;PBS缓冲液、DMEM培养基 海克隆生物化学制品有限公司;DMEM无酚红培养基 吉林省吉诺生物工程有限公司;牛血清白蛋白、胰岛素、胰蛋白酶-EDTA溶液、MTT(噻唑蓝)、二甲基亚砜、青霉素-链霉素混合液 北京索莱宝科技有限公司;葡萄糖测试盒 南京建成生物工程研究所;蛋白预制胶、BCA蛋白定量试剂盒、全蛋白提取试剂盒、二甲双胍、特超敏ECL化学发光试剂盒 上海碧云天生物技术有限公司;胎牛血清 浙江天杭生物科技有限公司;细胞培养瓶、96孔板、6孔板 康宁生命科学有限公司;抗体 p-AKT(Ser473)、p-FOXO1(Ser256)、AKT、FOXO1、G6pase、PEPCK、β-actin 北京博奥森生物技术有限公司;彩虹Marker、10×TBS封闭洗涤缓冲溶液 上海生工生物工程技术服务有限公司;Tween-20、SDS电泳上样缓冲液 北京鼎国昌盛生物技术有限责任公司;Western转膜缓冲液 白鲨生物科技有限公司。
BPN-40RHP二氧化碳培养箱 上海一恒;D1Mi倒置显微镜 德国徕卡公司;CGF-300台式高速低温冷冻离心机 北宏科技;1703940半干转膜仪 美国伯乐;WD-9423B化学发光成像系统、DYCZ-24DN垂直电泳槽 北京六一;EPS-300稳压稳流电泳仪 上海天能;BIOBASE-EL10A酶标仪 上海博科;752N紫外分光光度计 上海精科。
1.2 实验方法
1.2.1 Hepg2细胞培养 采用含100 mL/L胎牛血清,100 U/L青霉素,100 mg/L链霉素的DMEM培养基,于37 ℃ 5% CO2培养箱中培养。待细胞生长至95%传代继续培养[17]。
1.2.2 四甲基偶氮唑盐微量酶反应比色(MTT)法试验 将对数生长期的细胞,于96孔板中以1×105个/孔铺板,于CO2培养箱中培养至细胞单层长满孔底,血清剥夺12 h后,设置空白对照组及药物处理组(处理浓度分别为:60、30、15、7.5、3.8、2、1、0.5 μg/mL),处理浓度每组设置6个复孔。将1 mg异鼠李素溶于10 μL 75%乙醇中,培养基稀释至终浓度为60 μg/mL,以二倍稀释法给药处理,设置最低浓度为0.5 μg/mL。12 h后每孔加入20 μL浓度为0.5%的MTT溶液孵育4 h,弃去孔内培养基,PBS清洗后每孔加入100 μL二甲基亚砜,摇床振荡10 min,设置转速为40 r/min,490 nm处测每孔吸光度值并计算细胞存活率[17],公式如下:

将未添加异鼠李素处理的组别设为正常组,设定细胞存活率为“100%”,绘图并分析结果。
1.2.3 胰岛素抵抗(IR)模型建立 将对数生长期的细胞,以悬液密度为2×105个/mL接种于六孔板中,CO2培养箱培养24 h后血清剥夺12 h,以胰岛素浓度为1×10-6mol/L药用培养基于CO2培养箱中继续处理36 h即为胰岛素抵抗模型。
1.2.4 葡萄糖代谢水平测试 将已建立好的胰岛素抵抗模型,以10 μmol/L二甲双胍为阳性对照,使用无酚红培养基配制不同剂量分组给药;根据MTT试验结果,共设置六组别,分别为:空白组(C)、模型组(B)、阳性对照(Met,1 mmol/L二甲双胍)、低剂量组(1 μg/mL)、中剂量组(2 μg/mL)、高剂量组(3.8 μg/mL),处理12 h后取培养基离心取上清,参照葡萄糖检测试剂盒说明书测定细胞葡萄糖消耗量。
1.2.5 Western Blot检测AKT-FOXO1信号通路相关蛋白表达情况 使用Western Blot方法检测AKT、FOXO1、p-AKT、p-FOXO1、G6pcse、PEPCK、β-actin共七种蛋白的表达情况。将胰岛素抵抗模型建立完成后的细胞,弃去培养基,PBS清洗三遍后,分别加入含有不同浓度(低剂量组:1 μg/mL;中剂量组:2 μg/mL;高剂量组:3.8 μg/mL)的异鼠李素的药用培养基,处理12 h。药物处理后细胞弃去上清,分别以预冷的PBS清洗三次,提取细胞总蛋白,BCA法测蛋白浓度备用。变性后取20 μg上样,10% SDS-PAGE电泳分离。转膜、封闭后分别加入抗体,4 ℃孵育过夜,TBST洗膜后,以相应二抗常温孵育。ECL 法显影,凝胶成像系统扫描蛋白条带浓度[18]。
1.3 数据处理
采用SPSS 13.0软件对试验结果进行组间单因素方差分析,P<0.05表示有统计学意义。
2 结果与分析
2.1 MTT试验检测异鼠李素对HepG2细胞生长影响
设置最高浓度为60 μg/mL,最低浓度为0.5 μg/mL,以2倍稀释法分组给药,以无血清培养基作为对照组,结果如图1所示。与正常组比较,当异鼠李素浓度在大于7.5 μg/mL 时,细胞存活率为小于80.7%,显著抑制HepG2细胞生长(P<0.05),当浓度在3.8~1 μg/mL时对HepG2细胞生长无危害,细胞存活率在0.943与1.093之间,当异鼠李素浓度为1 μg/mL时,可有效促进细胞生长;当浓度继续减小时,HepG2细胞存活率显著降低(P<0.05)。当异鼠李素浓度减小至0.5 μg/mL时,细胞存活率为:79%。因此选定异鼠李素浓度在3.8~1 μg/mL时为安全用药剂量。故选取3.8、2、1 μg/mL分别为高、中、低剂量组。
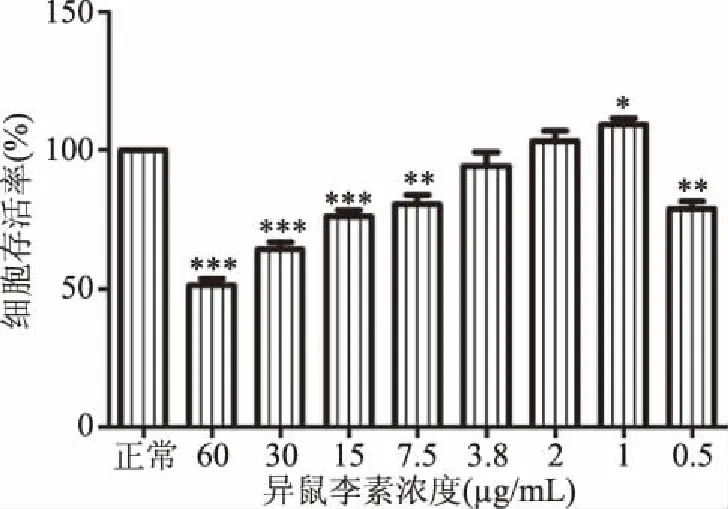
图1 异鼠李素对Hepg2细胞活力的影响
2.2 异鼠李素对IR HepG2细胞葡萄糖消耗量的影响
如图2所示,表明空白组葡萄糖消耗量为4.473 mg/mL,与之比较模型组葡萄糖消耗量明显减少,其数值为1.7 mg/mL,存在极显著性差异(P<0.001),因此胰岛素模型造模成功;与模型组比较,阳性对照组及试验组葡萄糖消耗量均显著增加(P<0.05),阳性对照组葡萄糖消耗量为4 mg/mL。试验组的细胞葡萄糖消耗量随剂量升高而降低,其中高剂量组葡萄糖消耗量为2.6 mg/mL;低剂量组葡萄糖消耗量达4.3 mg/mL,与空白组和阳性对照组葡萄糖消耗量相当。

图2 异鼠李素对 IR HepG2细胞葡萄糖消耗影响
2.3 异鼠李素对IR HepG2细胞Akt和FOXO1蛋白磷酸化影响
如图3A、3B所示,各剂量组AKT蛋白的表达水平与FOXO1蛋白表达水平趋于一致,表明实验结果具有可靠性,并且该组试验分别以AKT蛋白表达和FOXO1蛋白表达作为内参。如图3C、3D所示,分别将AKT蛋白与FOXO1蛋白作为内参蛋白,衡量两蛋白磷酸化水平变化,即p-AKT蛋白与p-FOXO1蛋白相对于AKT蛋白与FOXO1蛋白表达量的变化:与空白组比较,模型组p-AKT(Ser473)、p-FOXO1(Ser256)蛋白表达明显降低且存在极显著性差异(P<0.001),因此胰岛素抵抗模型造模成功;相较于模型组,实验组p-AKT(Ser473)和p-FOXO1(Ser256)蛋白表达均明显增加,且随剂量升高而下降。p-AKT的蛋白表达,低剂量组与模型组存在极显著性差异(P<0.001)高剂量组的蛋白水平与模型组并无显著性差异(P>0.05);P-FOXO1三个剂量组均与模型组皆有显著差异(P<0.05),且低剂量组p-FOXO1的蛋白表达量与阳性对照组相当。
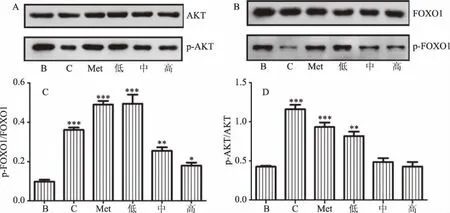
图3 异鼠李素对IR Hepg2细胞AKT和FOXO1蛋白磷酸化水平影响
2.4 异鼠李素对IR HepG2细胞G6pase和PEPCK蛋白表达水平影响
如图4A所示,选取β-actin作为内参蛋白,且在该组试验中,内参表达水平趋于一致,说明试验具有可靠性。故以PEPCK蛋白和G6pase蛋白相对于内参基因的表达量作为衡量蛋白表达水平的标准,如图4B和4C所示。如图所示,与空白组比较,模型组PEPCK、G6pase、蛋白表达明显升高且存在极显著性差异(P<0.001)。G6pase与PEPCK的蛋白表达量均随剂量升高而升高,阳性对照与低剂量组较模型组相比均具有显著差异(P<0.01)且G6pase低剂量组蛋白表达量与阳性对照组相当。
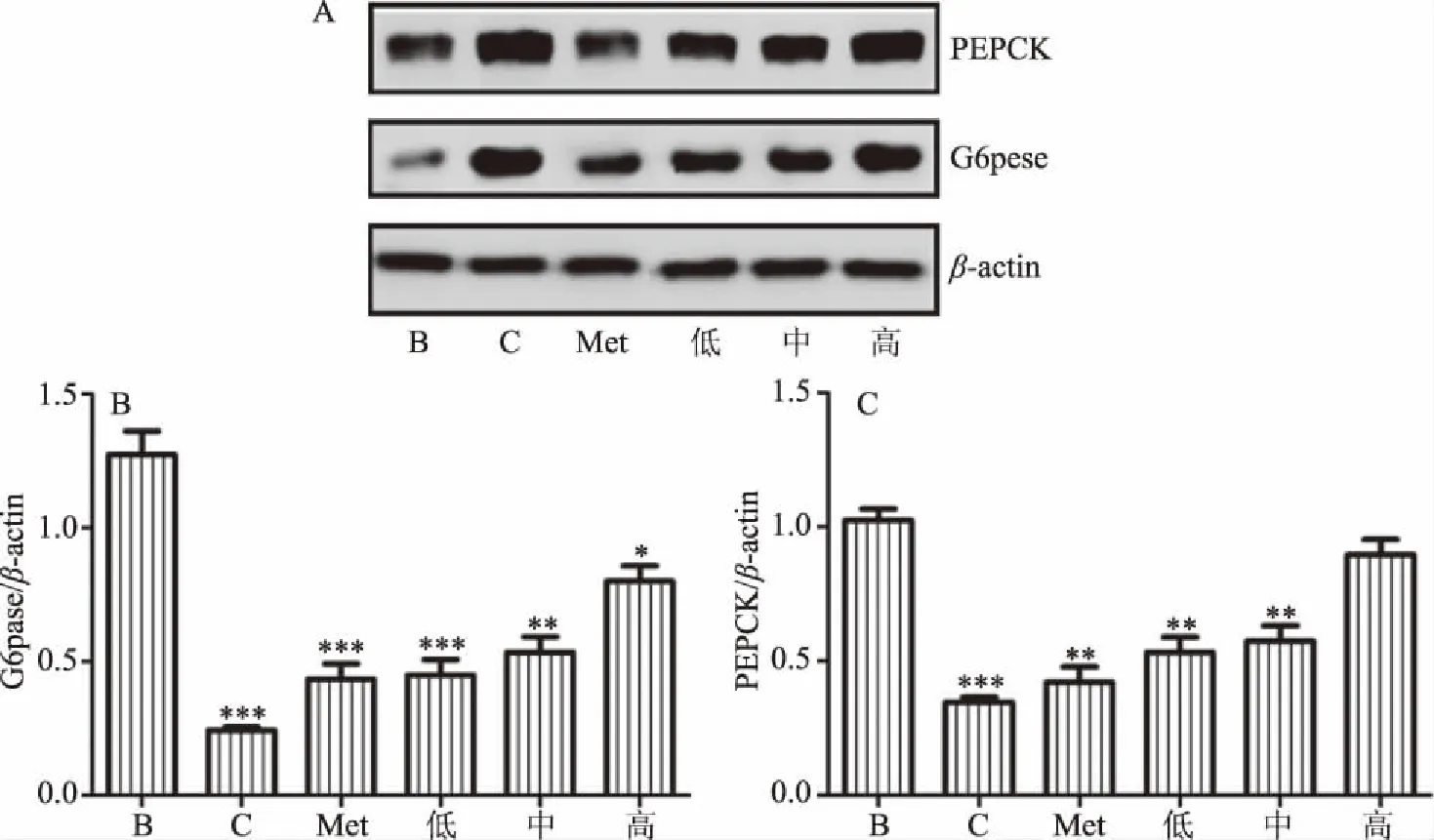
图4 异鼠李素对IR Hepg2细胞G6pcse和PEPCK蛋白表达的影响
3 结论
胰岛素抵抗是指由各种原因,如高血压、肥胖等引起的胰岛素敏感性下降,是治疗Ⅱ型糖尿病的关键途径之一。肝脏在糖代谢过程中发挥着重要作用,胰岛素通过下调肝脏肝糖原合成与分解、糖异生等过程调节机体的糖代谢过程,因此胰岛素抵抗严重影响肝糖代谢[19]。
科研人员在对胰岛素抵抗治疗研究当中,将大量目光集中于天然产物的应用上,其中黄酮类化合物在胰岛素抵抗治疗方面具有显著疗效。异鼠李素是广泛存在于自然界中的一种黄酮类化合物,具有调节糖代谢,治疗糖尿病等作用[20]。
AKT/FOXO1信号通路处于胰岛素信号通路下游,是调节糖原合成并维持葡萄糖稳态的重要途径。FOXO1蛋白是细胞核内的转录因子,主要调控G6pase和PEPCK蛋白的转录,从而促进细胞的糖原分解。通过AKT蛋白在Ser473位点磷酸化,激活AKT蛋白。磷酸化的AKT蛋白促进FOXO1蛋白磷酸化并向细胞核外转移,抑制G6pase和PEPCK蛋白的转录,从而抑制糖原分解。当细胞受高浓度胰岛素作用产生胰岛素抵抗后,细胞糖代谢紊乱,糖原合成机能受损。因此,通过激活AKT/FOXO1信号通路可改善细胞胰岛素抵抗现象,维持细胞葡萄糖稳态。
本试验通过将异鼠李素作用于高浓度胰岛素诱导的胰岛素抵抗的Hepg2细胞模型[21-23],以二甲双胍为阳性对照,评估异鼠李素改善Hepg2细胞胰岛素抵抗作用,并通过检测AKT/FOXO1信号通路相关指标,研究其作用机制[24-25]。由试验结果表明,异鼠李素具有改善胰岛素抵抗细胞葡萄糖消耗量的作用。且给予异鼠李素刺激后,胰岛素抵抗细胞的p-AKT(Ser473)、p-FOXO1(Ser256)蛋白表达显著增加,PEPCK、G6pase的蛋白表达量显著减小,明显改善细胞胰岛素抵抗,推测其可能是通过促进ATK蛋白磷酸化从而增加FOXO1蛋白磷酸化,减少PEPCK和G6pase的蛋白表达水平以发挥降低血糖,改善胰岛素抵抗作用从而缓解2型糖尿病症状。Jiang等[14]通过试验研究证明,异鼠李素可通过激活IRS/PI3K/AKT信号通路促进L6肌管的葡萄糖摄取,维持细胞糖代谢稳态;Jia等[15]发现异鼠李素可调节胰岛素敏感性抑制胰高血糖作用,与本研究成果相符。值得关注的是,本试验结果中在安全用药范围内,虽然各剂量组皆可有效调节细胞糖代谢,但异鼠李素的药理活性呈剂量依赖性降低,即低剂量组葡萄糖代谢水平及蛋白水平优于高剂量组。对照MTT试验结果,根据药物的量效关系可得[26]:因异鼠李素药理活性强,微量差异即可对细胞活力产生较大影响。在选用的三组剂量中,给药剂量为1 μg/mL时细胞活力最强,其葡萄糖代谢水平与二甲双胍相当,而高剂量组虽对细胞没有显著性伤害,但细胞活力却较低,影响了细胞的代谢水平,因此低剂量组细胞的葡萄糖代谢水平高于高剂量组葡萄糖代谢水平。
综上所述,异鼠李素可通过调节AKT/FOXO1信号通路改善高浓度胰岛素诱导的HepG2细胞胰岛素抵抗。
