基于离子交换色谱法检测结核治疗性DNA疫苗纯度的方法建立
2020-12-09孔雯雯周飞燕符美娟杨丽菲梁艳吴雪琼倪世明黄明
孔雯雯,周飞燕,符美娟,杨丽菲,梁艳,吴雪琼,倪世明,黄明
(1.广州白云山拜迪生物医药有限公司,广东 广州 511495;2.中国人民解放军总医院第八医学中心结核病重点实验室,北京 100091)
结核病是由结核分枝杆菌引起的呼吸道传染病,属于重大传染病之一[1-2]。临床上应用最为广泛的结核疫苗为卡介苗(Bacillus Calmette-Guérin,BCG),其对新生儿及儿童结核性脑膜炎和粟粒性肺结核具有有效预防效果,但对成人结核病和结核分枝杆菌潜伏感染保护效果有限[3-9]。目前已有多种结核候选疫苗处于临床研究阶段,主要包括用于增强BCG免疫效力的蛋白亚单位疫苗、病毒载体疫苗和治疗性DNA疫苗,及代替BCG的重组BCG等[10-18]。结核治疗性DNA疫苗是采用基因重组技术构建,通过细菌发酵、裂解和纯化后制备的质粒DNA,为确保质粒的质量,质粒DNA疫苗的指导原则要求对DNA的纯度进行质量控制[19]。目前对DNA纯度的检测方法主要有琼脂糖凝胶电泳和高效液相色谱法[20-22]。琼脂糖凝胶电泳法操作简便但分辨率较低,高效液相色谱法可以更准确地检测DNA纯度。为了对生产制备的结核治疗性DNA疫苗进行有效质量控制,本文拟采用高效液相色谱法检测重组质粒DNA制剂的纯度。该法是通过阴离子交换色谱法对质粒DNA进行分离并在特定波长进行测定,采用面积归一化法计算目的质粒峰的百分比,从而建立结核治疗性DNA疫苗的纯度的检验方法,并对该方法进行验证,为结核治疗性DNA疫苗质量控制和质量标准的建立提供参考。
1 材料与方法
1.1 主要试剂与仪器 三羟甲基氨基甲烷(Tris Base,色谱纯)购自美国Merck公司;氯化钠(分析纯)和盐酸(分析纯)均购自广州化学试剂厂;氯化钠(药用级)购自河北华晨药业有限公司;磷酸氢二钠(药用级)、磷酸二氢钠(药用级)购自湖南九典制药有限公司;结核DNA疫苗成品(20170301、20170302、20170303)为广州白云山拜迪生物医药有限公司制备的样品;Agilent 1100 高效液相色谱仪(配有 G1315B DAD 检测器、 G1311A 四元梯度泵、G1322A在线脱气装置、G1316A柱温箱)和化学工作站(ChemStation,版本号:Rev.A.10.01[1635])均购自美国安捷伦科技有限公司;Agilent 1260 高效液相色谱仪(配有G7117C DAD 检测器、 G7111A 四元梯度泵、G7129A 自动进样器、G7116A 柱温箱)和化学工作站(Openlab 2.1chemstation)均购自美国安捷伦科技有限公司;BS124S 型电子天平购自德国赛多利斯科学仪器有限公司;色谱柱 TSK-gel DNA-NPR(4.6 mm×75 mm,2.5 μm)购自日本Tosoh公司。
1.2 供试品溶液及PBS对照液的配制 用流动相A将20170301批、20170302批和20170303 批结核ag85ab DNA 疫苗成品分别稀释成 0.10 mg·mL-1的溶液,10 000 r·min-1离心后吸取上清,作为供试品 1、供试品 2和供试品 3备用。称取氯化钠 9.00 g,磷酸氢二钠 1.93 g,磷酸二氢钠 0.44 g,用灭菌注射用水溶解并定容至 1 L,即得到 PBS 对照液。用 PBS 对照液将 20170301 批成品稀释成 0.10 mg·mL-1的溶液,10 000 r·min-1离心后吸取上清,作为供试品 4 备用。
1.3 色谱条件 色谱柱 TSK-gel DNA-NPR (4.6 mm×75 mm,2.5 μm);流动相:20 mmol·L-1三羟甲基氨基甲烷(用盐酸调节 pH至9±0.2)为流动相 A,20 mmol·L-1三羟甲基氨基甲烷-1 mol·L-1NaCl (用盐酸调节pH至9±0.2) 为流动相 B;柱温:25 ℃;流速:0.5 mL·min-1;进样量:10 μL;检测波长:260 nm;梯度洗脱程序见表1。
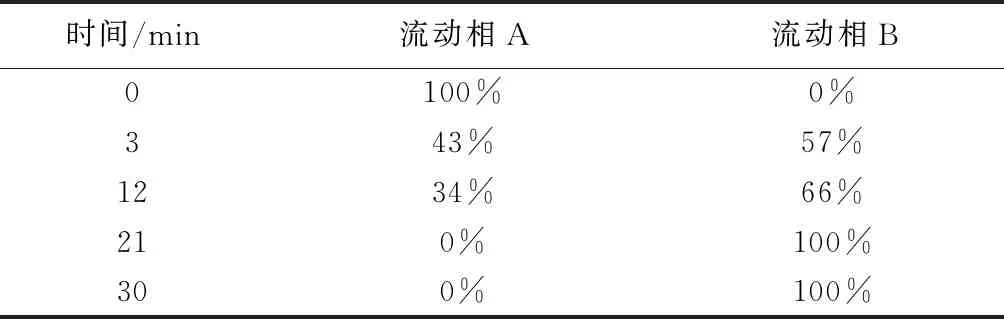
表1 梯度洗脱程序
1.4 方法的验证
1.4.1 专属性 取供试品1、供试品4和PBS对照样品分别按“1.3”项下色谱条件上样检测,比对色谱图,观察在供试品1主峰出峰位置,供试品4及PBS对照液是否有干扰。
1.4.2 线性 将供试品1用PBS溶液稀释成0.05、0.10、0.15、0.20和0.25 mg·mL-1,按“1.3”项下色谱条件进样,每个浓度分别进样6次。计算供试品的主峰面积,以进样量为横坐标,峰面积为纵坐标进行线性拟合,计算相关系数。
1.4.3 精密度 重复性:取供试品按照“1.3”项下色谱条件进样6次,测定主峰面积,计算主峰面积的相对标准偏差(RSD)。
中间精密度:测定不同检测时间的精密度变化,按“1.3”项下色谱条件进样方法在3个工作日制备供试品1,按照“1.3”项下色谱条件分别进样2次,计算主峰面积的RSD。
测定不同实验员间的精密度变化,2个实验员分别制备3份供试品1,依“1.3”项下方法进行测定,每个供试品分别测定2次,计算主峰面积的RSD。
测定不同检测设备间的精密度变化,取供试品1,采用“1.3”项下的方法分别在高效液相色谱仪Agilent 1100 和Agilent 1260 进样2次,计算不同高效液相色谱仪上供试品主峰面积的RSD。
1.4.4 耐用性 检测波长耐用性:将“1.3”项下色谱条件的波长条件改为258、260和262 nm,取供试品1分别进样2次,测定主峰面积;柱温耐用性:将“1.3”项下色谱条件的温度条件改为23、25和27 ℃,取供试品1分别进样 2 次,测定主峰面积;流速耐用性:将 “1.3”项下色谱条件的流速改为0.4、0.5和0.6 mL·min-1,取供试品1分别进样2次,测定主峰面积;流动相比例耐用性:将“1.3”项下梯度洗脱条件12 min的流动相B 设定值改为64%、66%和68%,取供试品1分别进样2次,测定主峰面积。
1.4.5 稳定性 将新配制的供试品1跟放置24 h后的供试品1分别按“1.3”项下色谱条件进行进样2次,采用面积归一化法计算供试品溶液主峰的面积百分比,比较0 h和放置24 h后的供试品溶液主峰纯度的变化。
1.4.6 检测限 取供试品1用流动相A逐级稀释浓度至 0.01、0.005、0.001 mg·mL-1和0.000 5 mg·mL-1,按浓度由低到高分别进样3次,分别计算每个浓度的信噪比,如还未达到3∶1,根据检测浓度进一步稀释。
1.5 含量的测定 取供试品1、供试品2和供试品3按“1.3”项下色谱条件进样2次,采用面积归一化法计算供试品的主峰面积百分比及RSD。
2 方法与结果
2.1 专属性研究 从检测结果可知,PBS对照液除溶剂峰外其他位置未出峰,用流动相A和 PBS配制的供试品主峰保留时间和峰高一致。结果表明辅料磷酸氢二钠、磷酸二氢钠和氯化钠对结核质粒DNA纯度的检测无明显干扰,专属性验证符合要求,结果见图1。
2.2 线性 结核质粒DNA浓度在0.5~2.5 μg的范围内,线性拟合系数R2为0.999 8,表明进样量与峰面积的线性关系良好。
2.3 重复性 供试品连续进样6次的主峰面积RSD为0.30%,表明该法精密度良好。 中间精密度:3个工作日测得结核质粒DNA主峰面积的RSD为0.40%,结果显示该法不同检测时间的中间精密度良好。2名实验员制备供试品测定的主峰面积RSD为0.51%,不同人员间中间精密度良好。2台检测设备测得供试品主峰面积RSD为0.23%,表明不同设备间中间精密度良好。
2.4 耐用性 为考察色谱条件的变化对结果的影响,将柱温、波长、流速和流动相的比例分别设置为不同参数,结果显示不同设置下,供试品纯度的RSD均<2.0%,表明该法的耐用性较好,详见表 2。
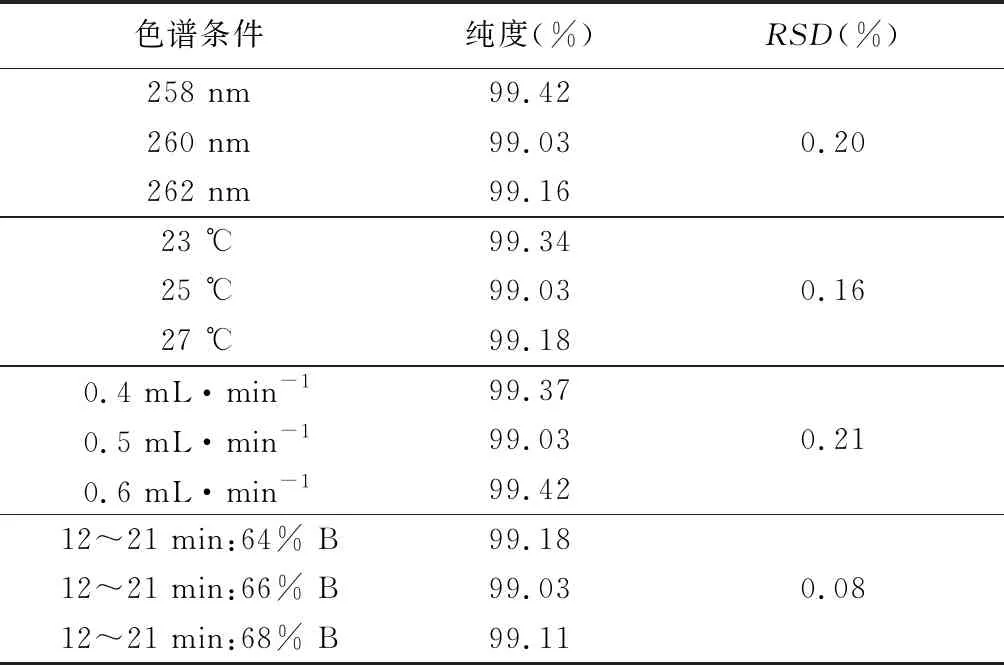
表2 耐用性研究结果
2.5 稳定性 供试品1在0 h时测定的纯度平均值为99.44%,在室温放置24 h后测定的纯度平均值为99.20%,不同放置时间纯度的RSD为0.14%,结果显示供试品溶液在24 h内稳定性良好。
2.6 检测限 0.001 mg·mL-1的供试品测定的信噪比(S/N)为3,因此推测 0.001 mg·mL-1时为该方法的检测限。
2.7 3批结核ag85ab DNA疫苗样品的纯度检测结果均大于95%,见表 3。
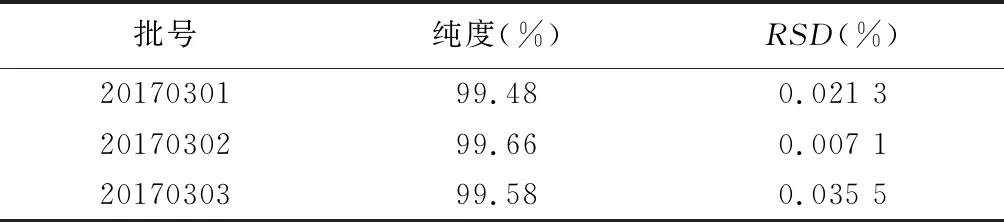
表3 3批结核ag85ab DNA疫苗样品的纯度测定结果
3 结论
结核治疗性DNA疫苗发挥治疗作用的主要成分为质粒DNA,在产品的终产物中,宿主菌的基因组DNA、RNA、蛋白质、内毒素和非超螺旋质粒等杂质均不利于质粒DNA在真核细胞的基因转染,进而影响药效作用[23]。因此结核DNA疫苗的纯度对终产品是否安全有效起到了重要作用。采用高效液相色谱法分析质粒DNA的纯度主要有分子排阻色谱法和离子交换色谱法,分子排阻法对开环、线性和超螺旋3种构型的质粒DNA无法达到较好地分离,而离子交换色谱柱是根据组分离子对树脂亲合力不同而得到分离,对不同构型的 DNA也具有一定的分离效果。因此本试验选用离子交换色谱法对结核治疗性DNA疫苗进行纯度的分析,并对该方法的专属性、线性、重复性和稳定性等进行验证。结果表明,该方法用于检测结核治疗性DNA疫苗中质粒DNA的专属性良好,辅料组分未对目的峰造成干扰,精密度和耐用性测试结果均良好,样品在24 h内也较稳定,验证表明本试验建立的结核DNA疫苗纯度的检测方法准确、可靠,能为新型结核DNA疫苗的质量控制提供一定依据。
