超声辅助酸解-超高效液相色谱-电雾式检测器测定灵芝多糖的单糖组成
2020-12-09赵志国张敏敏耿岩玲赵恒强
梁 琰,赵志国,张敏敏,刘 倩,耿岩玲,王 晓,赵恒强*
(1.齐鲁工业大学(山东省科学院)山东省分析测试中心山东省中药质量控制技术重点实验室,山东济南 250014;2.山东农业大学食品科学与工程学院,山东泰安 271018;3.山东迪沙药业,山东威海 264209)
灵芝多糖(Ganodermalucidumpolysaccharides)是灵芝菌丝的次生代谢产物,是灵芝的主要功效成分,具有降血脂、降血糖、抗氧化、清除自由基、抗衰老、抗肿瘤、提高免疫力等作用[1-3]。多糖是由单糖通过糖苷键结合而成,准确测定多糖的单糖组成以及各单糖的含量,对于多糖的质量控制具有重要意义[4-5]。
水解是测定多糖组成的关键步骤,不同糖苷键对水解的敏感性不同,解聚单糖的难易程度也不同,多糖的水解效率将会直接影响其单糖组成测定的准确性。近年来,研究者们对多糖的降解方法进行了大量研究,主要包括酸水解、碱水解、酶解以及电磁辐射等[6]。其中,酸水解法反应速率快,水解产物发生结构变化的机率较小,所以在多糖的单糖组成分析中应用较广[7]。但同时也发现,传统的高温酸水解方式用于多糖的水解,时间长、能耗大、效率较低[8-9]。超声提取技术是利用超声波产生的强烈的空化效应和机械振动加速药物有效成分进入溶剂,促进提取的进行,增加有效成分的溶出率,提高药材的利用率,节约能源并且避免了高温对提取成分的影响,具有省时、节能、提取率高等优点,已经广泛的应用于天然产物中有效成分的提取[10-12],但在多糖水解方面的应用鲜有报道。
关于单糖组成及含量的测定方法主要有高效液相色谱法(HPLC)、气相色谱法(GC)、离子色谱-脉冲安培检测法(HPAEC-PAD)等[13]。因糖类物质没有紫外吸收,HPLC检测糖时,需将样品水解后进行衍生化处理,此过程比较繁琐,且PMP修饰的单糖不稳定,特别是在低浓度时,易使最终测定的结果缺乏可靠性[14]。GC法具有灵敏度高的优点,但很难将多种单糖一次性分开,分离度有局限性,且GC出峰的重现性很差,需要添加内标物来对单糖进行含量的定量分析,这无疑增加了操作的繁琐程度[15]。HPAEC-PAD法则使用高pH、高浓度的非挥发性钠盐,对仪器系统要求较高,并且不能直接与质谱联用[16]。单糖分析常用的检测器主要有紫外检测器(UV)、示差折光率检测器(RID)、质谱(MS)等。采用UV检测器分析时,需先对其进行衍生化操作,步骤较为繁琐。RID则灵敏度较低,无法进行梯度洗脱,受外界温度等因素影响较大,系统平衡时间长,特别是对复杂样品分析效果较差[17]。MS技术具备高特异性和高灵敏度的优势,可以详细解析化合物的结构特征,但仪器结构复杂,价格昂贵,使用受到一定的限制[18]。因此,发展简单、快速、灵敏的单糖组成分析方法,具有重要意义。
超高效液相色谱技术(Ultra Performance Liquid Chromatography,UPLC)是近年来推出的一种采用亚2微米填料色谱柱的超高效液相色谱系统,具有高分离度、高效率、节省溶剂等优势[19]。而电喷雾式检测器(CAD)是近年来在市场上被逐步推广的一款高灵敏度、通用型检测器,其检测信号不依赖于被检测物质的化学结构,对不同结构的化合物有一致的响应[20],可以避免复杂的衍生化过程。另外,与蒸发光散射检测器(Evaporative Light Scattering Detector,ELSD)和RID相比灵敏度较高,可以耐受梯度洗脱溶剂。目前,该技术已逐渐用于糖类、脂质类、固醇类和皂苷类等样品的检测[21-23]。
本研究建立了超声辅助酸解(UAH)-UPLC-CAD法测定灵芝多糖单糖组成的方法,并对6批赤芝多糖的单糖组成和含量进行测定,以期为药食两用真菌多糖的单糖组成研究提供方法和数据参考。
1 材料与方法
1.1 材料与仪器
对照品:D-阿拉伯糖(LOT:AJ0702FA14)、L-鼠李糖(LOT:SJ0715GA13)、D-(+)-葡萄糖(LOT:S08J6G1)、D-半乳糖(LOT:AJ0603LA14)、D-(+)-木糖(LOT:B02M6W1)、L-(+)-岩藻糖(LOT:TM0312QB14)、D-甘露糖(LOT:A16O6L4546) 购于上海源叶生物科技有限公司(纯度均大于98%);乙腈 瑞典Oceanpak,色谱纯;95%乙醇 山东禹王实业有限公司化工分公司,分析纯;氢氟酸 上海阿拉丁生化科技股份有限公司,色谱纯;甲酸铵、浓盐酸、三氟乙酸 天津市科密欧化学试剂有限公司,分析纯;其余试剂 均为分析纯;实验用水 娃哈哈纯净水;干燥的赤芝子实体 购于济南市药王楼,产地来源为安徽,由山东省分析测试中心王晓研究员鉴定为赤芝(Ganodermalucidum)。
色谱柱:Waters Xbridge HILIC(2.1 mm×150 mm,2.5 μm)、Waters ACQUITY UPLC Amide柱(3.0 mm×100 mm,1.7 μm)、MERCK ZIC-HILIC(2.1 mm×150 mm,2.5 μm);SBL-10DT型恒温超声波清洗机 宁波新芝生物科技股份有限公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器开发有限公司;万分之一电子分析天平 德国Sartourius;赛默飞Ultimate 3000高效液相色谱仪 美国,Thermo Fisher。
1.2 实验方法
1.2.1 多糖的提取 将赤芝置于真空干燥箱中(60 ℃)烘干,切片,粉碎,过40目筛。精密称取2.0 g干燥的样品粉末置于三角瓶中,加入30.0 mL去离子水,于超声提取器中提取30 min(90 ℃热水),后冷却15 min,将提取液离心(5000 r/min,10 min),抽滤,用水定容至30.0 mL,采用Sevage法除蛋白,直至无蛋白析出。向其中加入4倍体积的95%乙醇,置于4 ℃冰箱中用于沉淀粗多糖(12 h),离心(5000 r/min,15 min),沉淀依次经95%乙醇、无水乙醇、丙酮、乙醚多次洗涤,后置于水浴锅中干燥,并用5.0 mL热水(80 ℃)复溶,再次离心(5000 r/min,15 min),取上清液,用水定容至5.0 mL,备用[24-25]。
1.2.2 多糖的完全水解 吸取700 μL的多糖溶液于水解管中,加入700 μL的三氟乙酸(4.0 mol·L-1)溶液,密封后置于恒温超声波清洗机(70 ℃,功率270 W)中,酸解1 h。产物用氮气吹干并用甲醇洗涤,以除去TFA残留[26]。
1.2.3 对照品溶液的配制
1.2.3.1 单个对照品溶液的配制 分别精密称取阿拉伯糖、甘露糖、木糖、鼠李糖、葡萄糖、岩藻糖和半乳糖对照品各1.0 mg,各置于1 mL容量瓶中,配制成质量浓度均为1.0 mg·mL-1的单个对照品溶液,备用。
1.2.3.2 混合对照品溶液的配制 分别精密称取阿拉伯糖、甘露糖、木糖、鼠李糖、葡萄糖、岩藻糖和半乳糖对照品各1.0 mg,置于1 mL容量瓶中,配制成质量浓度为1.0 mg·mL-1的混合对照品溶液,备用。
1.2.4 样品溶液的配制 取吹干的样品用乙腈-水(v∶v=3∶1)溶液定容至1.0 mL,用0.22 μm微孔滤膜过滤后,作为样品溶液,备用。
1.2.5 检测色谱条件 流动相A为0.8%甲酸水溶液,B为乙腈,色谱柱:Waters ACQUITY UPLC Amide柱(3.0 mm×100 mm,1.7 μm)。梯度洗脱程序:0~6 min,85% B;6~8 min,85% B~72% B;8~12 min,72% B;12~15 min,72% B~50% B。进样量:10 μL;流速:0.4 mL·min-1;柱温:25 ℃。CAD检测参数:雾化器温度35 ℃,气体源为N2,压力61.2 Psi,Filter 5.0 sec。
1.3 数据处理
实验数据分别采用Excel 2010和Origin 7.5软件进行处理和绘图分析。
2 结果与分析
2.1 多糖酸解条件的优化
2.1.1 酸种类的影响 盐酸(HCl)、氢氟酸(HF)和三氟乙酸(TFA)是常用于多糖水解的酸,其中,TFA因其易于除去的优点而被广泛采用[27]。从图1(A)可以看出,当采用盐酸和氢氟酸用于灵芝多糖水解时,均有部分单糖未检出。而在三氟乙酸的酸解作用下,产物中7种单糖均可被检出。因此,本实验选TFA用于灵芝多糖的水解。
2.1.2 酸浓度的影响 如图1(B)所示,随着TFA浓度的增加各特征峰的峰面积呈现先升高后下降的趋势,当浓度为4 mol·L-1时,水解程度达到最大,这可能是由于酸浓度过高时,单糖则易转化成糠醛及其衍生物,而浓度低时,水解程度则较低,大部分以多糖的形式存在。因此,选定TFA的浓度为4 mol·L-1。
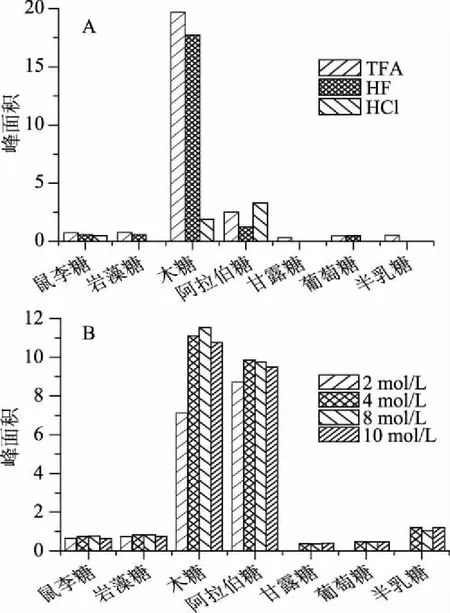
图1 酸种类(A)及浓度(B)对水解程度的影响
2.1.3 超声功率的影响 如图2(A)所示,超声功率在150~270 W范围内,多糖水解程度随着超声功率的提高而快速增加。当功率超过270 W后,水解程度则呈现降低趋势。考虑到本研究采用的超声系统具有控温功能,功率优化过程中系统温度严格控制在60 ℃。结合相关参考文献[28-29],初步推测可能是因为较高的超声功率会产生较强的空化和剪切效应,使得单糖发生转化或分解,降低了单糖的含量。所以,最终选择多糖的超声功率为270 W。

图2 超声功率(A)、温度(B)和时间(C)对水解程度的影响
2.1.4 水解温度的影响 如图2(B)所示,水解程度随着温度的变化而发生明显改变,在30 ℃和50 ℃时,温度过低,水解程度偏低;当温度升高到70 ℃时,水解程度大幅度提高,各特征峰的峰面积均出现明显增加;当温度继续升高时,部分单糖发生转化,导致峰面积降低。因此,选择70 ℃作为灵芝多糖的水解温度。
2.1.5 水解时间的影响 如图2(C)所示,水解时间为0.5 h时,多糖水解不够充分,产物大部分以多糖形式存在,单糖含量较低;当水解时间增加到1 h时,寡糖和多糖开始水解,单糖含量明显增加;但当水解时间继续增加时,单糖含量整体则没有明显变化。因此,选择灵芝多糖的水解时间为1 h。
2.2 色谱条件优化
为了获得最佳的色谱分离效果和较短的分离时间,对色谱柱类型、流动相组成、柱温等色谱条件进行了考察。
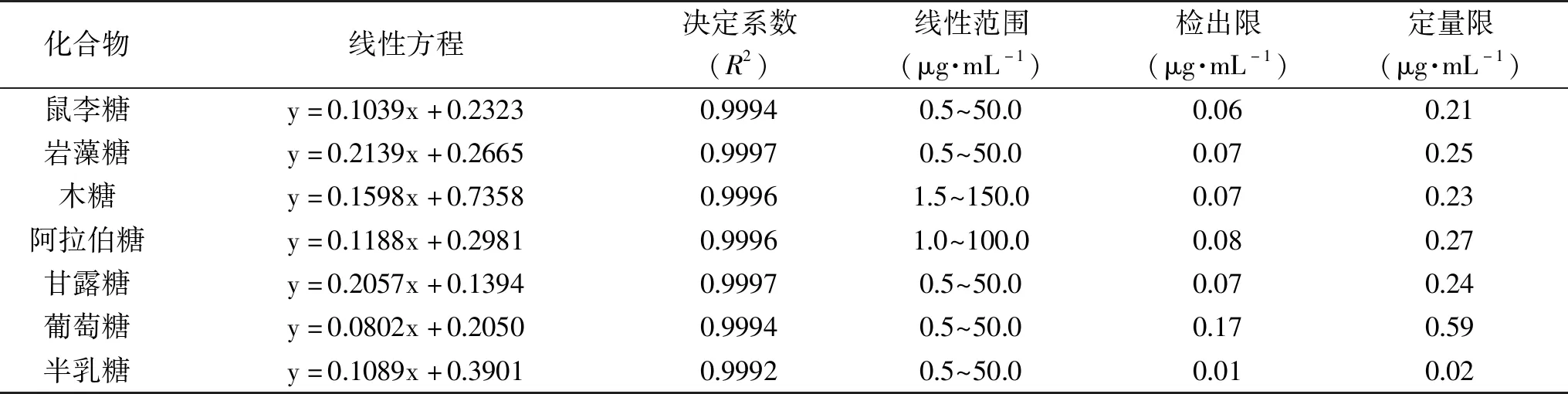
表1 线性关系考察
在相同的流动相和梯度条件下,考察了Waters XBridge HILIC(2.1 mm×150 mm,2.5 μm)、Waters ACQUITY UPLC Amide柱(3.0 mm×100 mm,1.7 μm)、MERCK ZIC-HILIC(2.1 mm×150 mm,2.5 μm)三种色谱柱,最终选择Waters ACQUITY UPLC Amide柱(3.0 mm×100 mm,1.7 μm)柱作为多糖单糖组成的分析柱。根据7种单糖的保留时间和分离效果,确定乙腈-水(0.8%甲酸)的溶剂体系。糖类为多羟基物质,升高色谱柱温度可以明显改善单糖的峰型,但温度过高又会使得糖类物质发生改性[30],因此选择柱温为25 ℃。在优化的色谱条件下,将每种单糖标准品单个进样分析,和样品图进行比对,根据各单糖对照品和样品的保留时间对各色谱峰进行定性分析。混合对照品及样品的UPLC-CAD色谱图见图3。
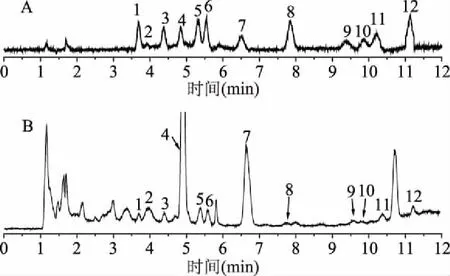
图3 混合对照品(A)和样品(B)的UPLC-CAD色谱图
2.3 方法学考察
2.3.1 线性范围考察 分别吸取“1.2.3.1”中配好的7种标准品溶液(葡萄糖、岩藻糖、鼠李糖、甘露糖和半乳糖各10.0 μL,阿拉伯糖20.0 μL,木糖30.0 μL)至容量瓶中,充分混匀后稀释至不同浓度,按“1.2.5”项下色谱条件进样分析。以各对照品质量浓度的对数为横坐标(X),以峰面积的对数为纵坐标(Y),绘制标准曲线,结果见表1。由表1可知,7个单糖标准曲线的相关系数均大于0.999,说明其线性关系良好。各单糖标准曲线的线性范围均在两个数量级之间,线性范围较宽。检出限在0.01~0.17 μg·mL-1之间,说明方法的灵敏度均较高。
2.3.2 仪器精密度试验 取同一供试品溶液,按“1.2.5”项下色谱条件连续进样6次,测得7个单糖峰的保留时间RSD分别为0.58%(0.27%)(根据峰1,2的保留时间分别计算,下同)、0.55%(0.55%)、0.80%(0.51%)、0.74%、0.30%、0.62%(0.85%)、0.48%(0.21%),均小于1%;峰面积RSD分别为2.93%(1.31%)(根据峰1,2的峰面积分别计算,下同)、2.62%(1.02%)、1.96%(0.59%)、4.28%、1.29%、2.99%(2.30%)、1.15%(2.21%),均小于5%。结果表明仪器精密度良好。
2.3.3 日间精密度试验 每日取同一批次粗多糖样品按“1.2.4”项下方法制成供试品溶液,按“1.2.5”项下色谱条件进样2次,连续测定3 d,测得7个单糖峰的保留时间RSD分别为0.85%(0.35%)(根据峰1,2的保留时间分别计算,下同)、0.65%(0.31%)、0.08%(0.32%)、0.13%、0.35%、0.46%(0.54%)、0.47%(0.17%),均小于1%;峰面积RSD分别为1.00%(0.08%)(根据峰1,2的峰面积分别计算,下同)、1.05%(0.82%)、0.97%(0.69%)、0.35%、0.94%、1.11%(0.16%)、0.95%(1.64%),均小于5%。结果表明日间精密度良好。
2.3.4 重复性试验 取同一批次粗多糖样品,按“1.2.4”项下方法制成6份供试品溶液,按“1.2.5”项下色谱条件进行测定,测得7个单糖峰的保留时间RSD分别为0.60%(0.22%)(根据峰1,2的保留时间分别计算,下同)、0.40%(0.50%)、0.23%(0.16%)、0.15%、0.39%、0.25%(0.46%)、0.23%(0.14%),均小于1%;峰面积RSD分别为3.53%(2.90%)(根据峰1,2的峰面积分别计算,下同)、1.95%(1.56%)、1.18%(2.01%)、3.54%、1.74%、2.43%(1.20%)、1.00%(1.83%),均小于5%。结果表明方法重复性良好。
2.3.5 稳定性试验 取同一供试品溶液分别于0、3、6、12、18、24 h按“1.2.5”项下色谱条件进样分析,测得7个单糖峰的保留时间RSD分别为0.71%(0.24%)(根据峰1,2的保留时间分别计算,下同)、0.40%(0.69%)、0.62%(0.46%)、0.26%、0.80%、0.31%(0.54%)、0.55%(0.21%),均小于1%;峰面积RSD分别为3.50%(2.63%)(根据峰1,2的峰面积分别计算,下同)、2.68%(2.05%)、2.08%(2.15%)、3.92%、3.48%、1.98%(4.10%)、1.99%(1.81%),均小于5%。表明供试品溶液在24 h内稳定性良好。
2.3.6 加样回收率试验 精密称取已知含量的同一批次粗多糖样品6份,分别精密加入不同量的鼠李糖、岩藻糖、木糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖对照品适量,使得样品中所含各单糖量与加入的单糖对照品量之比约为1∶1,按“1.2.2”项下方法进行水解,并按“1.2.4”项下方法制成供试品溶液后按“1.2.5”项下色谱条件进行分析检测,计算加样回收率,结果见表2。

表2 加样回收率试验(n=6)

续表
2.4 样品测定
多糖是由10个以上的单糖基和糖苷键连接而成的天然生物大分子,其单糖组成分析是基础性和关键性的环节,水解后的单糖组成复杂且含量差异较大。采用本实验方法对提取的灵芝粗多糖样品经“1.2.2”项下方法水解后,按“1.2.4”项下方法制成供试品溶液,根据“1.2.5”项下色谱条件分别测定6批次样品中7种单糖成分的含量。含量测定结果见表3。

表3 粗多糖水解后单糖含量测定结果(mg/g)
其水解后的产物由7种单糖共同组成,其含量分别为:鼠李糖(2.42±0.10) mg/g、岩藻糖(2.19±0.08) mg/g、木糖(27.25±0.67) mg/g、阿拉伯糖(11.99±0.29) mg/g、甘露糖(0.45±0.01) mg/g、葡萄糖(0.85±0.04) mg/g和半乳糖(2.36±0.05) mg/g,含量大小依次为:木糖>阿拉伯糖>鼠李糖>半乳糖>岩藻糖>葡萄糖>甘露糖。摩尔比为:鼠李糖∶岩藻糖∶木糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=5.90∶5.34∶72.64∶31.96∶1.00∶1.89∶5.24。
3 结论
本研究建立的超声辅助酸解方法,具有速度快、效率高等显著优势,结合UPLC-CAD法可以实现灵芝多糖单糖组成的快速分析测定。对灵芝多糖酸解产物的单糖组成及含量进行分析比较,结果表明:灵芝多糖的完全水解产物中木糖的含量最高,其次为阿拉伯糖,而鼠李糖、半乳糖、岩藻糖含量接近,葡萄糖和甘露糖的含量较低,研究结果为评价灵芝药材质量及指导进一步开发利用提供了数据支持和技术参考。
