一株拮抗酿酒葡萄灰霉病的枯草芽孢杆菌T3筛选、鉴定及抑菌分析
2020-12-09夏俊芳郑素慧翟少华张志东苏金花艾赛提
夏俊芳,郑素慧,翟少华,张志东,苏金花,艾赛提,武 运
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091;3.新疆农业大学动物医学院,新疆乌鲁木齐 830052;4.新疆农业科学院微生物应用研究所,新疆乌鲁木齐 830091)
葡萄灰霉病是危害葡萄果实的重要病害之一[1],其病原菌是灰葡萄孢(Botrytiscinerea,简称B.cinerea),无论葡萄处于生长期、开花期还是结果期,均可被该B.cinerea侵染和破坏,B.cinerea是一种坏死性病原体,能够在感染期间分泌多种胞外酶和代谢产物杀死宿主细胞[2],该病原菌也能耐受低温,保持较高的萌发率[3],即使在-0.5 ℃条件下,也可以迅速传播并扩散至整串葡萄浆果,导致整个浆果的最终腐败,在多个主要葡萄栽培种植地区,灰霉病的危害非常严重[4-5],严重影响着葡萄与葡萄酒的生产[6-7]。目前对葡萄灰霉病的防治主要以化学防治为主,但长期大量使用化学杀菌剂,使得病原菌抗药性增强并产生环境污染及农药残留等问题[8-9]。葡萄酒是葡萄的发酵产品,葡萄酒的质量主要取决于原料的质量,而残留在葡萄中的农药会随着发酵过程迁移至葡萄酒中[10]。
消费者对食品中的农药残留和环境安全日益关注,对开发病害控制的替代方法的需求也在不断增加[11-12],生物防治是化学杀菌剂的一种潜在替代方法,目前已筛选出数种对葡萄B.cinerea具有拮抗作用的微生物,哈茨木霉(Trichodermaharzianum)[13-14]、绿色木霉(Trichodermaviride)[14]、长枝木霉(Trichodermalongibrachiatum)[14]、康氏木霉(Trichodermakoningii)[14]、假丝酵母(Candidaguilliermondii)A42[15]、假丝酵母(Candidasake)CPA-1[16]、假丝酵母(Candidadiversa)SW-W8[17]、毕赤酵母(Pichiapastoris)G5[18]、假单胞杆菌(Pseudomonas)BHG[19]、假单胞杆菌(Pseudomonas)BTZ[19]、枯草芽孢杆菌(Bacillussubtilis)BS2[20]、枯草芽孢杆菌(Bacillussubtilis)KS1[21]、枯草芽孢杆菌(Bacillussubtilis)Em7[22]、枯草芽孢杆菌(Bacillussubtilis)QST713[23]、枯草芽孢杆菌(Bacillussubtilis)B12[24]、解淀粉芽孢杆菌(Bacillusamyloquefaciens)D747[23]、解淀粉芽孢杆菌(Bacillusamyloquefaciens)B15[25]、洋葱霍尔德氏菌(Burkholderiacontaminans)B-1[26]等。这些拮抗菌株是生物防治措施中的关键因素,但这些对葡萄灰霉病具有良好抑菌效果的生防菌株主要筛选于鲜食葡萄内生菌或鲜食葡萄园根际微生物,而对酿酒葡萄及酿酒葡萄园根际微生物的研究较少。
天山北麓葡萄酒产区位于北纬43°~45°,属中温带大陆性干旱气候,土壤为多层结构的沙壤土,特有的气候、地域特色不仅赋予酿酒葡萄浓郁的香气和极高的甜度,更有极具开发潜质的地域特色微生物资源[27]。本研究将从新疆北麓葡萄酒产区酿酒葡萄根际土壤中分离出具有较强拮抗B.cinerea活性的细菌菌株,通过形态学、生理生化特性、16S rDNA基因序列确定拮抗菌的分类地位,并评价拮抗菌对B.cinerea的抑菌作用,以期为酿酒葡萄灰霉病的生物防治提供新的微生物资源。
1 材料与方法
1.1 材料与仪器
酿酒葡萄根际土样 新疆天山北麓葡萄酒产区部分酿酒葡萄园植株根部大田土样,采样后24 h内送至实验室用于拮抗菌的分离筛选;灰葡萄孢(Botrytiscinerea,B.cinerea) 新疆农业科学院农产品贮藏加工研究所;马铃薯葡萄糖琼脂(PDA)培养基、营养琼脂(NA)培养基、脑心浸液肉汤(BHI)培养基、生化试剂 北京陆桥生物技术有限公司;酵母浸出粉胨葡萄糖培养基(YPD)液体培养基(葡萄糖20 g/L、酵母膏10 g/L、蛋白胨20 g/L) 北京奥博星责任有限公司;牛津杯(内径6 mm,外径8 mm,高10 mm) 上海兢翀电子科技发展有限公司;其他试剂 均为国产分析纯。
LDZX-40SCI型高压灭菌锅 上海早安医疗器械厂产品;HR40-IIAI生物安全柜 青岛海尔特种电器有限公司;THZ-98AB恒温培养振荡箱 上海一恒科学仪器有限公司;LRH-280型生化培养箱 上海森信试验仪器有限公司;HSY2-SP电热恒温水浴锅 北京市永光明医疗仪器厂;Quanta FEG250场发射环境扫描电镜 美国FEI公司;722可见分光光度计 上海欣茂仪器有限公司;FE20 PLUS pH计 上海梅特勒托利多仪器有限公司;DJ100-3型电子分析天平 上海恒平科学仪器有限公司;血球计数板 上海求精生化试剂仪器有限公司。
1.2 实验方法
1.2.1 拮抗菌的筛选
1.2.1.1B.cinerea培养及孢子悬浮液制备 将保存的B.cinerea进行活化,25 ℃下在PDA斜面培养基上培养5~7 d,用接种针在斜面上刮取适量孢子,放入装有玻璃珠的250 mL三角瓶中,加入无菌生理盐水,振荡摇匀,用定性滤纸过滤,去掉菌丝获得孢子悬浮液,用血球计数板计数将孢子悬浮液的浓度调整为2.33×109个/mL,4 ℃保存、待用。
1.2.1.2 拮抗菌的分离纯化 采集新疆天山北麓三个酿酒葡萄园(天山冰湖葡萄酒庄葡萄园、中信国安玛纳斯葡萄酒厂葡萄园、新疆伊珠葡萄酒厂葡萄园)植株根部大田土样,每处地方选择3个采集点,除去根际表层5 cm左右的浮土,取5~10 cm处的土壤,带回实验室风干、过筛、混匀,每份土样称取10 g,溶解于90 mL无菌水中,加入小玻璃珠在150 r/min的摇床上振荡30 min,制成6个(10-1、10-2、10-3、10-4、10-5、10-6)稀释梯度的土壤悬浮液,均匀涂布在营养琼脂培养基上,37 ℃培养2~3 d。挑取形态不同的菌落划线培养至单菌落,纯化保存备用。
1.2.1.3 拮抗菌发酵液制备 分离纯化的形态不同的细菌菌落接种于10 mL的BHI液体培养基,37 ℃、120 r/min条件下,培养48 h后,通过平板稀释法确定梯度菌悬液结果分别为3.6×109~3.6×102CFU/mL,于4 ℃冰箱中贮存备用。
1.2.1.4 拮抗菌的筛选 采用牛津杯法进行抑菌效价,具体操作方法为:将PDA培养基15 mL倒入直径9 cm的平皿中,将培养基凝固后,吸取200 μL 2.33×109个/mLB.cinerea悬浮液,均匀地涂布于PDA培养基上,再将牛津杯置于平皿中央,往杯中加入处理后样品,对照样品或无菌水200 μL,严格按照无菌操作进行。接种后的培养皿置25 ℃培养箱连续培养5 d,采用十字交叉法测量牛津杯周围的抑菌圈直径,每个处理重复3次,抑菌效价最高的拮抗菌分离纯化、保存、备用。根据公式计算拮抗菌发酵液的抑菌效价:
抑菌直径(mm)=抑菌圈直径(mm)-牛津杯直径(mm)
抑菌效价(mm/mL)=抑菌直径(mm)/发酵液体积(μL)×1000。
1.2.2 拮抗菌株的鉴定
1.2.2.1 拮抗菌株形态观察 经纯化的拮抗菌株划线接种在营养琼脂平板培养基上,于37 ℃恒温箱中培养48 h后,观察菌落特征,革兰氏染色、芽孢染色后光学显微镜观察。
1.2.2.2 菌株生理生化鉴定 按照《伯杰细菌鉴定手册》[28]和《常见细菌系统鉴定手册》[29]对拮抗菌进行相关生理生化指标的测定。VP测定、MR测定、动力培养、明胶反应、硝酸盐还原反应、西蒙式柠檬酸盐、枸橼酸盐、丙二酸盐的利用试验、葡萄糖、阿拉伯糖、蔗糖、甘露醇、木糖、乳糖、棉子糖发酵试验、淀粉水解反应、酪素、溶菌酶试验。
1.2.2.3 16S rDNA分子生物学鉴定 利用细菌16S rDNA,对筛选到的菌株进行分子生物学鉴定,这部分测序试验由鼎国昌盛生物科技有限公司完成。细菌16S rDNA通用引物27F:5 ′-AGAGTTTGATCC TGGCTCAG-3′;1492R:5′-CGGTTACCTTGTTACG ACTTC-3′,采用单菌落为模板进行PCR扩增。PCR反应体系总体积50 μL:预混液25 μL、正反向引物(10 μmol/L)各1 μL、菌样模板1 μL、ddH2O 22 μL。PCR扩增程序为,94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min 30 s,35个循环,72 ℃ 10 min。扩增后,产物经琼脂糖电泳分离后将亮度好、纯度高的特异性条带(1500 bp左右)的PCR产物用鼎国昌盛(NEP025-1)试剂盒切胶回收纯化,将对应目的片段置于-20 ℃下保存双向引物测序,基因测序结果在NCBI通过BLAST进行序列比对分析,采用MEGA 7.0.14软件,构建菌株的系统发育树。
1.2.3 拮抗菌生长特性分析
1.2.3.1 拮抗菌生长曲线绘制 参考文献[30],吸取3.6×108CFU/mL的拮抗菌菌液1 mL于100 mL BHI培养基中,37 ℃培养,摇床转速120 r/min,每4 h开始用分光光度计在600 nm波长下测OD值,将测定的光密度值与其对应的培养时间作图,以不接菌培养液为空白对照。
1.2.3.2 拮抗菌最适培养温度测定 参考文献[30],吸取3.6×108CFU/mL的拮抗菌菌液1 mL于100 mL BHI培养基中,分别于25、28、30、37、40、45 ℃,120 r/min摇床培养至稳定期,用分光光度计在600 nm波长下测OD值,以不接菌培养液为空白对照。
1.2.3.3 拮抗菌最适pH测定 参考文献[30],用1% NaOH或1% HCl,将BHI液体培养基pH分别调节为3.0、5.0、6.0、7.0、8.0、9.0、11.0。吸取3.6×108CFU/mL的拮抗菌菌液1 mL于上述不同pH的100 mL BHI培养基中,37 ℃、120 r/min培养至稳定期,用分光光度计在600 nm波长下测OD值,以不接菌培养液为空白对照。
1.2.4B.cinerea拮抗菌抑菌作用初探
1.2.4.1 拮抗菌对B.cinerea抑菌作用随时间变化趋势 采用1.2.1.4牛津杯法以PDA平板中接种200 μLB.Cinerea孢子悬液,涂布均匀后,接种100 μL 3.6×108CFU/mL菌悬液于牛津杯中,以无菌水蒸馏水作对照,连续120 h培养观察拮抗菌对B.cinerea的抑菌效果。
1.2.4.2 拮抗菌对B.cinereaMIC和MBC的测定 将制备的2.33×109个/mLB.cinerea孢子悬液吸取0.1 mL,分别加入到10 mL不同浓度的拮抗菌发酵液中摇匀,于600 nm波长下用分光光度计测定稀释液初始吸光值,然后在水浴振荡器中进行振荡培养,振荡频率50 r/min,于37 ℃培养48 h,取出后再在600 nm分光光度计下读数,吸光值与初始吸光值相同的试管浓度为稀释液的最低抑菌浓度MIC。把测定完的MIC试管继续在相同条件下培养12 h时间,再在600 nm波长下测定吸光值,吸光值与初始吸光值仍相同的试管浓度为MBC。
1.2.4.3 不同浓度的拮抗菌株对B.cinerea抑制作用 采用1.2.1.4法测定抑菌效果,以PDA平板中接种200 μLB.Cinerea悬液,涂布均匀后备用,分别取100 μL各浓度菌悬液稀释液(3.6×105~3.6×109CFU/mL)注入牛津杯中,25 ℃培养120 h,观察抑菌效果并计算抑菌效价。
1.2.4.4 扫描电镜观察拮抗菌株对B.cinerea菌丝生长的影响 取1 mL 3.6×108CFU/mL拮抗菌悬液加入到冷却到45 ℃熔化的25 mL PDA培养基中,混匀后制平板,以不加拮抗测试液的PDA培养基为对照。同步接种B.cinerea菌丝块,25 ℃培养箱中培养120 h,挑取拮抗菌处理及对照平板上的边缘菌丝,将菌丝滴加于粘有碳导电胶带的样品台上,自然晾干扫描电镜下观察菌丝形态变化情况。
1.3 数据处理
实验中每个处理重复三次,数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序,差异显著性采用Duncan检验进行多重比较,应用Excel 2016和MEGA 7.0.14制作图表。
2 结果与分析
2.1 拮抗菌的筛选结果
注:同行不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。表3、表5同。
从酿酒葡萄根际土壤共分离到15株细菌,经过挑取形状、大小、颜色等不同菌落分别划线接种于营养琼脂,直至无杂菌落纯化培养后分离到T1、T3、M1、M2、Y1 5株菌,拮抗菌牛津杯法筛选结果如图1,其中T3出现明显的抑菌圈,由表1可知,T3菌对B.cinerea抑菌直径为31.5±0.2 mm(P<0.05),抑菌效价为157.5±1.0 mm/mL(P<0.05),其它菌株几乎对B.cinerea无抑菌效果,T3菌株分离于新疆天山冰湖葡萄酒庄酿酒葡萄园。

图1 拮抗菌株分离信息
2.2 拮抗菌的鉴定结果
2.2.1 拮抗菌形态学鉴定结果 如图2,在营养琼脂培养基上,T3菌株菌落圆形、光滑、湿润、乳白色、隆起、边缘不整齐,菌落直径大小2 mm;在静置BHI液体培养基中,培养液出现轻微浑浊,液面呈现褶皱完整的膜,光学显微镜(100×10)观察菌体呈细杆状,革兰氏染色为蓝紫色,孔雀绿染色中生椭圆芽孢,T3为革兰氏阳性芽孢杆菌。

表1 不同细菌对灰葡萄孢抑菌效价

图2 T3菌形态学结果
2.2.2 拮抗菌生理生化鉴定结果 菌株T3的生理生化特性情况如表2所示。T3菌株VP反应阳性,MR反应阴性,动力培养阳性,明胶液化、硝酸盐还原阳性,无法利用西蒙氏柠檬酸盐、枸橼酸盐,丙二酸盐利用阳性,能发酵葡萄糖、阿拉伯糖、蔗糖、甘露醇、木糖、乳糖,不能发酵棉子糖,能水解淀粉,分解酪素,溶菌酶反应阴性。参考《伯杰氏细菌鉴定手册》[28]和《常见细菌系统鉴定手册》[29],初步鉴定T3菌株为枯草芽孢杆菌(Bacillussubtilis)。

表2 T3菌株生理生化特性
2.2.3 拮抗菌16S rDNA序列分析 通过PCR扩增产生的DNA片段为单一条带,大小长度约为1500 bp,扩增产物无明显非特异扩增现象,结果见图3。菌株16S rDNA序列经测序后经NCBI网站进行比对分析,选择较为相似的序列构建系统发育树,如图4,T3菌株与BacillussubtilisstrainASS4B(JQ905096.1)的同源性最高,达到100%。故T3菌株为枯草芽孢杆菌(Bacillussubtilis),这与形态学、生理生化特征的鉴定结果一致。

图3 T3菌株的16S rDNA扩增电泳结果

图4 T3菌株的系统发育树
2.3 拮抗菌生长特性结果
2.3.1 拮抗菌生长曲线结果 T3的生长曲线如图5所示,0~4 h属于延滞期,4~24 h属于对数生长期,菌体快速生长,24 h时菌体数量达到最高值,达到OD600=0.89,此时菌体生长旺盛代谢活性高,24~48 h属于稳定期,此时期菌体分泌次级代谢产物,48 h后进入衰亡期,体系代谢产物积累,活性逐渐降低,由图5知T3菌能较长时间保持稳定,发挥生物活性。
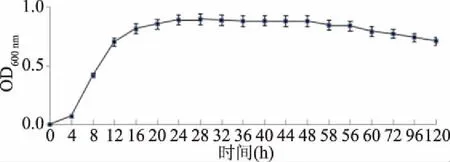
图5 T3菌株的生长曲线
2.3.2 拮抗菌的最适生长温度 T3菌株在不同温度下的生长情况如图6,T3菌株在25~45 ℃内均能生长,表明该菌具有较强的耐温性,当温度为25~37 ℃,随着温度的升高,菌株生长活力逐渐升高,当温度为37~45 ℃,随着温度的升高,菌株生长活力逐渐减小,可见T3菌株最适的生长温度为37 ℃。

图6 不同温度下T3菌株的生长情况
2.3.3 拮抗菌的最适pH T3菌株在不同pH下的生长情况如图7,在pH3.0~11.0范围,T3菌株均能生长,pH在3.0~7.0时,菌株生长能力随着pH的增大而增大,当pH>7.0时培养液浑浊且形成菌膜,当pH>7.0时,菌液OD值逐渐降低,可见,T3菌株最适培养pH=7.0。
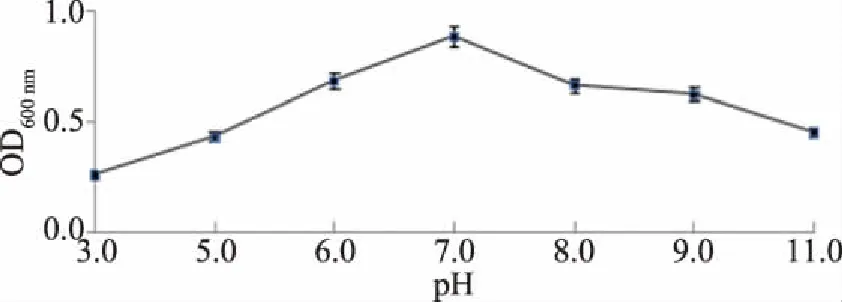
图7 不同pH下T3菌株的生长情况
2.4 拮抗菌对B. cinerea抑菌作用分析
2.4.1 拮抗菌对B.cinerea抑菌作用随时间变化趋势 由图8和表3知,T3菌株对B.cinerea抑菌作用随时间变化趋势图,培养48 h(图8B),B.cinerea绕开添加T3菌液的牛津杯生长并出现白色菌丝,此时期为T3菌的稳定期,抑菌物质在此时期分泌,抑菌直径为34.5±0.4 mm(P<0.05),抑菌效价为172.5±2.0 mm/mL(P<0.05);培养72 h(图8C),B.cinerea孢子颜色变灰黑色,添加T3菌液的牛津杯周围无B.cinerea生长;培养96 h(图8D),B.cinerea孢子黑色加深,抑菌现象较明显,但部分菌丝仍为灰白色;培养120 h(图8E),B.cinerea孢子黑色,可观察到明显抑菌现象,抑菌直径为31.4±0.2 mm(P<0.05),抑菌效价为157.0±1.0 mm/mL(P<0.05)。由图8、表3知,T3菌对B.cinerea抑制作用在共培养48 h即可看到抑菌趋势,即此时T3菌分泌抑菌物质,而B.cinerea孢子完全成熟需要120 h,可观察到明显抑菌现象,T3菌具有较长的抑菌物质产生期,此抑菌活性物质需后期进一步分析研究。

图8 T3菌株抑菌效果随时间变化趋势

表3 不同培养时间的T3菌株对灰葡萄孢抑菌效价
2.4.2 拮抗菌对B.cinerea的MIC和MBC 由表4可知,T3菌株对B.cinerea最小抑菌浓度(MIC)为3.6×105CFU/mL,最小杀菌浓度(MBC)为3.6×106CFU/mL。

表4 T3菌株对灰葡萄孢的MIC和MBC(CFU/mL)

表5 不同浓度的T3菌悬液对灰葡萄孢抑菌效价
2.4.3 不同浓度的拮抗菌对B.cinerea抑制作用结果 不同浓度的T3菌对B.cinerea抑制作用如图9所示,相对应的抑菌效价如表5,当T3菌浓度为3.6×105CFU/mL,几乎无法观察抑菌现象(P<0.05),T3菌悬液为3.6×109CFU/mL时抑菌直径为31.6±0.2 mm(P<0.05),抑菌效价达到158.0±1.0 mm/mL(P<0.05),表明高浓度T3菌悬液对B.cinerea具有良好的抑制作用,且对B.cinerea抑菌效价随着T3菌悬液浓度的升高而升高。

图9 不同浓度的T2菌悬液对灰葡萄孢(Botrytis cinerea)抑制作用
2.4.4 扫描电镜观察T3菌株对B.cinerea菌丝生长的影响 图10A~C对照组,不同倍数(×400倍、×800倍、×1600倍)扫描电镜图,菌丝稠密粗细均匀,孢子繁密,原生质分布均匀;图10D~F T3菌处理组,不同倍数(×400倍、×800倍、×1600倍)扫描电镜图,菌丝稀疏粗细不均匀、菌丝扭曲、畸形,顶端膨大,孢子稀松,原生质收缩,出现空洞。T3菌抑制B.cinerea菌丝生长及孢子萌发。

图10 扫描电镜下T3菌悬液对灰葡萄孢菌丝生长的影响
3 结论与讨论
植物根际微生物具有重要的农业意义,芽孢杆菌属的细菌具有产孢子能力,能以芽孢形式存活下来,并在有利条件下恢复活性,这使得芽孢杆菌在开放和严酷的环境中能够发挥作用,可开发成环保和可持续的生物菌剂[31]。迄今为止,利用芽孢杆菌对植物病害进行生物防治的研究相当多,但多数研究多限于实验室条件下,生产应用较为成功的仅为少数,其中以枯草芽孢杆菌作为生物载体的生物菌剂应用最多,如美国Gustafson公司的Bacillussubtilisstrain GBO3、美国Agraquest公司Bacillussubtilisstrain QST 713、美国Becker Underwood公司BacillussubtilisMBI 600、德国Abitep GmbH公司B.subtilisvar.amyloliquefaciensstrain FZB24等[32]。同时有学者研究发现生物菌剂具有降解农药残留作用,Salunkhe等[33-34]研究发现葡萄根际分离的枯草芽孢杆菌DR-39、CS-126、TL-171、TS-204在葡萄浆果上显示出良好的降解农药残留作用。由此可见,枯草芽孢杆菌(Bacillussubtilis)在植物病害生物防治及降解农药残留方面展现出巨大的应用潜力。
本研究从新疆天山北麓葡萄酒产区冰湖葡萄酒庄葡萄园酿酒葡萄植株根际土壤中分离到一株具有明显拮抗B.cinerea作用的T3菌株,经形态学、生理生化特征及16S rDNA测序鉴定及系统进化树确定T3菌为枯草芽孢杆菌(Bacillussubtilis),培养24~48 h,T3菌株进入稳定期,T3菌株最适的生长温度为37 ℃,最适pH为7.0。T3菌株对B.cinerea抑制作用在共培养48 h可看到抑菌趋势,即T3菌48 h分泌抑菌物质,共培养120 h,可观察到明显抑菌现象,T3菌株具有较长的抑菌物质产生期。T3菌株对B.cinerea的MIC为3.6×105CFU/mL、MBC为3.6×106CFU/mL,抑菌效价随着T3菌悬液浓度的升高而升高,3.6×109CFU/mL T3菌株对B.cinerea抑菌31.6±0.2 mm(P<0.05),抑菌效价达到158.0±1.0 mm/mL(P<0.05),扫描电镜观察T3菌液造成B.cinerea菌丝粗细不均匀、畸形、扭曲、顶端膨大、原生质收缩、孢子稀松,抑制菌丝生长及孢子萌发。尽管本研究从新疆天山北麓葡萄酒产区酿酒葡萄地筛选的T3菌具有良好抑制B.cinerea效果,可作为酿酒葡萄灰霉病的潜在生防源,但其抑菌机理及实际大田防病效果尚未研究,后续试验将对上述问题做进一步研究,使之成为有效的酿酒葡萄灰霉病生物控制剂。
