重型脑损伤患者血清UCH-L1、Caspase-3水平变化及其临床意义
2020-12-09余前王璐杨平来周立田刘维军
余前,王璐,杨平来,周立田,刘维军
1 东南大学附属中大医院溧水分院,江苏南京211200;2 济南护理职业学院
随着社会和经济的迅速发展,交通事故伤和高处摔落伤概率大大增加,由此引起的重型脑损伤(SBI)发生率亦不断升高。SBI的致残率和致死率均较高,是导致青壮年死亡的主要原因之一。及早对SBI患者进行病情评估和预后判断,从而指导临床制定有效的干预措施,对改善患者预后具有重要意义[1]。SBI患者的脑组织挫伤区有凋亡细胞的存在,细胞凋亡是神经元死亡的主要方式,在动物神经损伤模型中证实,神经元内存在凋亡—抗凋亡信号机制。因此,监测调控凋亡—抗凋亡信号途径的生物学指标可能对SBI患者病情评估和预后判断具有一定价值[2]。泛素羧基末端水解酶L1(UCH-L1)是泛素羧基末端水解酶家族成员之一,不仅具有去泛素化作用,还具有泛素连接酶活性。UCH-L1主要在神经元中表达,具有促进神经元细胞凋亡的作用。有研究报道,UCH-L1异常表达与脑损伤密切相关[3]。天冬氨酸特异性半胱氨酸蛋白酶3(Caspase-3)是脑损伤过程中的重要蛋白酶之一,可通过结构变化和影响特定信号分子参与细胞凋亡的发生[4]。但目前UCH-L1、Caspase-3与SBI的关系尚不完全清楚。本研究观察了SBI患者血清UCH-L1、Caspase-3水平变化,并探讨其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择2017年12月—2019年12月东南大学附属中大医院溧水分院收治的SBI患者122例(观察组),男74例、女48例,年龄(59.94±13.69)岁。纳入标准:①有明确头部外伤史;②经颅脑CT或MRI检查证实存在脑挫裂伤、颅内出血、脑水肿等SBI征象;③发病时间<12 h;④入院时格拉斯哥昏迷量表(GCS)评分≤8分。排除标准:①合并缺血性卒中或自发性脑出血者;②合并颅内感染者;③合并血液系统、免疫系统疾病或恶性肿瘤者;④合并心、肝、肾等重要脏器严重功能障碍者。同期选择在东南大学附属中大医院溧水分院体检健康的志愿者61例(对照组),男39例、女22例,年龄(58.41±14.72)岁。两组性别、年龄具有可比性。本研究经东南大学附属中大医院溧水分院医学伦理委员会批准,研究对象或其家属知情同意。
1.2 血清UCH-L1、Caspase-3检测 观察组入院次日,对照组体检当日,采集清晨空腹肘静脉血10 mL,室温静置1 h,2 000 r/min离心15 min、离心半径14 cm,留取上层血清,-80 ℃保存,待标本成批。采用双抗体夹心ELISA法检测血清UCH-L1、Caspase-3。UCH-L1 ELISA试剂盒购自美国BIM公司,Caspase-3 ELISA试剂盒购自上海西唐生物科技有限公司。所有操作严格按照试剂盒说明进行。
1.3 资料收集与分析 收集SBI患者基本资料,包括性别、年龄、吸烟史、饮酒史、既往史(高血压、糖尿病、冠心病)。同时,收集SBI患者入院时GCS评分、脑部Marshall CT分级、脑组织中线移位、脑池异常、蛛网膜下腔出血情况。记录SBI患者入院30 d生存结局,比较生存者与死亡者上述临床资料。以SBI患者入院30 d生存结局为因变量,将上述有统计学差异的指标纳入多因素Logistic回归分析,分析SBI患者入院30 d死亡的影响因素。

2 结果
2.1 两组血清UCH-L1、Caspase-3水平比较 观察组与对照组血清UCH-L1水平分别为(29.43±6.58)、(10.15±2.59)ng/mL,血清Caspase-3水平分别为(613.27±159.43)、(162.25±37.64)ng/mL。观察组血清UCH-L1、Caspase-3水平均高于对照组(t分别为22.023、21.766,P均<0.05)。
2.2 SBI患者入院30 d死亡的影响因素分析 SBI患者入院30 d死亡30例、存活92例。死亡者与存活者临床资料比较见表1。以SBI患者入院30 d死亡为因变量,以年龄、入院时GCS评分、脑组织中线移位、脑池异常、脑部Marshall CT分级以及血清UCH-L1、Caspase-3水平为自变量,进行多因素Logistic回归分析。结果显示,脑部Marshall CT分级及血清UCH-L1、Caspase-3水平是SBI患者入院30 d死亡的危险因素,而入院时GCS评分是其保护因素(P均<0.05)。SBI患者入院30 d死亡的影响因素分析见表2。

表1 SBI患者入院30 d生存者与死亡者临床资料比较
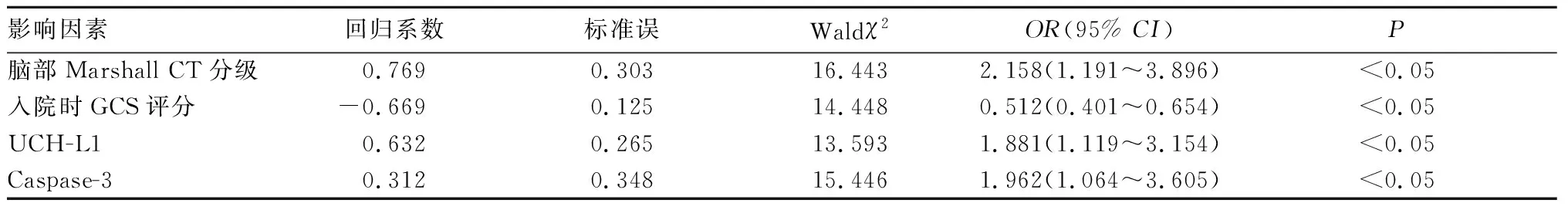
表2 SBI患者入院30 d死亡的影响因素分析
2.3 血清UCH-L1、Caspase-3水平对SBI患者入院30 d死亡的预测效能 ROC曲线分析显示,血清UCH-L1水平预测SBI患者入院30 d死亡的曲线下面积(AUC)为0.797(95%CI:0.704~0.890),其截断(cut off)值为29.34 ng/mL,此时其预测SBI患者入院30 d死亡的敏感度为81.67%、特异度为82.42%;血清Caspase-3水平预测SBI患者入院30 d死亡的AUC为0.804(95%CI:0.716~0.892),其cut off值为569.52 ng/mL,此时其预测SBI患者入院30 d死亡的敏感度为83.33%、特异度为74.52%;二者联合预测SBI患者入院30 d死亡的AUC为0.884(95%CI:0.816~0.952),其预测SBI患者入院30 d死亡的敏感度为85.00%、特异度为86.95%。二者联合对SBI患者入院30 d死亡的预测效能高于二者单独(Z分别为3.781、4.965,P均<0.05)。见图1。
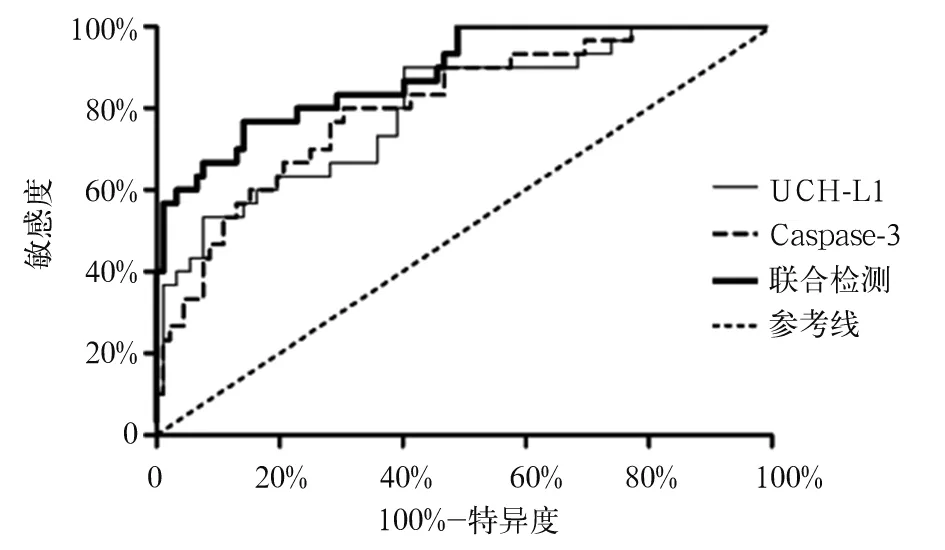
图1 血清UCH-L1、Caspase-3水平预测SBI患者入院30 d死亡的ROC曲线
3 讨论
随着社会和经济的迅速发展,交通事故伤和高处摔落伤概率大大增加,由此引起的SBI发生率亦不断升高。尽管现代医疗技术有了长足的进步,但SBI的致残率和致死率一直居高不下。据报道,脑损伤的病死率为4%~7%,而SBI的病死率为50%~60%[5]。虽然S100蛋白、Tau蛋白、神经元特异性烯醇化酶等对脑损伤病情评估和预后判断有一定帮助,但其敏感度和特异度不理想[6]。因此,寻找SBI病情评估和预后判断的生物标志物仍是现阶段重症医学领域的研究热点和难点。
UCH-L1是泛素羧基末端水解酶家族成员之一,在脑组织中含量丰富,是神经组织特有的一种胞质酶,特异性存在于神经内分泌细胞、神经元细胞核周及树突中,占可溶性脑蛋白的1%~5%,对内源性脑蛋白酶和血清蛋白酶具有抵抗作用[7]。研究认为,UCH-L1是神经系统损伤高度特异的生物标志物。RAMEZANI等[8]研究发现,严重脑损伤患者在损伤后1 h即可观察到血清UCH-L1水平升高,并且其升高速度和幅度与病情程度呈明显正相关关系。有研究还发现,轻度和中度脑损伤患者早期血清UCH-L1水平即可出现较大差异[9]。本研究结果发现,观察组血清UCH-L1水平明显高于对照组,与既往研究结论基本一致。本研究SBI患者入院30 d的病死率为24.59%,提示SBI患者短期预后较差。进一步研究发现,SBI死亡者血清UCH-L1水平高于存活者;多因素Logistic回归分析显示,血清UCH-L1水平是SBI患者入院30 d死亡的危险因素。提示血清UCH-L1水平能够用于预测SBI患者生存结局。以往对SBI患者预后的评估多采用GCS评分,但该评分易受患者生命体征和药物因素的影响,临床应用价值有限[10]。王佳等[11]研究发现,血清UCH-L1水平联合中性粒细胞明胶酶相关脂质运载蛋白对SBI患者6个月内预后不良具有较好的预测价值。乔柏林等[12]研究亦证实,血清UCH-L1水平对严重颅脑损伤具有较好的预测价值。这些研究表明血清UCH-L1可作为评估脑损伤患者预后的生物学指标之一。本研究结果进一步证实,血清UCH-L1水平可用于预测SBI患者短期预后。SBI患者脑组织损伤严重,细胞骨架破裂,神经细胞中的UCH-L1大量释放,而脑组织挫伤还可导致血脑屏障破坏,进而使UCH-L1随脑脊液外流释放入血[13],引起血清UCH-L1水平升高。血清UCH-L1水平越高,表明脑组织损伤越重。因此,血清UCH-L1水平能够较好地预测SBI患者预后。
Caspase-3是天冬氨酸特异性半胱氨酸蛋白酶超家族成员之一。正常情况下,Caspase-3以非活化的酶原形式存在于细胞中;当机体出现异常,Caspase-3在多种蛋白水解酶的作用下发生裂解而活化,进而充当细胞凋亡的启动子或效应子,是神经细胞凋亡的关键蛋白酶[14]。本研究结果显示,观察组血清Caspase-3水平明显高于对照组。进一步研究发现,SBI死亡者血清Caspase-3水平高于存活者;多因素Logistic回归分析显示,血清Caspase-3水平是SBI患者入院30 d死亡的危险因素。以上研究结果提示,Caspase-3可能参与SBI的发生、发展。刘雪艳等[15]研究发现,重度颅脑损伤患者入院时血清Caspase-3水平明显升高,且其预测患者30 d内死亡的准确度较高。本研究结果进一步证实血清Caspase-3水平可用于预测SBI患者短期预后。有研究报道,Caspase-3能够参与缺血性脑损伤后迟发性神经元的死亡过程,并且Caspase-3可能是神经细胞凋亡级联反应中的关键因子[16-17]。提示Caspase-3可能是通过促进SBI患者脑组织再损伤,从而使病情进一步加重。目前,Caspase-3活化后的具体机制尚不完全清楚,其参与细胞凋亡的机制包括切断DNA修复蛋白、细胞骨架蛋白,进而引起DNA断裂、碎片形成[18]。SBI患者脑组织损伤严重,神经元细胞出现凋亡,死亡受体被激活,而死亡受体联合死亡诱导信号可激活Caspase-3,进而通过裂解DNA修复蛋白、骨架蛋白等途径造成神经元细胞大量死亡,引起脑组织二次损伤[19-20],最终导致SBI患者预后较差。因此,血清Caspase-3水平能够较好地预测SBI患者预后。
本研究还发现,血清UCH-L1、Caspase-3水平联合预测SBI患者入院30 d死亡的AUC高达0.884,其预测效能高于二者单独。提示二者联合检测有利于早期评估SBI患者短期预后。
综上所述,SBI患者血清UCH-L1、Caspase-3水平升高;血清UCH-L1、Caspase-3水平是SBI患者入院30 d死亡的危险因素,并可作为预测SBI患者短期预后的生物学指标,二者联合时预测价值更高。
