一株羊种变异布鲁氏菌分离株遗传特征分析
2020-12-08杨晓雯韩秀瑞朴东日赵鸿雁田国忠
杨晓雯,韩秀瑞,朴东日,赵鸿雁,田国忠,姜 海
布鲁氏菌(Brucella)是一种兼性胞内寄生菌,易造成宿主持续性感染,引起全球性人兽共患流行性疾病—布鲁氏菌病。该病主要表现为发热、多汗、乏力、关节疼痛等症状,严重者使患者丧失劳动能力,影响公共卫生安全以及经济发展[1]。人感染布鲁氏菌若诊疗不及时,容易引起各种并发症,如脊柱炎、心内膜炎、脑炎等[2]。羊种、牛种、猪种和犬种布鲁氏菌能够感染人。全球人间布鲁氏菌病发病率年平均超过50万例[3],中东地区每百万人口的布鲁氏菌病发病率均在200以上,叙利亚发病率最高(1 603.4/10万),但据世界卫生组织(WHO)调查表明,实际发病率是报告的10~25倍[4]。我国布鲁氏菌病首次报道于内蒙古[5],人间布鲁氏菌病疫情于1957-1963年和1969-1971年出现两次流行高峰。随着动物布鲁氏菌病疫苗的使用,上世纪80-90年代人畜布鲁氏菌病发病率显著下降[6],但自20世纪90年代中期开始,布鲁氏菌病疫情在国内再次肆虐,并从北方扩展到南方[7],全国32省市自治区均有病例报道[8]。
自然条件下,除犬种和绵羊附睾种布鲁氏菌外,其余种型布鲁氏菌为光滑型布鲁氏菌。布鲁氏菌的表型主要由外膜外侧的脂多糖(LPS)决定。LPS由类脂A、核心寡聚糖和O抗原组成,根据LPS是否含有O抗原,将布鲁氏菌分为光滑型和粗糙型,光滑型布鲁氏菌的LPS含有O抗原(S-LPS),而粗糙型布鲁氏菌的LPS缺少O抗原(R-LPS)[9]。粗糙的布鲁氏菌的致病力降低,而粗糙型通常不会引起人类布鲁氏菌病[10]。本研究针对课题组保存的菌株,经表型鉴定后,利用全基因组测序技术对变异羊种布鲁氏菌进行测序,分析其遗传特征,为我国布鲁氏菌病的防控提供基础性数据。
1 材料与方法
1.1布鲁氏菌菌株 布鲁氏菌标准菌株和变异菌株于中国疾病预防控制中心传染病所BSL-3实验室内传代培养及增殖。布鲁氏菌标准菌株基因组序列及其氨基酸序列于NCBI Refseq数据库中下载(https://ftp.ncbi.nlm.nih.gov/genomes/brucella/)。
1.2粗糙表型鉴定 利用单因子R血清、三胜黄素检测表型。取培养后的布鲁氏菌,利用生理盐水调整其比浊度为0.5 McF,取30 μL菌液与分别等体积的单因子R血清和三胜黄素混合,2 min观察实验结果。粗糙型布鲁氏菌存在凝集现象,而光滑型布鲁氏菌不凝集[11]。
结晶紫染色检测表型。待平板上长出单菌落后,稀释结晶紫染液至工作浓度,覆盖单菌落表面染色15~20 s,弃掉染液后放大镜观察菌落着色情况。粗糙型布鲁氏菌着色,被染成红色或者紫色;光滑型菌落不着色,仍然为原来的黄色或黄绿色[11]。
1.3LPS提取及鉴定 划线培养布鲁氏菌,取适量培养48 h的菌体,利用生理盐水调整比浊度为1.5 McF,此时细菌浓度约为1.0×109CFU/mL。将菌液于室温下13 000 r/min离心,弃掉上清液,重复2~3次,获取足够的细菌,然后按照脂多糖提取试剂盒(iTron,韩国)的操作说明提取LPS,-20 ℃保存。将提取的LPS利用SDS-PAGE(康为世纪,中国)检测,选用银染试剂盒(碧云天,中国)染色。
1.4全基因组测序 划线培养菌株,取适量培养48 h的菌体,使用Wizard Genomic DNA Purification试剂盒(Promega,美国)提取细菌基因组DNA。检测合格的基因组DNA,使用Nextera XT Library Prep试剂盒(Illumina,美国)添加接头,进行了测序文库的制备。将序列送交华大基因有限公司(中国),使用Illumina / Solexa测序分析仪对文库进行测序,基因组覆盖度大于100倍(100 ×)。
测序完成后获得原始数据(raw data),应用fastQC(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)进行测序质量评价,去除冗余序列及质量低的序列。同时,将通过测序质量评价的序列去掉接头,即为clean data,后续分析使用clean data进行。
1.5比较基因组分析 利用BWA[12]将clean data比对到参考基因组上,允许最大gap为5,应用samtools[13]输出测序深度,同时输出4 ×和20 ×测序覆盖度,利用excel统计测序深度和覆盖度。利用velvet[14]将clean data进行组装成大片段序列contig,利用BLAST将contig在全基因组中定位,利用Vector NTI设计引物将gap补全成为完整基因组,利用NCBI Prokaryotic Genome Annotation Pipeline (PGAP)[15]进行全基因组注释。
利用samtools和GATK[16]相结合的方法检测SNP和InDel,更准确地对变异进行识别。通过多种算法各自识别的SNP和InDel进行一致性分析,保留具有高度一致性的变异作为最终结果,这些高度一致性的SNP和InDel具有非常高的可信度。将最终结果利用GATK进行过滤,留下测序质量大于20且两个SNP的距离不小于5的SNP和InDel。
将参考基因组的序列建库,提取出参考基因组的蛋白编码序列,蛋白序列和信使RNA序列(mRNA)等,利用snpEff[17]对找到的变异进行注释,包括同义突变,错义突变,移码突变等,同时利用excel统计每个样品的变异位点,数量和每kb SNP的大小用于比较变异率。
对完整的基因组来说,利用MAUVE[18]将全基因组比对SNP结果输出;对测序样品来说,利用samtools和GATK结合寻找变异位点,从过滤后的最终结果中提取出SNP位点。利用phyloSNP将两者的输出结果构建矩阵,采用邻接法(Neighbor-joining method,NJ)构建进化树,自检值为1 000。
2 结 果
2.1变异羊种布鲁氏菌 本研究发现,分离自宁夏的1株羊种布鲁氏菌能够与R血清和三胜黄素(图1)发生凝集,且被结晶紫染色,初步判断该菌株为变异羊种布鲁氏菌。

图1 三胜黄素凝集试验检测布鲁氏菌表型Fig.1 Rough phenotype detection by acriflavinium chloride
提取该菌株以及参考布鲁氏菌菌株的LPS后,利用SDS-PAGE凝胶检测,发现羊种布鲁氏菌参考菌株16M、羊种疫苗株M5以及另外两株分离株LPS条带分布基本一致,除共有的条带簇之外,在34-43 kDa,55-95 kDa及180 kDa附近也有明显的LPS组成条带分布(图2)。而犬种布鲁氏菌RM6/66和宁夏分离株的LPS则不具有以上3个条带簇。从LPS的凝胶检测条带中可以发现,光滑型布鲁氏菌含有长链的O侧链,而宁夏分离株的脂多糖条带更接近于粗糙型犬种布鲁氏菌RM6/66,主要包括中链和短链的O侧链,这和凝集试验结果相一致。
2.2变异菌株全基因组注释 宁夏分离株共获得1.48 Gb大小的原始数据,过滤后共获得1.25 Gb大小的clean data。利用velevet进行组装时,收集大于500 bp的contig。宁夏分离株基因组草图包含27个contigs,最长contig片段为609 252 bp,N50大小为358 887 bp,序列GC含量为57.24%。
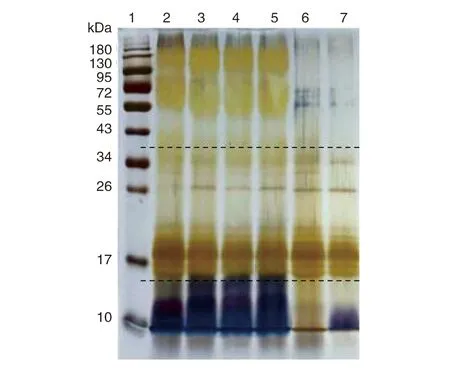
1为蛋白marker,2为羊种布鲁氏菌16M菌株的LPS,3为羊种布鲁氏菌疫苗株M5菌株的LPS,4-5为其他分离株的LPS,6为犬种布鲁氏菌RM6/66菌株的LPS,7为本研究涉及的宁夏分离株的LPS。图2 SDS-PAGE检测LPS的完整性Fig.2 Composition of LPS by SDS-PAGE
利用Vector NTI设计引物将gap补全成为完整基因组,结果发现,宁夏分离株的全基因组序列中包含两条染色体,染色体1大小为2 126 100 bp,染色体2大小为1 185 600 bp,基因组大小为3 311 700 bp,GC含量为57.2%。该分离株基因组经注释后含有3 379个CDS,9个rRNA,55个tRNA和4个ncRNA(图3)。

图3 羊种布鲁氏菌粗糙型变异菌株全基因组基因功能注释图Fig.3 Annotation of the whole genome sequences of the rough B. melitensis strain
2.3变异菌株遗传特性分析 利用全基因组构建进化树可知,宁夏分离株属于羊种布鲁氏菌,且与羊种2型标准菌株ATCC23457亲缘关系最近。以羊种2型菌株ATCC23457为参考基因组,利用GATK和samtools寻找SNPs和InDel,结果发现,与参考菌株相比,该菌株存在282个变异,其中243个SNPs,39个InDel(17个Ins和22个Del)。SNP主要存在于C和T的变异之间,其中SNPs转换(transitions,Ts)348个,颠换(transversions,Tv)137个,Ts/Tv率为2.54,变异率较低,表明基因组与参考基因组相比差异较小(图4)。
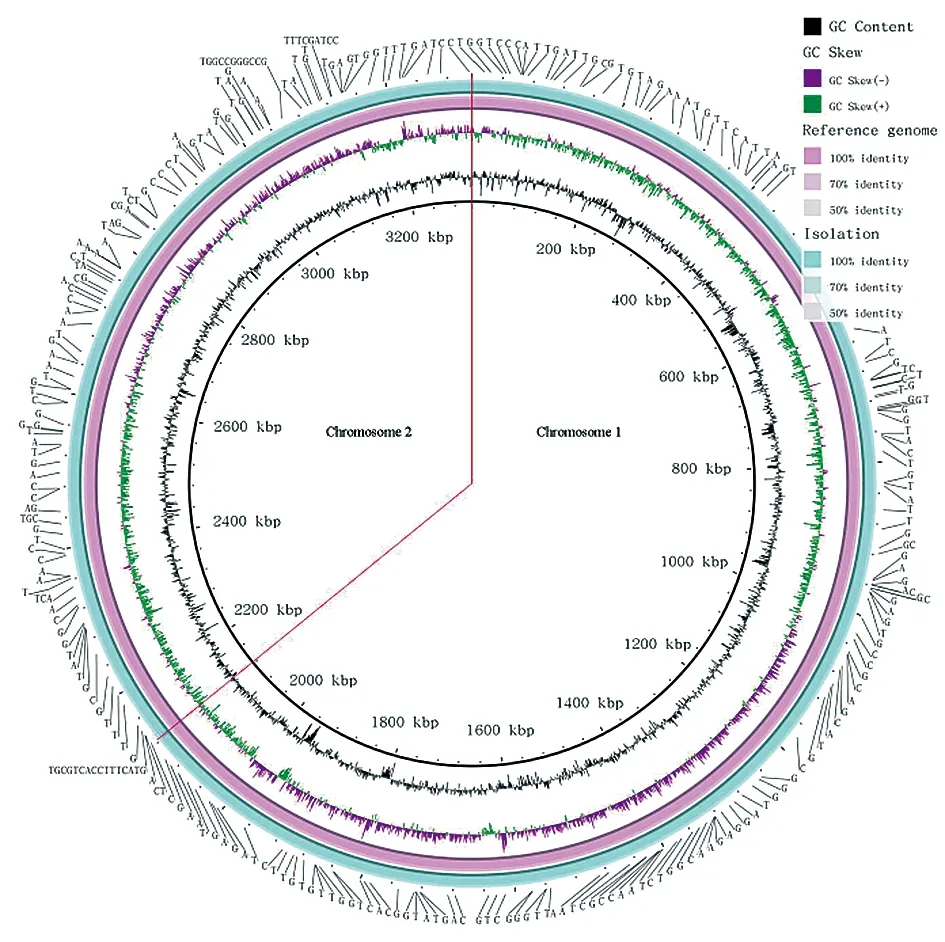
图4 羊种布鲁氏菌粗糙型变异菌株SNP及InDel在基因组中的分布图Fig.4 Distribution of the SNP and InDel of the rough B. melitensis strain
已知的LPS合成相关基因中,假定甘露糖转移酶(wboA,wboB),甘露糖合成酶(manBo-Ag,manCo-Ag),ABC转运系统蛋白(wzt),十一异戊烯-糖基转移酶(wbkF),异构酶/脱水酶(wbkD)和葡萄糖磷酸变位酶(pgm)基因均在宁夏分离株中均出现错义突变,导致编码氨基酸出现变异。LPS合成受阻后,最终导致宁夏分离株表型由光滑型变为粗糙型,见表1。
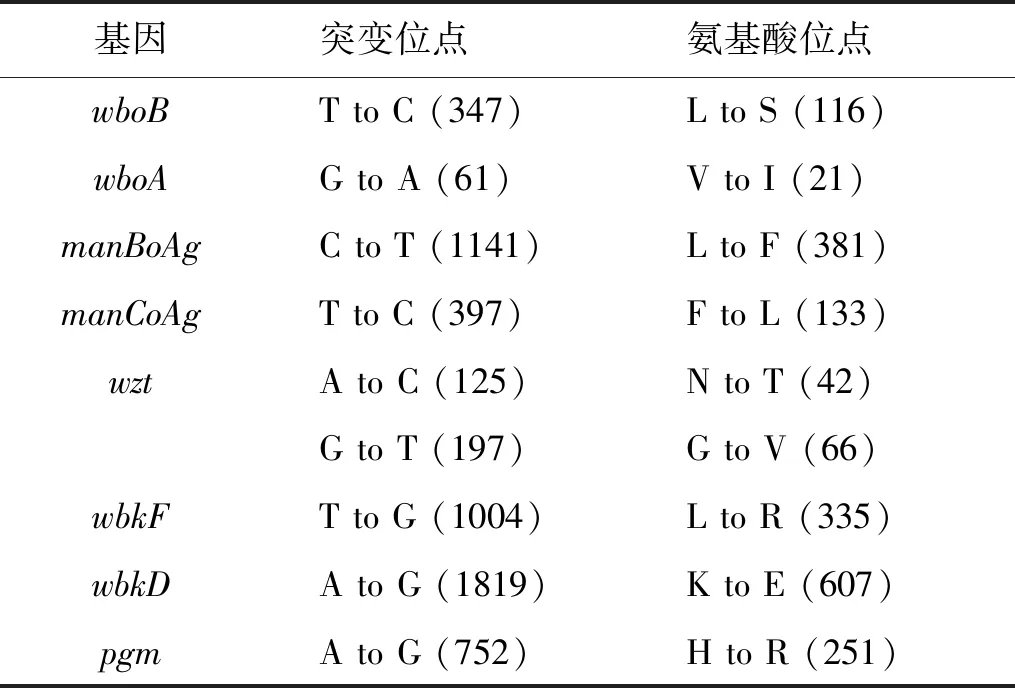
表1 已知LPS合成基因的变异统计表Tab.1 Missense variations of the LPS-related genes
3 讨 论
LPS是布鲁氏菌的重要毒力因子,对S-LPS合成过程中所需的基因进行突变、表达量改变以及调控基因突变可以导致产生结构不完整的R-LPS,使其毒力降低,可以作为弱毒活疫苗候选株。参与O抗原合成的基因主要有GDP-甘露糖脱水酶(gmd)、过骨胺合成酶(per)、甲酰基转移酶(wbkC)、甘露糖糖转移酶(wbkA、wbkE)、wbkD、wbkF和ABC转运系统蛋白(wzm)、wzt等,另有两个假定甘露糖转移酶(wboA和wboB)[19];与合成核心寡聚糖相关的基因主要有甘露糖酶(manBcore和manCcore)、甘露糖合成酶(manAo-Ag)、manBo-Ag和manCo-Ag、糖基转移酶(wadA、wadB、wadC)、pgm[20]。参与类脂A合成的基因主要有酰基-(酰基载体蛋白)UDP-N-乙酰葡糖胺-O酰基转移酶(lpxA)、UDP-3-O-酰基-N-乙酰葡糖胺二乙酰酶(LpxC)、UDP-3-O-(3羟基肉豆蔻酰基)葡糖胺N-乙酰转移酶(LpxD)、脂质-A-二糖合成酶(LpxB)、Tetraacyldisaccharide-1-P4′激酶(LpxK)、2-脱氢-3-脱氧磷酸酯酸醛缩酶(KdsA)、3-脱氧-甘露糖基磺酸酯胞苷酰转移酶(KdsB)、3-脱氧-D-甘露八油酸转移酶(KdtA)、月桂酰酰基转移酶(HtrB)[21]。自然条件下存在的布鲁氏菌的表型变异主要存在两个途径:插入段片(如IS711)插入LPS合成相关基因中(如疫苗株RB51)和LPS合成相关基因缺失(如绵羊附睾种布鲁氏菌缺失GI-2)[9],这两种表型变异机制均属于LPS合成相关基因的突变/缺失。最新的研究表明,参与LPS和成相关基因的表达量变化也能导致菌株表型的突变。羊种布鲁氏菌RM57为粗糙型菌株,与亲本菌株羊种布鲁氏菌M1981相比,参与LPS合成的基因未出现突变,但pgm基因表达水平改变,表明参与LPS合成的相关基因表达水平的变化也可能引起布鲁氏菌表型的变化[22]。
由于缺少O抗原的保护,R-LPS更容易暴露靶标,影响布鲁氏菌在细胞内的生存能力[23],在感染细胞或机体内增殖能力和持续生存时间是布鲁氏菌毒力判定的依据。这些因素导致了粗糙的布鲁氏菌的致病力降低,而粗糙型通常不会引起人类布鲁氏菌病[24]。研究表明,在没有抗体等因素参与的条件下,粗糙型布鲁氏菌侵入巨噬细胞的量要比光滑型布鲁氏菌大,但侵入细胞形成早期布氏小体(Brucella-containing vacuole,BCV)后,光滑型布鲁氏菌能够抑制BCV与溶酶体融合,最终进入内质网,在细胞内存活;而粗糙型布鲁氏菌无法逃避与溶酶体的融合,容易被细胞清除掉。粗糙型和光滑型布鲁氏菌刺激机体产生的抗体不同,粗糙型布鲁氏菌的抗体不影响血清学诊断,因此,粗糙型布鲁氏菌用于疫苗候选菌株具有较大的应用前景。目前,布鲁氏菌病得到有效控制的国家采取以下程序:选择可靠的疫苗、制定恰当的免疫方案、形成广泛的保护率、选择合适的诊断方法,持续扑杀感染动物并严格控制感染动物群向无疫病动物群运输动物。基于这些措施,部分国家也成功消灭了人布鲁氏菌病[25]。由于粗糙型布鲁氏菌毒力较光滑型低,且其刺激机体产生的抗体不影响布鲁氏菌的血清学诊断,因此,粗糙型菌株在疫苗研发中存在优势。我国布鲁氏菌病防控现状严峻,布病发病数逐年增高,且遍布全国。疫苗作为布病防控中的手段之一,需要着重筛选疫苗候选菌株,结合我国布病流行的优势菌株,才能更好更全面的用于我国布病的防控。
综上所述,与单因子R血清、三胜黄素发生凝集且能够被结晶紫染色的粗糙型变异羊种布鲁氏菌分离株,全基因组测序表明,该分离株与羊种2型菌株相似性最高。其基因组由2条染色体组成,大小为3 311 700 bp,GC含量为57.2%,含有3 379个CDS,9个rRNA,55个tRNA和4个ncRNA。与参考基因组相比,该分离株存在282个变异,其中243个SNPs,39个InDel,变异率较低。已知的LPS合成基因中,8个存在错义突变,LPS合成受阻,导致分离株表型由光滑型变为粗糙型。本研究为羊种布鲁氏菌粗糙型变异菌株的研究提供了基础数据,同时也为布鲁氏菌疫苗候选株的筛选提供新思路。
利益冲突:无
