浅谈新课标下原电池的教学思路
2020-12-07骆小科
骆小科

摘 要:原电池是高中化学中的一个重要基础理论内容之一,也是全国高考理综1卷的热点题型,解此类题型的首先要明确原电池的构成和工作原理,以及掌握电极方程式的书写。
关键词:原电池;工作原理;电极方程式
原电池一直作为高中授课的重难点,高考对此知识点的考查有选择题和非选择题。对于这一块知识,一直都让学生头痛。本文对此问题进行了简要分析,并讲解了一些经典例题,以期对化学教师在课堂授课时向同学解此类型题时提供一些帮助。
一、原电池的构成
原电池是一种通过将化学能转化成电能的装置,要产生电流,则需要电子定向移动或者离子定向移动。以下我们探究原电池的构成。
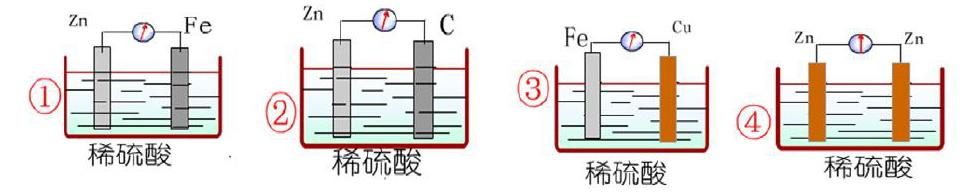
1.探究原电池的电极材料——下列哪些装置可以形成原电池
通过上图可发现①②③可以形成原电池,④不能形成原电池。故可得出构成原电池需要两个活泼性不同的电极,且一般活泼电极作负极,不活泼电极作正极。
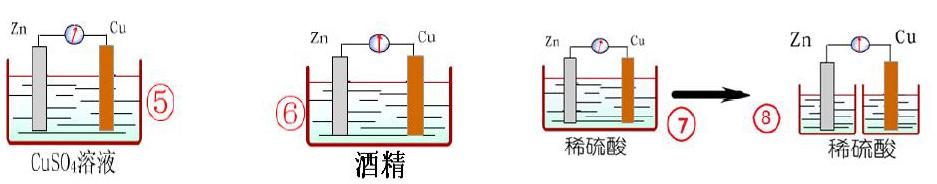
2.探究原电池中的溶液——下列哪些装置可以形成原電池
通过上图可发现⑤可以形成原电池,⑥不能形成原电池。故可得出构成原电池需要活泼性不同的两种电极同时插入电解质溶液或熔融电解质。
3.探究原电池中的线路——下列哪些装置可以形成原电池
通过上图可发现⑦可以形成原电池,⑧不能形成原电池。故可得出构成原电池需要形成闭合的回路。通过以上探究,我们可以总结出原电池构成的条件:①发生氧化还原反应,②活泼性不同的两种电极材料,③电极材料同时插入电解质溶液或熔融电解质,④形成闭合回路。
二、原电池的工作原理
有的学生看到原电池的题目就没有思路,完全不知如何下笔。要想解决此类题目,我们可以从原电池的工作原理作为切入点,通过分析原电池的正负极、电子流向、离子流向、电流流向以及电解质的类型,那么有关原电池选择题的大部分选项我们都可以迎刃而解。
例:下图所示,下列有关原电池的叙述不正确的是()
A.原电池工作时,盐桥中的阴离子移向AgNO3溶液溶液
B.负极的电极反应是Cu - 2e-== Cu2+
C.Ag片为正极,发生还原反应
D.外电路的电子流向:Cu片→ 检流计G → Ag片
答案:A。分析:通过图像,我们可以知道该装置是原电池装置,原电池中,阳离子向往正极移动,所以盐桥中的阴离子移向Cu(NO3)2溶液,故A错误;负极是Cu发生氧化反应,失去电子生成Cu2+,故B正确;根据以上分析,Ag片为正极,Ag片上发生还原反应,C正确;原电池总反应实质上是Cu与硝酸银的反应,故Cu失去电子,发生氧化反应,则Cu片为负极,Ag片为正极,电子从负极流向正极,D正确。
三、电极方程式的书写
电极方程式,它能反应出原电池的工作情况,是我们解题的关键。写出正负极的电极反应式乃至原电池的总反应,这是高中化学中一个比较复杂的问题。
1.书写电极反应式的基本原理
负极反应式:失电子,化合价升高,发生氧化反应
正极反应式:得电子,化合价降低,发生还原反应
总反应式= 正极反应式 + 负极反应式
2.书写电极反应式的方法
(1)先确定原电池的正、负极,列出正、负极上的反应物和生成物,并标出得失电子数目。(2)根据电解质溶液,给电极反应式配上相应的离子或者物质。若溶液为中性,通过物料守恒,观察反应式是否需要写H2O。若溶液为酸性,通过电荷和物料守恒,观察反应式是否需要写上H+和H2O-。若溶液为碱性,通过电荷和物料守恒,观察反应式是否需要写上OH-和H2O。
(3)将正、负极电极反应式的得失电子数目配上系数,使得失电子数目相同。然后通过将正负极的电极反应式相加,则可以得到原电池的总反应式。也可以先写出较易的电极反应式,在已知原电池的总反应的基础上,通过电子守恒,用原电池的总反应式减去较易写出的电极反应式,则可得到较难写出的电极反应式。
对于原电池这类型的题目,学生解题时不应逃避它。只要掌握原电池的构成和工作原理,层层分析,找出正负极,然后再结合书写电极反应式的步骤,即可书写出相应的电极反应式。
参考文献:
[1]2018年全国高考化学考试大纲.
[2]王朝银.2019化学步步高大一轮复习讲义.
[3]张俊杰.云南省洱源县第一中学.原电池中电极反应式的书写.
