菊米提取物对糖尿病视网膜病变大鼠CTGF表达的影响
2020-12-07陈韶奇张志梅卿莉萍刘欢漾龙昱
陈韶奇 张志梅 卿莉萍 刘欢漾 龙昱

摘 要:為探讨菊米提取物对糖尿病视网膜病变大鼠CTGF表达的影响。将雄性SD大鼠40只随机分为3个试验组和对照组,每组10只。实验组应用链脲佐菌素注射建立糖尿病视网膜病变大鼠模型,再随机分为A组糖尿病无治疗组、B组菊米提取物给药组、C组羟苯磺酸钙给药组。正常对照组为D组,注射同等剂量枸橼酸盐溶液。造模后1周,B、C组大鼠每天分别给予菊米提取物、羟苯磺酸钙经口灌胃治疗,A、D组大鼠每天给予等量生理盐水灌胃;第4,8,12周时分别监测大鼠体重和血糖;12周后,处死大鼠,摘取眼球,剥离其视网膜组织做石蜡切片并HE染色;采用酶联免疫吸附法检测视网膜CTGF的表达。结果表明菊米提取物一定程度上可以降低DR大鼠模型的血糖水平和控制其体重,减少视网膜神经节细胞的溶解和细胞水肿,缓解视网膜内颗粒层厚度减少的情况,降低DR大鼠CTGF浓度水平。菊米提取物可以调节DR大鼠模型血糖水平和控制其体重,改善大鼠视网膜变薄状态,一定程度上减少DR大鼠视网膜组织损伤程度,抑制DR大鼠CTGF表达,对延缓糖尿病大鼠视网膜微血管纤维化的进程有一定抑制作用。
关键词:菊米提取物;糖尿病视网膜病变;CTGF
中图分类号:R285; R-332 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.09.005
Abstract: To investigate the effect of Jumi extraction on the expression of CTGF in diabetic retinopathy rats,forty males SD rats were randomly divided into three experimental group and a control group,ten rats in each group. The experimental group application chain urea with cephalosporins injection to establish the rat model with diabetic retinopathy, and then randomly divided into a diabetes group(group A), a chrysanthemum extract group (group B), and a calcium dobesilate group (group C).The control group was named group D, injected with the same dose of citrate solution. After modeling for 1 wk, the rats in group B and C were given Jumi extraction and Doxium tablets by oral gavage very day, and the rats in group A and D were given the same dose of normal saline every day. At the 4th, 8th, and 12th weeks, the weight and blood glucose of the rats were monitored respectively; after 12 weeks, the rats were killed, the eyeballs were removed, and the retinal tissues were peeled off for paraffin sections and HE stained; the expression of CTGF in the retina was detected by enzyme-linked immunosorbent assay (Elisa).The results showed that Jumi extract coula reduce the blood sugar level of diabetic retinopathy rats and control its weight to a certain extent, reduce the dissolution and cell edema of retinal ganglion cells,alleviate the decrease in the thickness of the granular layer in the retina, and reduce the diabetic retinopathy rats Concentration level of CTGF / Total protein. Jumi extract could regulate the blood sugar level and control the weight of rats with diabetic retinopathy, improve the thinning of the retina of rats, reduce the degree of damage to the retinal tissue of rats with diabetic retinopathy, and inhibit the expression of CTGF. It has a certain inhibitory effect in delaying the process of retinal microvascular fibrosis in diabetic rats.
Key words: Jumi extraction; diabetic retinopathy; CTGF
作为一种严重危害人类健康的慢性全身性代谢性疾病,糖尿病 (Diabetes Mellitus,DM)常并发心血管动脉粥样硬化疾病、神经系统疾病、糖尿病足和微血管病变等,糖尿病视网膜病变(Diabetic retinopathy, DR)是DM微血管病变中最为常见和严重的眼部并发症之一[1]。近年来,由于DM趋于年轻化,其防治、研究尤显重要。
菊米为菊科草本植物,性寒味甘,经由野菊筛选、人工栽培种植,采摘菊花蕾加工而成。临床研究发现以菊花为有效成分的益气清肝活血汤对高血压性视网膜病变患者进行治疗,能缓解眼底视网膜的出血及水肿,改善视力。作为其加工产物的菊米含有丰富的挥发油、菊米内酯、多糖、黄酮等生物活性物质,能清火明目、润肺败毒、平肝降压、控血压及降血脂等[2-3],对皮肤、癌症、心血管、视网膜等临床疾病也有着良好的治疗作用,但其作用机制尚不明确。结缔组织生长因子(connective tissue growth factor, CTGF)为新发现的一种富含半胱氨酸的具有致纤维化作用的多肽蛋白,被认为是最具特异性的促纤维化因子之一,其在一定条件下能诱发肝、肺、肾纤维化及血管纤维化[4-7],参与调控视网膜纤维化过程[8],在DR患者的视网膜增殖过程中起着主导地位,并有望成为DR防治的潜在靶点[9]。虽然CTGF与DR的关系已逐渐受到关注,但关于两者的研究较少。本研究通过建立经典DM大鼠模型,观察菊米提取物对DR大鼠血糖、体质量及视网膜病变的影响,分析DR大鼠视网膜中CTGF表达水平的变化,探讨菊米提取物对DR的可能作用机制,为临床上改善和治疗DR提供研究资料。
1 材料和方法
1.1 试验动物及分组
选择二级健康SD大鼠40只,2月龄,均为雄性,体质量250±10 g,由长沙医学院动物实验中心购入,编号:SYXK湘2017-0003,SPF级环境饲养,环境温度为(22±2) ℃、相对湿度45%~65%经裂隙灯及直接检眼镜检查屈光间质清,眼底无异常者纳入实验。定量给食,昼夜自然变化。将所有大鼠适应性喂养1周,禁食水12 h后,随机分为4组:A组(糖尿病组)、B组(菊米提取物组),C组(羟苯磺酸钙组),D组(空白对照组)。
1.2 试验试剂和器材
菊米(购自浙江省嘉兴市,生产许可证批号:SC11433048301049,产品标准号:GB/T18862),柠檬酸,柠檬酸三钠,2%链脲佐菌素(streptozocin,STZ)( 购于上海伟进生物科技有限公司,批号:S0130-500MG),羥苯磺酸钙(购于贵州天安药业股份有限公司,国药准字H20010795),CTGF酶联免疫吸附测定(ELISA)试剂盒( m1002995-2,购于上海酶联生物科技有限公司),4%水合氯醛,高糖高脂饲料。荧光分光光度计,光学显微镜,低温高速离心机,血糖仪,全自动生化分析仪等。
菊米提取物制备:将菊米干燥粉碎,过60目筛,600 g菊米用10倍量纯水提取2次,提取液浓缩至120 mL,配成含生药量5 g·mL-1溶液备用[3]。
2%链脲佐菌素制备:称取-20 ℃保存的100 mg STZ,迅速加入配好的5 mL、0.1 mol·L-1柠檬酸缓冲液(称取柠檬酸1.082 g、柠檬酸三钠1.426 g,倒入100 mL烧杯,加入90 mL H2O,搅拌溶解,调节pH值=4.5,定容至100 mL,贮于4 ℃冰箱中备用),注意避光,现用现配。
0.1 mol·L-1柠檬酸缓冲液:称取柠檬酸1.082 g、柠檬酸三钠1.426 g,倒入烧杯,加入90 mL H2O,搅拌溶解,调节pH值=4.5,定容至100 mL,贮于4 ℃冰箱中备用。
1.3 DR动物模型造建及给药
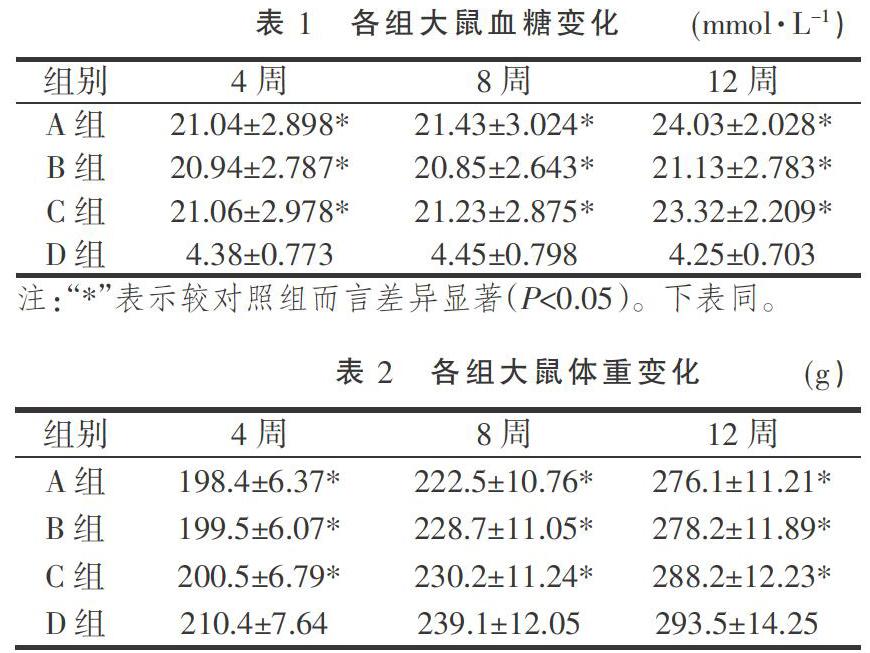
1.3.1 造模 A、B、C组均接受2%链脲佐菌素(60 mg·kg-1) 腹腔注射,同时结合高糖高脂饲养建立糖尿病模型,D组大鼠注射同样体积的枸橼酸盐溶液,正常喂养,自由饮水。72 h后在大鼠尾静脉采血,用血糖仪检测血糖浓度,凡空腹血糖浓度≥16.7 mmol·L-1,尿糖>+++,尿量及饮水量均明显增多者视为造模成功[10]。每隔2周测1次血糖及体质量(在试验进程中,当大鼠的血糖>28 mmol·L-1时,用精蛋白重组人胰岛素注射液3-4U皮下注射,以降低死亡率)。
1.3.2 给药 造模1周后,A组和D组给予1 mL 0.9%生理盐水灌胃、B组和C组分别以同等剂量的菊米提取物、羟苯磺酸钙灌胃;均为1天1次,灌胃12周。给药4周、8周和12周后分别测定各组大鼠体重,尾静脉采血,测定血糖浓度。
1.4 组织学观察
给药12周后的大鼠腹腔注射4%水合氯醛0.5 mL·(100 g)-1,麻醉后,快速摘除大鼠双侧眼球,于显微镜下剥离视网膜,左眼球视网膜制成匀浆待用;右眼球视网膜固定后进行石蜡包埋、切片、脱蜡、苏木素伊红(HE)染色、脱水、透明。
每只右眼选择4张切片,每张切片随机选取视网膜3个视野,4张切片测量平均值作为1个样本。采用计算机图像分析系统观察视网膜组织结构变化,注意观察视网膜神经节细胞变化,并通过Image J软件测量视网膜内颗粒层厚度,以此判断DM大鼠视网膜损伤情况。
1.5 酶联免疫吸附法检测视网膜CTGF的表达
取视网膜组织匀浆,采用双抗体夹心ABC-ELISA法,按照ELISA试剂盒操作步骤,测定不同浓度CTGF标准品溶液的OD值,绘制标准曲线,得线性方程回归y=0.000 6x + 0.0736,R2=0.998 5,再测定样本的OD值,依据回归方程计算样本浓度,计算各组大鼠视网膜内CTGF的浓度,并测出各组CTGF/Total protein比值变化。
1.6 统计学处理
采用SPSS17.0统计软件对实验数据进行处理分析,计量资料以均数±标准差(x±s)表示,计量资料进行正态性检验后进行方差分析,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 SD大鼠临床表征观察
试验结束时,D组(空白对照组)大鼠全部存活, 一般情况良好,摄食饮水正常,精神状况好,体质量平稳增长,二便正常,无死亡;A组有1只大鼠自尾静脉采血后,断尾处伤口红肿溃烂,于造模后第38天死亡;有一只大鼠造模9周后眼底开始变浑浊,到取材之日眼球可见白色浑浊物;剩余大鼠较其他组明显消瘦,精神萎靡,反应迟钝,毛色枯槁,尾部紫红,有数个大鼠头颈部皮肉分离;B、C组的大鼠与D组比较,摄食饮水量多,体质量稍有减轻,精神状况较A组表现好。
2.2 血糖和体质量变化
给药4周、8周和12周后分别测定4组大鼠血糖、体质量,具体结果见表1、表2。 4、8、12周时,A、B、C三组大鼠血糖水平均明显高于D组,比较差异极显著(P< 0.05);同时A、B、C三组大鼠的体质量均较D组有所降低(P<0.05)。且B组大鼠体质量均较A,C组有所降低(P<0.05)。
2.3 组织学观察
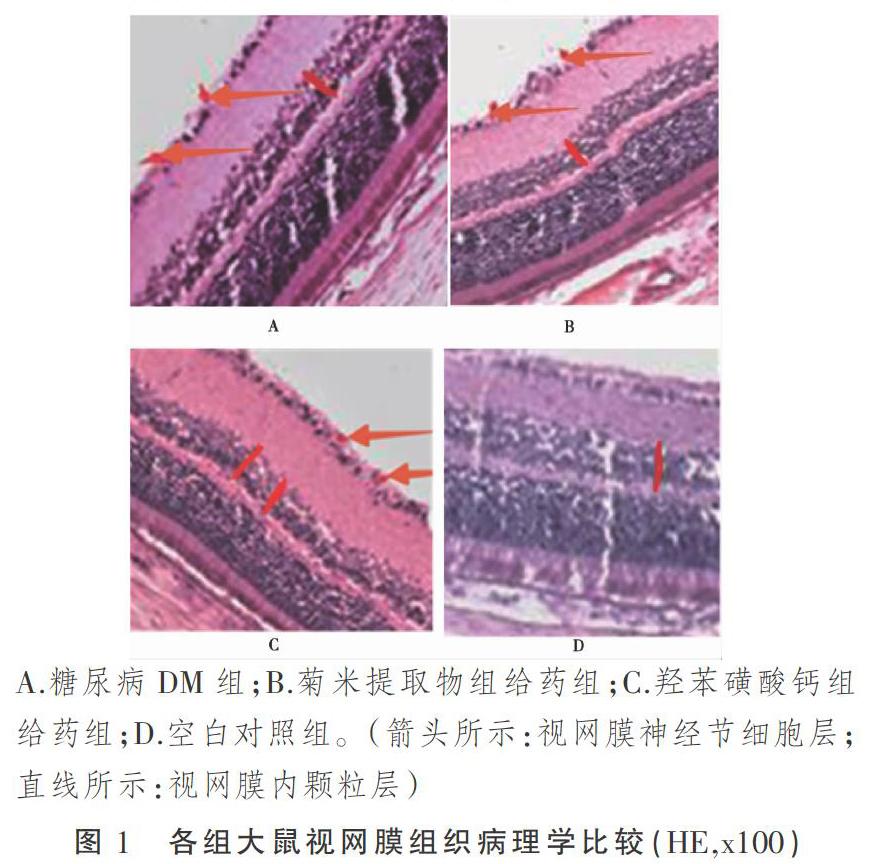
HE染色后,光镜下对照组D组大鼠视网膜表面光滑,组织形态未见明显异常,各层细胞排列规则,结构清晰,细胞核染色清晰(见图1-D);A组大鼠视网膜组织各层排列相对有序,视网膜神经节细胞层发现少许细胞溶解,视网膜内界膜略肿胀,表面不平、增厚,可见细胞水肿(见图1-A);B、C组大鼠视网膜各层组织结构较A组基本完整,视网膜神经节细胞层未见明显细胞溶解,少许细胞水肿(见图1-B、图1-C),有统计学意义(P<0.05),而B、C两组对比无显著差异,无统计学意义(P>0.05)。
Image J软件厚度测定显示,A、B、C、D四组视网膜内颗粒层厚度分别为26.221±2.813 μm、30.082±1.007 μm、29.842±1.114 μm、31.893±1.239 μm。四者相比较,差异有统计学意义(P<0.001)。A、B、C组视网膜内颗粒层厚度较D组下降,差异有统计学意义(P<0.01)。B、C组视网膜内颗粒层厚度较A组略增加,差异有统计学意义(P<0.05),而B、C两组间对比,结果无统计学意义(P>0.05)。
2.4 各组DR大鼠视网膜CTGF的表达比较
造模12周后,A、B、C三组大鼠视网膜组织中CTGF的表达水平均高于D组。与D组大鼠比较,A组大鼠视网膜CTGF水平明显增高,差异有显著统计学意义(P<0.001);与A组大鼠比较,B组大鼠视网膜CTGF显著降低,差异有显著统计学意义(P<0.001),C组CTGF水平低于A组,有统计学意义;C组CTGF水平较B组稍高,但两组对比无显著差异(P>0.001),提示DR模型大鼠视网膜组织中CTGF表达与病情成正相关,菊米提取物可显著减少视网膜组织中CTGF的表达(P<0.001),结果见表3、图2。
3 结论与讨论
中医学认为DR属消渴目病范畴,病机为“燥热灼伤目中血络”导致视网膜出血、渗出等一系列炎症病变,因此治法以活血化瘀为主, 兼疏肝理气、益气养阴、滋补肝肾等原则[11-12]。而西医则以控制血糖或玻璃体腔注射药物治疗为主,有的可进行激光手术,但属于有创性介入,易带来视力下降、视网膜水肿以及视野损害等问题,影响DR患者生活质量和预后。
菊米提取物具有清火明目、平肝降压、降低血脂等作用,但其作用机制尚未有明确报道,可能与含有菊米内酯、黄酮甙等活性成分有一定的关系[2-3,13]。本實验结果发现菊米提取物组大鼠的体质量、血糖等身体机能好于糖尿病组,与羟苯磺酸钙组大鼠有一定相似性,提示菊米提取物在DR大鼠的血糖调节及体重控制上有一定的作用。CTGF作为一种致纤维化因子,在DR患者的视网膜增殖过程中起着主导地位,其通过诱导毛细血管基底层增厚、周细胞丢失,导致后期新生血管,大量炎性介质释放,从而使血-视网膜屏障功能破坏,纤维组织增生,形成纤维血管膜,最后发展到增殖性糖尿病视网膜病变阶段[14],导致视力下降甚至失盲。已有研究发现DM大鼠视网膜CTGF的表达在8周时就显著高于正常大鼠视网膜[15];CTGF基因敲除的小鼠,视网膜毛细血管周细胞丢失、基底层增厚得到有效控制[16];而DR患者CTGF的表达也显著高于非糖尿病患者[17],这些都表明CTGF的升高与DR血管增生程度呈现正比关系。本研究的结果显示,菊米提取物组大鼠12周时视网膜神经细胞层的组织完整性好于糖尿病组,且视网膜CTGF表达水平比糖尿病组大鼠水平低,说明菊米提取物组大鼠血管增生程度有所下降,菊米提取物对早期DM大鼠视网膜组织结构具有一定的保护作用。因此,如果在糖尿病视网膜病变早期开始进行菊米提取物干预,一定程度上可延缓大鼠糖尿病进程及微血管病变,减轻DR大鼠的视网膜纤维化状态,保护视网膜组织的损伤。此外,本研究结果也发现菊米提取物组与羟苯磺酸钙组的大鼠在视网膜细胞完整性及视网膜CTGF浓度水平方面相差不大,说明菊米提取物与羟苯磺酸钙在保护视网膜组织的作用上存在药物平行性,这可为菊米在临床上治疗糖尿病视网膜病变患者时进行联合用药提供一定的参考。
由于菊米含有多种生物活性成分,加之样本数量有限、试验动物的生物性多样等因素,后续需要在菊米相关有效成分的作用机制上进行深入探讨,并可通过直接眼底镜检查及视网膜神经节细胞凋亡情况等方面观察在药物干预下DR的病情进展。
参考文献:
[1]MANDAL L K, CHOUDHURI S, DUTTA D, et al. Oxidative stress-associated neuroretinal dysfunction and nitrosative stress in diabetic retinopathy[J].Can J Diabetes, 2013,37(6): 401-407.
[2]赵永旺, 刘峥嵘, 秦裕辉. 微血管周细胞与糖尿病视网膜病变中西医研究进展[J]. 湖南中医药大学学报, 2019(2): 277-283.
[3]李玲, 金李峰. 菊米提取物对高脂血症模型小鼠降血脂作用研究[J]. 浙江中西医结合志, 2017(4): 332-333.
[4]YANG Z Z, SUN Z R, LIU H M, et al. Connective tissue growth factor stimulates the proliferatinn, migration and differentiation of lung fibroblasts during paraquat-induced pulmonary fibrosis[J]. Mol Med Rep, 2015, 12(1): 1091-1097.
[5]PI Liya, ROBINSON, PAULETTE M, et al. Connective tissue growth factor and integrin alpha v beta 6: a new pair of regulators critical for ductular reaction and biliary fibrosis in mice[J]. Hepatology: official journal of the American association for the study of liver diseases, 2015, 61(2): 678-691.
[6]LU W, LIU S H, ZHAO Z M, et al. The effect of connective tissue growth factor on renal fibrosis and podocyte injury in hypertensive rats[J]. Renal failure, 2014, 36(9):1420-1427.
[7]曾少杰, 謝怀林, 何小娟. 增生性糖尿病视网膜病变与VEGF和CTGF水平的相关性及治疗启示[J]. 临床眼科杂志, 2018(4): 296-300.
[8]ZHANG Q, QI Y, CHEN L, et al. The relationship between anti-vascular endothelial growth factor and fibrosis in proliferative retinopathy:clinical and laboratory evidence[J]. Br J Ophthalmol, 2016, 100(10): 1443-1450.
[9]MORALES M G, ACUN M J, CABRERA D, et al. The pro-fibrotic connective tissue growth factor (CTGF/CCN2) correlates with the number of necrotic-regenerative foci in dystrophic muscle[J]. J Cell Commun Signal, 2017, 12 (1): 413-421.
[10]宋晗, 滕岩, 马秋莎. 糖尿病视网膜病变大鼠模型的实验研究[J]. 医学研究杂志, 2014, 43(4): 134-136.
[11]刘芳, 杜郁华, 陈雁. 中医适宜技术治疗糖尿病视网膜病变100例的临床观察[J]. 中国实用医药, 2019, 14(2): 118-119.
[12]马英琦, 黄延芹, 徐云生. 中医治疗非增殖期糖尿病视网膜病变研究进展[J]. 河北中医, 2019, 41(5): 779-782.
[13]应海航, 徐高. 益气清肝活血汤治疗高血压性视网膜病变40例临床观察[J]. 浙江中医杂志, 2015, 50 (3): 192.
[14]马腾. 结缔组织生长因子在“血管—纤维化开关”机制中的转录组学分析[D]. 天津: 天津医科大学, 2018.
[15]曾勍. 双靶点干预对糖尿病大鼠视网膜VEGF和CTGF表达的影响[D]. 天津: 天津医科大学, 2013.
[16]VAN GEEST R J, LEEUWIS J W, DENDOVEN A, et al. Connective tissue growth factor is involved in structural retinal vascular changes in long-term experimental diabetes[J]. Journal of Histochemistry&Cytochemistry, 2014, 62(2): 109-118.
[17]侯雨, 于扬, 杨晓辉, 等. 结缔组织生长因子基因启动子甲基化状态与糖尿病视网膜病变关系的研究[J].蚌埠医学院学报, 2020, 45(1): 67-70.
