石油降解菌SY-3的筛选及对浮选油泥中的烷烃降解动力学研究
2020-12-07张小梅邢献杰姜巧于鑫娅彭明国张文艺
张小梅 邢献杰 姜巧 于鑫娅 彭明国 张文艺

摘 要:通过对大庆油田某采油场地的含油污泥进行富集、筛选,分离出1株高效石油降解菌,命名为SY-3,并对其进行16S rDNA分子鉴定。以中石化金陵公司浮选含油污泥为处理对象,探究pH值、NaCl含量、接菌量等对浮选油泥中的石油烃降解效果的影响,构建了SY-3菌生长动力学与浮选油泥中的石油烃降解动力学本构模型。结果表明:菌株属于副球菌属(Paracoccus SP.),在25~30 ℃接菌量为3%的基础上,相较于NaCl含量,pH值对SY-3降解石油烃影响更大,当调节pH值为7、NaCl含量为1%时,SY-3在以石油烃提取液为唯一碳源的无机盐培养基中的生长模式符合Logistic生长模型,其中菌株生长环境承载量K为1.206,菌株生長平均速率r为0.12,无量纲参数a为4.78。SY-3可在30 d内将石油烃含量为5 g·kg-1降解至0.9 g·kg-1,降解了4.1 g·kg-1,降解率达82%。SY-3对短链烷烃(C10~C28)的降解率为88%、半衰期为9.9 d,对长链烷烃(C30~C40)的降解率为72%、半衰期为17.3 d,且对短链烷烃(C10~C28)降解速率是长链烷烃(C30~C40)的1.75倍。相较于长链烷烃,短链烷烃更易被SY-3菌生物降解。当石油烃初始含量小于34.47 g·kg-1时,其降解动力学符合生物处理经典方程Monod方程的线性简化形式,半饱和常数Ks=1.24 g·kg-1,最大反应速率Vmax=3.24 g·(kg·d)-1。
关键词:浮选油泥;石油降解菌SY-3;16S rDNA;石油烃;动力学
中图分类号:X74 文献标识码:A DOI编码:10.3969/j.issn.1006-6500.2020.09.003
Abstract: Based on the enrichment and screening of oily sludge from an oil production site in Daqing oilfield, a highly efficient petroleum degrading bacterium named SY-3 was isolated and identified by 16S rDNA molecular analysis. The flotation of oily sludge from Sinopec Jinling Company was taken as the treatment object. The effects of pH, NaCl content and inoculum amount on the degradation efficiency of petroleum hydrocarbons in flotation sludge were investigated. Constitutive models of SY-3 bacteria growth kinetics and petroleum hydrocarbon degradation kinetics in flotation sludge were established. The results showed that the strain belongs to Paracoccus marcusii. On the basis of 3% inoculation amount at 25~30 ℃, pH had greater influence on degradation of petroleum hydrocarbons by SY-3 than content of NaCl. When pH was adjusted to 7 and content of NaCl was 1%, the growth mode of SY-3 conformed to Logistic growth model in inorganic salt medium with petroleum hydrocarbon extract as the sole carbon source. The K was 1.206, the r was 0.12, and the dimensionless parameter a was 4.78. The petroleum hydrocarbons were degraded by SY-3 from 5 g·kg-1 to 0.9 g·kg-1 within 30 days, 4.1 g·kg-1 of petroleum hydrocarbons being decomposed, and the degradation rate reached 82%. The degradation rate and half-life of short-chain alkanes(C10~C28) by SY-3 was 88% and 9.9 days respectively, while it was 72% and 17.3 d days for long-chain alkanes(C30~C40). In addition, the degradation rate of short-chain alkanes(C10~C28) was 1.75 times that of long-chain alkanes(C30~C40) by SY-3. Compared with long-chain alkanes, short-chain alkanes were more easily biodegraded by SY-3 bacteria. When the initial content of petroleum hydrocarbon was less than 34.47 g·kg-1, its degradation kinetics conformed to the linear simplified form of Monod equation, a classical biological treatment equation. The semi-saturation constant Ks was 1.24 g·kg-1 and the maximum reaction rate vmax was 3.24 g·(kg·d)-1.
Key words: flotation sludge; petroleum degrading bacteria SY-3; 16S rDNA; petroleum hydrocarbon; kinetics
石油开采、炼制、运输、使用和储存的过程中会产生大量的含油污泥[1],尤其是石油炼制领域过程中所产生的浮选含油污泥,对环境造成了严重的污染。因此,如何安全处置浮选含油污泥(简称浮选油泥)一直是石油炼制领域的一大难题。近年来,微生物降解因其安全高效符合生态处置理念,成为降解浮选油泥中石油烃的主要途径之一[2,5-7]。张恒等[8]报道了从某油井的土壤样品中筛选出3株高效石油降解菌,在最适生长条件下对石油烃的降解率最高可达52.20%;冯晋阳等[9]分离得到的假单胞菌对石油具有良好的降解能力,且降解反应为一级动力学。辛蕴甜和赵晓祥[10]分离筛选出石油降解菌H-1,其降解动力学符合Monod的线性简化模式。Pi等[11]证明了微生物表面活性剂生产菌M-25可有效降解4种原油,而Kimura等[12]则侧重于微生物对原油各组分尤其是对芳烃物质的降解机制研究。
综上石油烃生物降解研究的国内外报道虽然较多,但大多以石油烃污染较轻的常规含油污泥降解为主,针对石油烃污染较严重的浮选油泥微生物降解鲜有报道。且已有报道烷烃的降解菌主要有红球菌、假单胞菌等[13],关于马氏副球菌(Paracoccus marcusii)降解烷烃的研究鲜有报道。基于此,本研究从大庆油田某采油场含油污泥中富集、筛选、分离石油降解菌,应用于中石化南京金陵公司浮选油泥,考察了pH值、NaCl含量、接菌量等对浮选油泥中石油烃降解效果的影响,为石油降解菌(SY-3)安全处置浮选油泥提供基础认识和理论支持。
1 材料和方法
1.1 样品和培养基
菌种来源泥样来自大庆油田某采油井的含油污泥。
试验用浮选油泥取自中石化南京金陵公司炼油车间,浮选油泥的石油烃初始含量为5 g·kg-1,含水率为23.92%,灰分含量为40.19%,挥发性固体含量为35.89%,pH值为7.76。
标液:16种偶数碳正构烷烃混标(C10-C40)Alkane Mix 16 1 000 mg·L-1 1 mL,购买自东莞市迪卡实验科技有限公司。
微量元素:维生素C,5 g;MnSO4,10 mg;K2HPO4,2 g;NH4Cl, 5 g;FeSO4,4 g;无菌水,1 000 mL。其中维C高温灭菌会氧化失活,故配制母液过滤灭菌,其他利用高压蒸汽灭菌锅,121 ℃灭菌20 min。
无机盐&石油烃培养基:MgSO4,0.5 g;KH2PO4,0.5 g;NaCl,3 g;CaCl2,0.1 g;微量元素,1 mL;FeSO4·7H2O,0.2 g;60%的乳酸钠溶液,6 mL;添加本课题组从试验用浮选油泥提取的石油烃提取液作为碳源、能源;无菌水,1 000 mL;调节pH值至7.5~8.0。
LB培养基:参照文献[14]。
1.2 试验设备与分析仪器
立式压力蒸汽灭菌器LDZX-50KBS(上海申安医疗器械厂)、数显光照培养箱GZP-250(上海精宏实验设备有限公司)、净化工作台SW-CJ-1F(上海贺德实验设备厂)、恒温振荡培养箱HZQ-X100A(上海一恒科学仪器有限公司)、倒置显微镜TL4(日本奥林巴斯)、紫外分光光度计UV-1800(日本岛津)、红外测油仪IR-200A(山东高环优科精密仪器有限公司)、气相色谱仪7820A(上海安捷伦科技有限公司)等。
1.3 石油降解菌的筛选分离
称取10 g大庆某采场含油污泥样品(菌种来源泥样),加至已灭菌250 mL的LB培养基中,石油烃初始含量约为5 g·kg-1(采用红外光度法测定)。再将LB培养基置于温度为25~30 ℃,转速为134 r·min-1下进行富集培养,培养周期为4~7 d。培养一个周期后,从富集培养液中吸取5%的菌液,转接入新鲜的LB培养基中,相同培养条件下在恒温振荡培养箱培养一周,连续驯化5次。吸取0.5 mL的培养液涂布于牛肉膏蛋白胨琼脂固体培养基上,并在30 ℃的光照恒温培养箱中培养2 d,选择代表性较好、形态特征一致的单菌落进行5次以上的分离纯化培养,得到6株单菌落,分别命名为SY-1~SY-6。
将分离纯化得到的6株单菌落分别接入以石油烃为唯一碳源的无机盐&石油烃培养基中,恒温振荡培养,通过红外测油法[15-16]每隔2 d观察并监测石油烃降解情况,以方便筛选到降解效果最佳的菌株。参照《常见细菌系统鉴定手册》(2001年)及《伯杰氏系统细菌学手册》(第二版,2001年)观察该菌株的培养性状和菌体形态,并进行生理生化试验。
1.4 基于16S rDNA序列的分子鉴定
采用上海生工Ezup柱式细菌基因组DNA提取试剂盒来提取菌株SY-3的DNA基因组。采用27F和1492R细菌通用引物进行16S rDNA PCR扩增,PCR产物经1%琼脂糖凝胶电泳检查后,委托上海生工生物工程技术服务有限公司完成后续的纯化及测序。
将实验测得的16S rDNA序列与GenBank数据序列进行Blast比对,选取与菌株SY-3序列相似性高的序列,利用MEGA 5.1軟件中Glustalw程序,进行多重序列匹配的排列(Multiple alignments)分析,将形成的多重序列匹配排列阵采用邻近法(neighbor-joining)来构建系统发育树,最后采用自举检验法(Bootstrap method)评估系统发育树置信度,重复1 000次以鉴定SY-3菌株的分类归属。
1.5 气相色谱条件
气相色谱条件为:石英毛细管色谱柱(HP-5,30 m×0.25 mm×1.4 μm);进样方式:不分流进样;进样口温度:300 ℃;柱温:50~320 ℃;气体流量:高纯氮气(1.5 mL·min-1),氢气(30 mL·min-1),空气(300 mL·min-1);检测器温度:325 ℃;进样量:1 μL。
1.6 石油降解菌SY-3对石油烃的降解效果
由前期研究结果知,菌株SY-3降解试验的最适接菌量为3%,最适pH值为7,最适NaCl含量为1%。在上述条件下,制备石油烃初始含量为5 g·kg-1的无机盐&石油烃培养基,再将石油降解菌SY-3在无菌环境下接入培养基中,使用25~30 ℃、100 r·min-1恒温振荡培养箱培养30 d,相同降解条件下设2组平行实验和1组不接菌的空白实验。每隔2 h取样测定菌株细胞浓度,以600 nm波长下的吸光度值OD600表示。每隔2 d取样经无水硫酸钠、正己烷、丙酮等提取、净化、浓缩、定容后,并参考《油田含油污泥综合利用污染控制标准DB23/T.1413-2010》中附录A《油田含油污泥石油类的测定红外光度法》计算石油烃含量,参考《HJ 1021-2019 土壤和沉积物石油烃(C10~C40)的测定气相色谱法》,在2.3.3的气相色谱条件下用带氢火焰离子化检测器(FID)的气相色谱仪检测石油烃(C10~C40)含量,根据保留时间窗定性,外标法定量,计算其降解率。
2 结果与分析
2.1 菌落形态
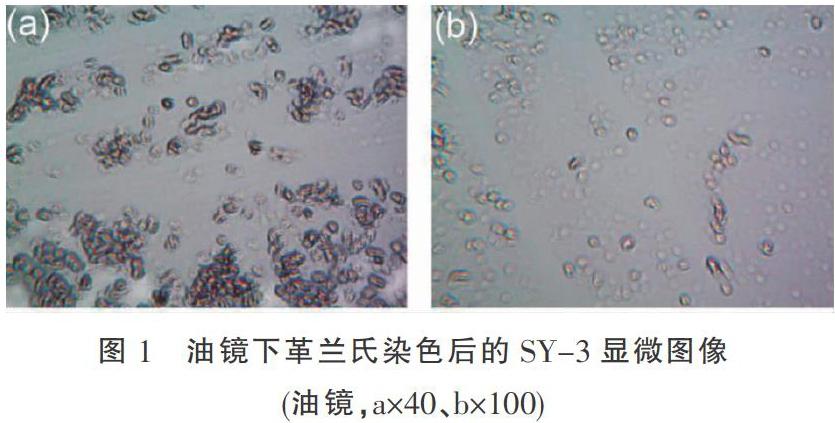
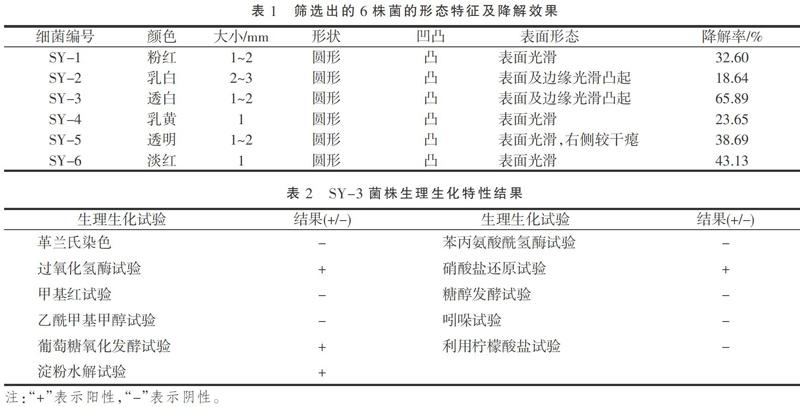
6株菌的形态特征及对其石油烃降解效果如表1所示。由表1可知,筛选出的6株菌的大小相近,颜色各不相同,形状均为圆形,表面大多较光滑,对石油烃的降解率也各不相同、相差较大。SY-1、SY-2、SY-3、SY-4、SY-5、SY-6对石油烃的降解率分别为32.60%,18.64%,65.89%,23.65%,38.69%,43.13%,其中SY-3菌株对石油烃降解效果最好。因此,本研究选取降解效果最佳的SY-3作为试验研究对象。此外,通过表征SY-3的生理生化性质,来进一步探究SY-3的特性。SY-3菌株常规的生理生化特性结果如表2所示,由表2可知SY-3菌株的生理生化特性各不相同,但多表现为阴性。从油镜下革兰氏染色后的SY-3显微图像可以看出(图1),SY-3革兰氏呈红色,属于阴性菌,稍透明,菌落呈1~2 mm圆形,表面及边缘光滑凸起。
2.2 SY-3菌16S rDNA序列分析
通过16S rDNA序列分析鉴定石油烃降解菌SY-3的菌属,将所测得的SY-3菌株DNA与GenBank数据库已有序列进行系统发育树构建如图2所示,结果表明SY-3菌株与Paracoccus marcusii、Paracoccus sp.等多种菌相似度可达98%以上。此外,SY-3与Paracoccus sp.(副球菌属)经MEGA7匹配相似性达到99.55%,处于同一展枝,自展值达到了96%。因此,初步鉴定筛选出的SY-3菌株是副球菌(Paracoccus sp.)。
2.3 石油降解菌SY-3对浮选油泥中石油烃的降解特性
石油烃降解菌SY-3对炼化油泥中石油烃的降解曲线如图3所示,其中t为反应时间,Ct是t时刻的石油烃含量,C0为油泥初始石油烴含量。由图3可知,未添加菌剂的无机盐&石油烃培养基中30 d内仅12%的石油烃被分解,而当添加3%的SY-3菌液时,石油烃的降解速率加快,30 d内SY-3对石油烃的降解率可达69%,这表明SY-3对石油烃有一定的降解能力(该条件下的pH值为6,NaCl含量为0.5%)。为了进一步提高SY-3对石油烃的降解效率,在接菌量为3%的基础上,通过改变pH值和NaCl含量探究其对SY-3降解石油烃的影响。当调节pH值为7时,SY-3对石油烃的降解率由69%增加至77%(该条件下,NaCl的含量是0.5%),而此基础上控制NaCl含量为1%时,SY-3对石油烃降解率仅增加了5%,此时降解率为82%,培养基石油烃残留量为0.9 g·kg-1,此石油烃残留量低于建设用地土壤污染风险管控标准中第二类用地总石油烃筛选值4.5 g·kg-1。这表明SY-3对石油烃具有良好的降解效果,且相较于NaCl含量,pH值对SY-3降解石油烃影响更大,这与已有的研究[10]结论相符合。
2.4 SY-3对石油烃中不同组分的降解效果解析及其一级动力学研究
为了进一步明确SY-3对于石油烃的降解特性,通过气相色谱仪,并辅以1 000 mg·L-1 的16种偶数碳正构烷烃混标(C10-C40),在菌株最适降解条件下(接菌量为3%、pH值为7、NaCl含量为1%)对降解后的炼化油泥中不同碳链长度的烷烃进行定性、定量。SY-3对不同碳链长度烷烃的降解效果(A)和降解速率(B)如图4所示。由图4A可知,30 d内未接种菌剂的无机盐&石油烃培养基中仅17%烷烃能被有效分解,当添加SY-3菌液时,不同碳链长度的烷烃C10~C28、C30~C40的降解过程急剧加速,30 d内,SY-3对烷烃(C10~C40)的降解率达82%,其中对C10~C28的降解率为88%,对C30~C40的降解率为72%。由图4B图可知,SY-3菌对不同碳链长度的烷烃C10~C28、C30~C40的降解动力学与一级动力学方程相关性良好,并由T1/2=0.693/k计算可知其半衰期分别为9.9 d,17.3 d,其中k为一级降解动力学常数。对比C10~C28、C30~C40、C10~C40的k值可知,且SY-3对C10~C28的降解速率是C30~C40降解速率的1.75倍,是C10~C40的1.4倍。这表明与C30~C40的长链烷烃相比,SY-3对于短链烷烃C10~C28分解较快,短链烷烃较长链烷烃更易被降解,分析可能是长链烷烃的毒性较高限制了其生物利用度,致使其难被生物降解[17-18]。
2.5 石油降解菌SY-3的生长动力学研究
经转速100 r·min-1、温度为25~30 ℃的摇床中培养,测得的SY-3生长曲线及其对石油烃的降解曲线如图5所示,其中S为降解体系中石油烃含量,培养基中石油烃的降解与菌株的增殖同步进行[19],菌株SY-3的最大OD600值为1.111,与其它文献报道的石油烃降解试验中的石油降解菌细胞密度[20-22]相比,本研究中SY-3菌株细胞密度较高,且菌株在生长1 d后迅速进入增长期和稳定期,对比石油烃的降解主要在菌株稳定期和衰亡期完成,说明菌株在复杂培养环境下生长良好且能够有效降解石油烃,对于降解浮选油泥中的石油烃具有一定参考价值。
本试验中,石油降解菌SY-3的微生物种群生长方式呈S型增长,因此采用Logistic模型对细菌的生长曲线进行拟合,Logistic方程如公式(4)所示:
Nt:生长时间为t时的细胞密度(OD600);t:细菌生长时间(h);r:石油降解菌SY-3生长平均速率(h-1);K:菌株生长的环境承载量(OD600),a:与K和N0相关的一个参数[23]。
基于菌株SY-3的初始细胞浓度为N0为0.010,最大细胞浓度为N50(t=50 h)为1.111,菌株SY-3的细胞浓度与培养时间的Logistic拟合曲线如图5所示。由图5可知菌株SY-3的生长情况由(2)表示,其中K= 1.296, r= 0.12,a =4.78,决定系数R2=0.951 7。
根据图5可知,Logistic S增长模型可较好的描述菌株SY-3的生长情况,理想条件下菌株SY-3可以利用浮选油泥中的石油烃作为碳源、能源促进其自身代谢,但实验室条件下SY-3不能完全利用营养等物质,因此有必要对菌株降解石油烃的过程进行分析,SY-3石油降解菌处于增长期时,其实验室条件下的细胞浓度略高于Logistic模型,石油烃的降解也主要是在SY-3菌株生长的增长期、稳定期,而随着石油烃浓度的进一步降低时,菌株逐渐进入衰亡期。这反映出SY-3降解石油烃并利用其作为碳源、能源进而促进其自身生长。
2.6 菌株SY-3增长与石油烃降解动力学模型构建
在最佳降解条件下,采用线性简化的动力学模型Monod方程式来描述菌株SY-3增长与石油烃降解动力学关系,假定石油烃的降解符合如下Monod方程式[24]:
式中:v—有机物的比降解速率,g·(kg·d)-1;
vmax—有机物底物的最大比增长速度,g·(kg·d)-1;
KS—饱和常数(也称半速率常数),其值为当v=vmax/2时的基质含量;
S—有机物底物含量,g·kg-1。
图5中SY-3对石油烃的降解曲线各点的斜率为SY-3菌株对石油烃的降解速率v,利用石油烃含量的倒数1/S和SY-3菌株对石油烃降解速率的倒数1/v关系如图6所示,在线性区间范围内采用线性简化的方法,以1/S对1/v作图,求得Monod方程中Vmax和KS的值。
由图6可知,拟合得到方程为:y= 0.382 2x- 0.309 1,R2=0.991 3。由此方程可得斜率B为0.382 2,纵截距A为0.309 1。又由纵截距A=1/vmax,计算得出vmax为3.24 d-1;由斜率B=KS/vmax,计算得出KS為1.24。所以SY-3菌株降解石油烃的速率与石油烃含量的关系为:
石油烃的初始含量S0为5 g·kg-1,拟合得出的KS为1.24,其值符合有机物的比降解速率与有机物底物含量的线性简化区间KS≤S≤10 KS的要求,假定成立,vmax越高,KS越低,表明物质越容易降解[10,25]。
不同初始含量条件下SY-3对TPH(C10~C40)降解的实际降解速率v,利用生物动力学模型Monod方程计算的降解速率v0,具体数据如下表3所示。
由表3可以看出,当石油烃含量大于34.47 g·kg-1时,实际降解速率V大于Monod方程中的vmax;当石油烃含量小于34.47 g·kg-1时,SY-3的实际降解速率与Monod方程计算结果基本吻合。这表明,石油烃含量较低时,Monod模型能够较好地模拟菌株SY-3降解石油烃的反应过程。
3 结 论
本研究通过对大庆油田某采油场地的含油污泥进行富集、筛选,分离出1株高效石油降解菌SY-3,并对其进行16S rDNA分子鉴定。以中石化金陵公司浮选油泥为处理对象,探究pH值、NaCl含量、接菌量等对浮选油泥中的石油烃降解效能的影响,构建了SY-3菌生长动力学与浮选污泥中的石油烃降解动力学的本构模型,得到如下结论。
(1)本文经培养基富集、分离纯化、筛选出的高效石油烃降解菌株SY-3,菌落呈圆形、稍透明且表面光滑。经常规生理生化试验及16S rDNA序列分析鉴定该菌革兰氏呈阴性,属于副球菌(Paracoccus sp.)。
(2)在接菌量为3%,pH值为7,NaCl含量为1%的降解体系中,相较于NaCl含量,pH值对SY-3降解石油烃影响更大。30 d内菌株对石油烃的降解率为82%,石油烃含量由5 g·kg-1降低至0.9 g·kg-1。其中对短链烷烃(C10~C28)和长链烷烃(C30~C40)的降解率分别为88%,72%,半衰期分别为9.9 d和17.3 d,且SY-3对短链烷烃(C10~C28)的降解速率是长链烷烃(C30~C40)的1.75倍。相较于长链烷烃,短链烷烃更易被SY-3菌生物降解。
(3)SY-3菌株在最适降解条件下的无机盐&石油烃培养基中的生长趋势符合Logistic模型,呈“S”型增长,相关性达0.970 2,SY-3降解石油烃并利用其作为碳源以促进自身生长。当石油烃初始含量小于34.47 g·kg-1时,其降解动力学符合Monod方程,半饱和常数Ks=1.24 g·kg-1,最大反应速率vmax=3.24 g·(kg·d)-1。
参考文献:
[1]CERQUEIRA V S, HOLLENBACH E B, MABONI F, et al. Biodegradation potential of oily sludge by pure and mixed bacterial cultures[J]. Bioresource technology, 2011(102): 11003-11010.
[2]董丁, 卢彦珍, 唐美华, 等. 一株石油烃高效降解菌的筛选及降解性能研究[J]. 南京工业大学学报, 2017, 39(3): 58-62.
[3]詹亚斌, 马立安, 陶兴玲, 等. 2株石油烃降解菌的分离鉴定[J]. 长江大学学报, 2017(18): 66-69.
[4]徐金兰, 黄廷林, 唐智新, 等. 高效石油烃降解菌的筛选及石油污染土壤生物修复特性的研究[J]. 环境科学学报, 2007, 27(4): 622-628.
[5]刘虹, 刘娜, 吕静, 等. 3种石油烃降解菌对石油烃的降解效果及其细胞表面疏水性[J]. 环境污染与防治, 2015, 37(7): 13-17.
[6]花莉, 洛晶晶, 彭香玉, 等. 产表面活性剂降解石油菌株产物性质及降解性能研究[J]. 生态环境学报, 2013(12): 1945-1950.
[7]許增德, 张建, 祝威, 等. 微生物降解油田含油污泥中烃类污染物的研究[J]. 环境科技, 2005, 18(4): 9-11.
[8]张恒, 吴鹏飞, 成娟丽, 等. 陕北地区高效石油烃降解菌的筛选及其对油污土壤的修复研究[J]. 延安大学学报, 2018, 37(3): 86-91.
[9]冯晋阳, 吴小宁. 一种假单胞菌SY5降解石油的动力学研究[J]. 西安工业大学学报, 2011, 31(4): 360-364.
[10]辛蕴甜, 赵晓祥. 石油烃降解菌的降解性能及降解动力学研究[J]. 安全与环境学报, 2013, 13(5):21-25.
[11]PI Y, CHEN B, BAO M, et al. Microbial degradation of four crude oil by biosurfactant producing strain Rhodococcus sp.[J]. Bioresource technology, 2017(232): 263-269.
[12]KIMURA N, NISHI A, GOTO M,et al. Functional analyses of a variety of chimeric dioxygenases constructed from two biphenyl dioxygenases that are similar structurally but different functionally[J]. Journal of bacteriology, 179(12): 3936-3943.
[13]BOONCHAN S, BRITZ M L, STANLEY G A. Surfactant enhanced biodegradation of high molecular weight polycyclic aromatic hydrocarbons by Stenotrophomonas maltophilia[J]. Biotechnology & Bioengineering, 1998, 59(4): 482-494.
[14]BARIN R, TALEBI M, BIRIA D, et al. Fast bioremediation of petroleum-contaminated soils by a consortium of biosurfactant/bioemulsifier producing bacteria[J]. International journal of environmental science and technology, 2014(11): 1701-1710.
[15]姜岩, 伍涛, 张贤明. 土壤中石油烃预处理及含量分析方法研究进展[J]. 土壤, 2015, 47(3): 461-465.
[16]XU R, ZHANG Z, WANG L, et al. Surfactant-enhanced biodegradation of crude oil by mixed bacterial consortium in contaminated soil[J]. Environmental science and pollution research, 2018( 25): 14437-14446.
[17]谭佳. 一株降解中长链烷烃菌株的分离鉴定及其特性研究[D].南充: 西华师范大学,2016.
[18]孙晶, 宋东辉, 刘凤路, 等. 一株烷烃降解细菌的分离鉴定及其降解特性[J]. 天津科技大学学报, 2016(5):19-24.
[19]姚力芬, 李丹, 陈丽华, 等. 石油烃降解菌的分离及在含油污泥中的应用[J]. 现代盐化工, 2015, 6: 34-38.
[20]张秀霞, 单宝来, 张剑杰, 等. 降解菌HJ-1降解石油动力学[J]. 中国石油大学学报, 2009, 33(5): 140-143.
[21]张秀霞, 王基成, 耿春香, 等. 含油污泥生物处理的烃类降解菌发酵条件优化[J]. 中国石油大学学报(自然科学版), 2008, 32(3):155-159.
[22]任丽君, 刘宪斌, 田胜艳, 等. 含油污泥中石油烃降解菌的分离及其降解特性[J]. 环境工程学报, 2015, 9(7):3538-3544.
[23]杨益民, 付必谦. 关于Logistic增长模型参数估计方法的再探讨[J]. 统计与决策, 2015(13):30-34.
[24]甄丽莎, 谷洁, 胡婷, 等. 石油烃类污染物降解动力学和微生物群落多样性分析[J]. 农业工程学报, 2015, 31(15): 231-238.
[25]PATOWARY R, PATOWARY K, KALITA M C, et al. Application of biosurfactant for enhancement of bioremediation process of crude oil contaminated soil[J]. International biodet-erioration & biodegradation, 2018(129): 50-60.
