高效溶藻菌—微杆菌菌剂制备工艺响应面分析法优化研究
2020-12-07周健飞申晓霞徐瑾郭惠娟王美娟张文艺
周健飞 申晓霞 徐瑾 郭惠娟 王美娟 张文艺


摘 要:为了弥补溶藻液体菌剂稳定性低、不易运输以及保存时间短等缺陷,利用本研究从太湖土著花锢鱼内脏中筛选出的1株编号为GHJ的具有高效溶藻的微杆菌(Microbacterium oleivorans SP.),以小麦粉作为载体,蔗糖、谷氨酸钠、脱脂乳粉、甘油作低温保护剂,采用真空冷冻干燥法制备溶藻菌GHJ干粉菌剂,借助响应面法优化不同保护剂组成条件下菌剂的制备参数,考察了各因素及其交互作用对干粉菌剂活菌率的影响,并对冷冻干燥的干粉菌剂中保护剂不同成份对菌体保护作用的机理进行分析。结果表明,该模型预测的溶藻菌GHJ干粉菌剂的活菌率最高为189.26% ,最佳复合保护剂配比为10%蔗糖∶10%甘油∶4%脱脂乳粉∶8%谷氨酸钠=1∶1∶0∶1,其机制是通过甘油维持细胞结构,蔗糖降低细胞机械损伤程度,谷氨酸钠修复受损细胞,三者共同作用实现对菌体的保护。本研究对于溶藻菌干粉菌剂制备及商品化开发有一定的理论和应用参考价值。
关键词:真空冷冻干燥; 干粉菌剂; 保护剂; 响应面; 活菌率
中图分类号:X172 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.09.002
Abstract:In order to make up the defects such as low stability, poor transportation, and short preservation time of algicidal bacteria liquid agent, a strain of Microbacterium oleivorans SP.(GHJ) with high-efficiency algicidal rate was isolated from the viscera of indigenous fish in Taihu Lake by our research group. With wheat flour as the carrier, sucrose, sodium glutamate, skim milk powder and glycerol as the protective agents, algicidal bacteria GHJ dry powder was prepared by vacuum freeze- drying method. With the aid of response suface method (RSM), the preparation parameters of different protective agents were optimized, and the effects of various factors and their interactions on the living bacteria rate of dry powder agents was investigated. Besides, the mechanism of different components of protective agents in the freeze-drying powder to protect bacteria was also analyzed. The results showed that the living bacteria rate of GHJ dry powder agent predicted by this model was 189.26%, and the best compound protective agent ratio was 10%sucrose∶10%glycerol∶4%skim milk powder∶8% sodium glutamate=1∶1∶0∶1. The mechanism was that glycerol maintained cell structure, sucrose reduced the degree of cellular mechanical damage, and sodium glutamate repaired the damaged cells. The three work together to achieve the protection of bacteria. This study has certain theoretical and practical reference value for the preparation and commercial development of algicidal dry powder agents.
Key words: vacuum freeze-drying; dry powder agent; protective agents; response surface methodology; living bacteria rate
針对太湖、巢湖等湖泊水体富营养化的问题,在原生态微生物处理体系中,加入具有高效溶藻功能的微生物,增强其对水体的控藻能力,从而达到改善水体环境质量的目的[1-4]。液体菌剂存在性能不稳定与运输不便的弊端,因此,研制合适的剂型是将试验室筛出的高效溶藻效果的溶藻菌投入市场运用的最好途径之一,但在目前看来,合适的菌剂成为富营养化水体生物处理技术发展的“瓶颈”[5-9],筛选出高效溶藻并在菌剂制备过程中保证菌株有较高存活率是当前亟待解决的问题[10-12]。
保护剂可降低菌剂制备过程中细菌细胞的损伤,保证细菌的活性,因此优化保护剂配比对干粉菌剂生物量起着至关重要的作用[10, 13]。菌剂保护剂的研究大多采用单因素试验与正交试验,忽略了不同种类保护剂之间的交互作用,进而限制了干粉菌剂生物量提高的途径,而响应面法已广泛应用于各种生物过程的优化实践[14],可利用较少的试验次数对影响因素及其交互作用进行评价,缩短优化周期,快速接近优化点,从而确定最优条件[15-16]。
本研究前期已从太湖土著花锢鱼内脏中筛选出了1株具有高效溶藻作用的微杆菌(Microbacterium oleivorans SP.),本试验以小麦粉作为载体,蔗糖、谷氨酸钠、脱脂乳粉、甘油作低温保护剂,基于Design-Expert软件使用响应面法对已经得到的各种保护剂的最优浓度进行复合,科学预测溶藻菌干粉菌剂复合保护剂的最佳配比,为开发适宜的溶藻干粉菌剂提供数据支撑。
1 材料和方法
1.1 材 料
1.1.1 菌 种 试验所用微杆菌(Microbacterium oleivorans SP.)是前期从太湖自然繁殖的花鲴鱼内脏(肝、肠等)筛选得到,编号为GHJ,于4 ℃冰箱中保存[17]。
1.1.2 主要仪器和试剂 (1)主要仪器:摇床、离心机、培养箱、高压蒸汽灭菌锅、倒置显微镜、岛津紫外分光光度计UV-1800等; (2)试剂:蔗糖、甘油、脱脂乳粉、谷氨酸钠、牛肉膏、鱼粉蛋白胨、琼脂粉、NaCl等试剂均是分析纯或生化纯试剂。
1.1.3 培养基 细菌培养采用牛肉膏蛋白胨培养基。
1.2 方 法
1.2.1 溶藻干粉菌剂制备 为了控制试验过程中的单一变量,选取小麦粉作载体,蔗糖、甘油、脱脂乳粉、谷氨酸钠作为菌剂低温冷冻干燥保护剂,在前期研究中已确定4保护剂菌剂浓度分别在10%,10%,4%,8%时,菌剂的活菌率最高。挑取一接种环的溶藻菌GHJ接种在牛肉膏蛋白胨培养基中活化,取100 mL经20 h发酵的溶藻菌GHJ种子液加入5 g载体、5 mL保护剂共105 mL制成液体菌剂,于120 r·min-1、25 ℃条件下振荡培养18 h,将液体菌剂在
-4 ℃的条件下预冻2~3 h,再放入真空冷冻干燥机中在-40~-30 ℃进行冷冻干燥,约48 h后成粉末状态,制成溶藻干粉菌剂。
1.2.2 活菌率的测定 在冷冻干燥前取1 mL液体菌剂,利用无菌水进行梯度稀释、平板涂布计数,记录菌剂冷冻干燥前的菌體数量,菌落计数单位为CFU·mL-1。冷冻干燥后将所得溶藻干粉菌剂全部溶于适量1 mol·L-1的磷酸盐缓冲液(PBS)中,配置成与冷冻干燥前液体菌剂相同体积的菌液,平板计数,计算溶藻干粉菌剂的活菌率。
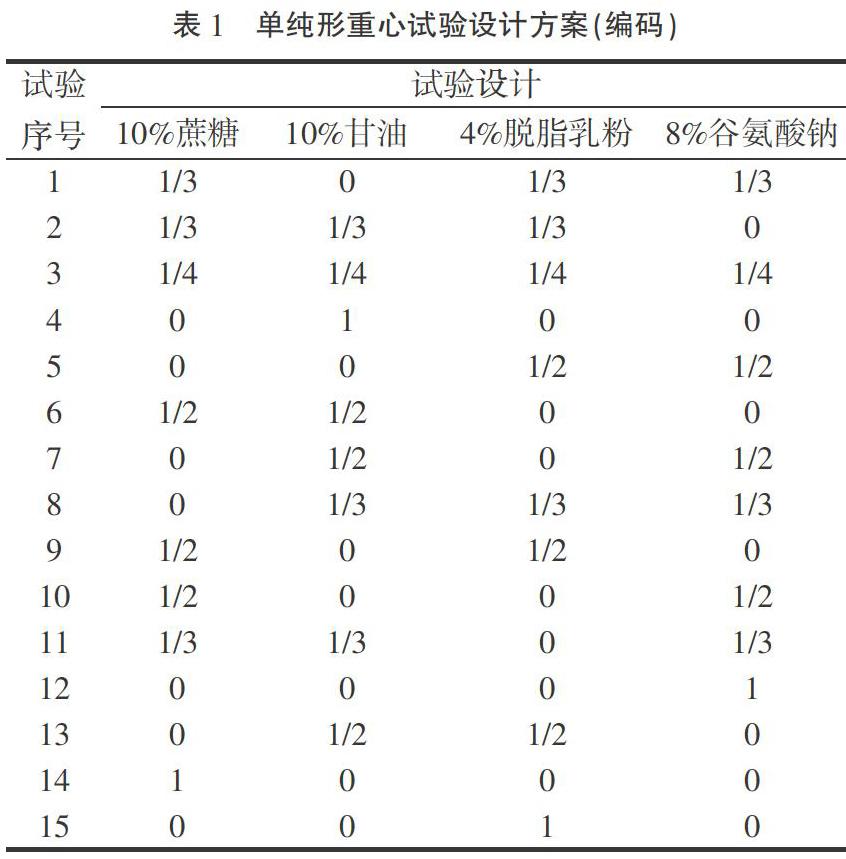
1.2.3 响应面优化试验 为了确定最佳菌剂保护剂配方,以溶藻菌GHJ菌体活菌率为响应值,选取10%蔗糖(A),10%甘油(B),4%脱脂乳粉(C),8%谷氨酸钠(D)4种保护剂为自变量,采用Design-Expert 8.0.6软件混合料单纯形重心试验设计方案对4种保护剂配比进行优化。
1.2.4 数据分析 本次试验所得数据采用Excel、oirgin进行分析和统计,采用Design-Expert 8.0.6和Origin 8.0进行相关绘图和有关数据分析。
2 结果与分析
2.1 单纯形重心设计
单纯形重心设计方法是一种高效的混料试验设计统计模型,可以根据各个试验点及其对应的响应值得到相应的响应面模型。单纯形重心设计法具有较高的精确性和信任度。响应面软件给出的试验设计方案如表1及表2。
响应面设计得到的不同配比的溶藻菌菌剂复合保护剂活菌率见表3。
按照软件给出的试验方案进行实验,将得到的试验结果进行软件分析,得到各试验保护剂编码值与试验因变量Y用编码表示的回归方程:
Y=150.30A+83.57B+101.38C+70.88D+179.82AB-32.60AC+93.12AD-46.34BC+413.74BD-141.76CD+481.75ABC+256.84ABD-465.32ACD+828.85BCD
其中不同配比配制得到的复合保护剂菌剂冷冻干燥前后状态如图1和图2所示。
其中响应面给出的试验分析中活菌率的方差分析结果如表4。
模型及其线性混合模型的P值均大于0.05,差异不显著,甘油与谷氨酸钠的交互作用对干粉菌剂活菌率的影响在P<0.05水平显著。相关系数R2为0.984 7(R2>0.9),说明结果的变异有98.47%是由变量引起的,校正后的相关系数R2 adj=0.959 7,模型与实际的拟合度较好。F值用于判断模型的受干扰程度,F值越大,模型的受干扰程度越小,而此次模型的F值为53.29,模型的受干扰程度较小。由Design-Expert 8.0.6优化得到活菌率最高的复合干粉菌剂保护剂组成为10%蔗糖(1/3),10%甘油(1/3)、4%脱脂乳粉(0)、8%谷氨酸钠(1/3)时,溶藻菌活菌率最大为189.26%。
2.2 响应面分析讨论
4种不同保护剂单独制备成干粉菌剂时对菌剂中溶藻菌结构和性能的影响在课题组早期的研究中已得到结论[18],4种保护剂两两之间的交互作用对菌剂中活菌率的影响如图3—图6所示。
菌剂保护剂组成中不含谷氨酸钠和脱脂乳粉(图3),干粉菌剂活菌率可达133.32%。在溶藻菌菌剂冷冻进行真空冷冻干燥的过程中,蔗糖分子含有大量的羟基,羟基基团可以联结菌剂四周的自由基,从而可以防止菌剂暴露在外界中,Leslie等[19]指出蔗糖不仅能使得完整的细胞不遭受外环境的破环,同时还能保护脂质体与生物膜。而甘油在溶藻菌干粉菌剂冷冻干燥时利用其能渗透细菌细胞壁与细胞膜,降低细胞失水程度与速度,使得菌体的新陈代谢过程减缓来提高菌剂活菌率。当两者同时存在时,蔗糖与甘油作为保护剂的同时还能为菌体提供细胞复苏所需的碳源,有利于干粉菌剂的存储。菌剂保护剂组成中不含甘油和谷氨酸钠(图4),蔗糖和脱脂乳粉各为1/2时,干粉菌剂活菌率可达133.44%。脱脂乳粉富含蛋白质能给予细菌一层保护外衣,将菌体包裹。按照保护剂的功能与性质,蔗糖属于糖类保护剂,脱脂乳粉属于蛋白类保护剂,以这两种物质组成的复合保护剂兼具糖类保护剂与蛋白类保护剂的优点。由图5可知,菌剂保护剂组成中不含谷氨酸钠和蔗糖时,干粉菌剂活菌率可达50.14%,活菌率较低,溶藻菌GHJ经真空冷冻干燥后的活菌率与甘油、脱脂乳粉的交互作用呈负相关。推测原因可能为甘油含有3个羟基,具有强吸湿性,与大分子物质脱脂乳粉形成氢键,两种保护剂相互作用从而降低了对菌体的保护。图6所示菌剂保护剂组成中不含甘油和蔗糖时,干粉菌剂活菌率可达103.51%。脱脂乳粉作为溶藻菌菌剂进行真空冷冻干燥时候的保护剂可以帮助菌剂呈现优异的粉末状和促使菌剂具有良好的复水性。谷氨酸钠可以与水进行密切作用能够使干粉菌剂留有适量充足的水分,满足了溶藻菌等微生物对维持活性的最低要求。
采用Design-Expert 8.0.6对试验结果进行分析作图,因为考虑到蔗糖、谷氨酸钠、脱脂乳粉和甘油存在相互影响进而对溶藻菌菌剂活菌率产生影响,所以选择控制某一保护剂作为单一变量,其他3个保护剂与活菌率的关系由软件处理得到响应面图,则各响应面影响分析见图7—图10。
蔗糖、脱脂乳粉、甘油3种保护剂在制备溶藻菌干粉菌剂过程中对溶藻菌活菌率的影响如图7所示,复合保护剂组分中不投加谷氨酸钠,10%蔗糖的溶液、4%脱脂乳粉和10%甘油各占1/3,在三类保护剂共同作用下,活菌率最高可达90.37%,其响应曲面图开口向下,说明活菌率作为响应值存在极大值且该点在试验选取的试验区域内。图8表示复合保护剂中不投加脱脂乳粉,10%蔗糖的溶液、8%谷氨酸钠和10%甘油各占1/3,经真空冷冻干燥后溶藻菌菌剂成活率达189.26%,活菌率最高,保护剂作用机制主要分为3个阶段,冷冻干燥前甘油保护剂渗透入细菌细胞内部,取代水分子与细胞内大分子物质多的氢键,维持细胞的结构[20];冷冻干燥过程中蔗糖保护剂增加了溶液的黏性,减缓了水的结晶过程,降低了菌体的机械损伤程度[21];冷冻干燥后谷氨酸钠能维持菌剂中的水分并修复受损细胞。图9表示复合保护剂中不投加甘油,10%蔗糖的溶液、8%谷氨酸钠和4%脱脂乳粉各占1/3,经真空冷冻干燥后溶藻菌菌剂成活率达160.21%,响应曲面图曲线较为平缓,变化幅度不大,三者共同作用时交互作用不明显。复合保护剂中不投加蔗糖,10%甘油的溶液、8%谷氨酸钠和4%脱脂乳粉各占1/3干粉菌剂活菌率的情况如图10所示,经真空冷冻干燥后溶藻菌菌剂成活率达153.21%。
3 结论与讨论
单一保护剂在细菌菌体抵抗恶劣的外界环境情况下保护作用相对较弱,不足以达到真空冷凍干燥的要求,在菌剂中添加复合保护剂,能突破单一保护剂的局限性。王大欣等[22]利用Box-Behnken法确认复合保护剂为蔗糖4.51 mg·g-1、海藻糖0.90 mg·g-1、葡萄糖9.60 mg·g-1时,能最大程度提高菌剂存活率。杜磊和乔发东[23]在单因素试验的基础上设计正交试验,得出10%蔗糖、10%脱脂乳与5%谷氨酸钠是最佳的复合保护剂,菌剂存活率由64%提升至95%。
本试验采用单纯形重心设计,建立了不同菌剂保护剂配比与干粉菌剂活菌率之间的回归模型,预测出复合保护剂最优比例为:10%蔗糖、10%甘油与8%谷氨酸钠成分各占1/3,溶藻功能菌活菌率最大为189.26%。本研究对于溶藻菌干粉菌剂制备及商品化开发有一定的理论和应用参考价值。
参考文献:
[1]JI X, JIANG M, ZHANG J, et al. The interactions of algae-bacteria symbiotic system and its effects on nutrients removal from synthetic wastewater[J]. Bioresource Technology, 2018, 247: 44-50.
[2]陈志伟, 徐顾榕, 陈坤, 等. 响应面优化混合发酵剂制作冷冻面团馒头的生产工艺[J]. 食品科技, 2016, 41(10): 120-126.
[3]董小娜, 陈泽慧, 毛林强, 等. 溶藻菌R1的溶藻特性[J]. 土木建筑与环境工程, 2018, 40(5): 117-123.
[4]董小娜, 陈泽慧, 毛林强, 等. 太湖土著激浪鱼内脏中溶藻菌R1的筛选及其特性研究[J]. 工业安全与环保, 2018, 44(8): 73-76.
[5]GWAK H J, LEE J H, IM T-W K, et al. Protective effect of soy powder and microencapsulation on freeze-dried Lactobacillus brevis WK12 and Lactococcus lactis WK11 during storage[J]. Food science and biotechnology, 2015, 24(6): 2155-2160.
[6]TANG C-j, ZHENG P, MAHMOOD Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge[J]. Journal of industrial microbiology & biotechnology, 2009, 36(8): 1093-1100.
[7]陈冬, 蔡庆庆, 黄彬, 等. 以干藻粉为原料的MC-LR提取试验研究[J]. 现代化工, 2017, 37(6): 84-86.
[8]徐承志, 周涛, 陈柏丽. 微生物菌剂的开发和应用现状[J]. 南方农机, 2017, 48(4): 172.
[9]祝虹钰, 刘闯, 李蓬勃, 等. 微生物菌剂的应用及其研究进展[J]. 湖北农业科学, 2017, 56(5): 805-808.
[10]MOAYYEDI M, ESKANDARI M H, RAD A H E, et al. Effect of drying methods (electrospraying, freeze drying and spray drying) on survival and viability of microencapsulated Lactobacillus rhamnosus ATCC 7469[J]. Journal of functional foods, 2018, 40: 391-399.
[11]曹琳, 邢亚阁, 苏菲烟, 等. 真空冷冻喷雾干燥下川藏高原冰酒发酵菌剂复合保护剂的配方优化[J]. 食品工业科技, 2018, 39(4): 88-93.
[12]陈晶, 陈萍, 邓文, 等. 反硝化聚磷菌B8干粉菌剂的制备及应用[J]. 环境化学, 2017, 36(5): 1148-1155.
[13]RAMOS Y G R, CALPENA C A C, EGEA G M A, et al. Freeze drying optimization of polymeric nanoparticles for ocular flurbiprofen delivery: effect of protectant agents and critical process parameters on long-term stability[J].Drug Development and Industrial Pharmacy, 2017, 43(4): 637-651.
[14]董玉惠, 张丽霞, 韩晓阳, 等. 响应面法优化棕壤茶园专用解磷微生物菌剂制备工艺[J]. 山东农业科学, 2016, 48(3): 56-61.
[15]RATNAM B V V, RAO M N, RAO M D, et al. Optimization of fermentation conditions for the production of ethanol from sago starch using response surface methodology[J]. World journal of microbiology and biotechnology, 2003, 19(5): 523-526.
[16]ZU Y, ZHANG Y, ZHAO X, et al. Optimization of the preparation process of vinblastine sulfate (VBLS)-loaded folate-conjugated bovine serum albumin (BSA) nanoparticles for tumor-targeted drug delivery using response surface methodology (RSM)[J]. International journal of nanomedicine, 2009(4): 321-333.
[17]郭惠娟, 張伟, 张小梅, 等. 溶藻细菌Microbacterium oleivoran的溶藻进程与叶绿素降解动力学[J]. 环境化学, 2019(6): 1274-1281.
[18]毛林强, 郭惠娟, 薛静静, 等. 干粉菌剂保护剂对溶藻菌溶藻效果与稳定性能的影响[J]. 环境化学, 2019, 38(12): 2819-2825.
[19]LESLIE S B, ISRAELI E, LIGHTHART B, et al. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying[J]. Applied & environmental microbiology, 1995, 61(10): 3592.
[20]杨耸月, 李灿, 王家林, 等. 乳酸菌菌剂中保护剂的种类和其保护机制[J]. 饲料研究, 2016, (1): 8-10.
[21]任香芸, 何志刚, 李维新, 等. 植物乳杆菌R23冻干保护剂的优选[J]. 中国食品学报, 2016(5): 115-121.
[22]王大欣, 张丹, 初少华, 等. 巨大芽孢杆菌NCT-2冻干菌剂的制备及冻干保护剂响应面优化[J]. 食品工业科技, 2016(11): 156-160.
[23]杜磊, 乔发东. 乳酸菌冷冻保护剂选择的研究[J]. 乳业科学与技术, 2010, 33(3): 119-121.
