用鲁尔三通和注射器整合中学化学实验的案例
2020-12-07霍本斌
霍本斌

摘要: 充分利用鲁尔三通气流流向的可控性、注射器功能的多样性,分别对空气中氧气含量的测定、某些有毒气体(如氯气、氨气、硫化氢、二氧化硫)的制备与性质实验、“铝三角”中物质间相互转化实验、含氮化合物之间的相互转化及其异常现象的探究实验等内容进行整合和一体化设计,不仅可以消除教材实验自身存在的某些缺陷所导致的学生认知困难,还可以提升实验教学质量,发展学生的学科核心素养。
关键词: 鲁尔三通; 注射器; 化学实验; 一体化设计; 实验改进
文章编号: 1005-6629(2020)11-0072-05
中图分类号: G633.8
文献标识码: B
注射器是一种十分常见的医疗器材,因其具有多种功能而受到中学化学教师的青睐并将其用于改进现行初、高中化学教材中的部分实验,如用于检测特定装置的气密性、制作减压装置[1]、某些易被空气氧化的物质的制备[2]、研究某些有毒物质(如NOx)的性质及实验改进[3]、研究乙醇的催化氧化[4]等。这些关于注射器的应用研究成果,往往针对某个单一的知识点或某一物质的制备与性质实验进行改进,鲜有结合鲁尔三通(见图1)进行实验设计。本文将介绍四则运用注射器和鲁尔三通整合中学化学实验的一体化设计案例,这些案例在教学中均取得较好的实验效果。
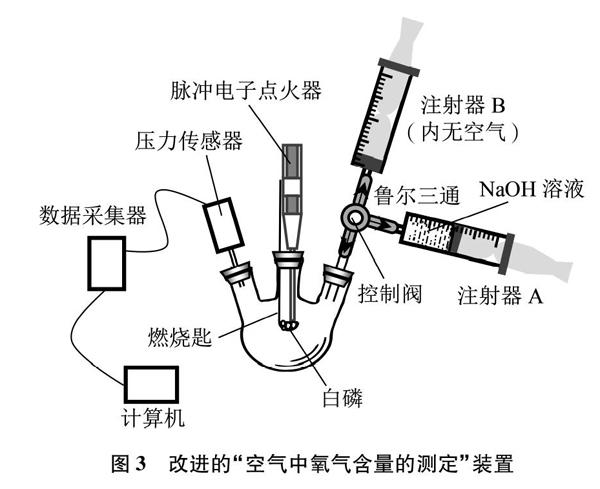
1 优化测定空气中O2含量的实验
人教版九年级《化学》上册中“空气中O2含量的测定”实验(见图2),因下列原因而造成较大测量误差: (1)无法利用加热法检测装置的气密性。若空气受热时的膨胀速率大于装置的漏气速率,烧杯中导管末端依然会产生气泡,这会对装置的气密性产生误判;(2)构成密闭系统部分的气体是个变化量,无法准确判定具体体积。这是由于燃烧的红磷伸入广口瓶时造成瓶内空气膨胀而部分逸出,致使广口瓶上的原有刻度标识失准;(3)打开止水夹时,回流到广口瓶中的水还有少量残留在导管中;(4)无论使用红磷还是白磷,氧气都会有一定残留[5]等。
为了解决上述问题,鲁通老师[6]借助压力传感器并利用钢丝绒生锈法来测定空气中O2的含量,解决了测定结果的准确性问题,却存在耗时长、不便于课堂演示等缺陷。王培明、徐宝刚等[7]则提出采用电烙铁头部缠绕铜丝,在自制的玻璃钟罩内,用电加热铜丝引燃白磷,白磷再引燃红磷,从而达到控制封闭体系中的气体为不变量,实现O2含量的准确测定。这种实验方法在一定程度上解决了教材装置中封闭系统气体是变化量的问题,但由于需要用电加热的电铬铁,会产生一定的不安全因素,测量也不够精确。如何才能确保实验结果的可靠性、安全性并适宜于课堂演示?笔者结合以往研究成果,借助脉冲电子点火器、压力传感器、鲁尔三通和注射器设计改进装置(见图3),轻松达成实验目标。
按图3连接好实验装置,旋转鲁尔三通的控制阀,打通三颈瓶与注射器B之间的气流通道。紧接着打开正方体软件Lab studio并选择“压力传感器”,在“按取样频率记点”栏选择“10点每秒”,时间选择“1分钟”。在“采集”菜单下选择“开始采集”,记下此时的初始压强p起(p起=98.2kPa)。启动脉冲电子点火器,点燃白磷。由于白磷燃烧放热,使三颈瓶内气体受热膨胀,导致瓶内气压增大,部分空气从瓶内进入注射器B中,注射器B的活塞缓慢向上移动,直至白磷燃烧结束。当白磷燃烧结束后,瓶内温度开始下降、气体体积不断收缩,三颈瓶内气压下降。可观察到注射器B的活塞在外界大气压作用下又开始往下移,直至恢复原状。冷却至室温,当瓶内气压稳定时停止数据采集,记下此时压强p终(p终=78.20kPa)。最后旋转控制阀,连通三颈瓶与注射器A间的气流通道,将注射器A中的NaOH溶液全部推入三颈瓶中,摇动三颈瓶,除去其瓶内的有毒物质。根据气体方程pV=nRT推知恒温条件下: p起-p终p起=V起-V终V起,即ΔVV起=Δpp起。由于烧瓶内气体的减少量为空气中氧气的量,即V(氧气)=ΔV,所以空气中氧气的体积分数为(O2%)=ΔVV起×100%=Δpp起×100%=98.2-78.298.2×100%=20.34%。该结果与空气中氧气的体积分数约为21%非常接近,测试值略低是由于白磷燃烧结束后氧气仍有残余,大约为2%~3%的缘故[8]。
2 借助鲁尔三通和注射器对有毒气体的制备及其性质实验进行一体化设计
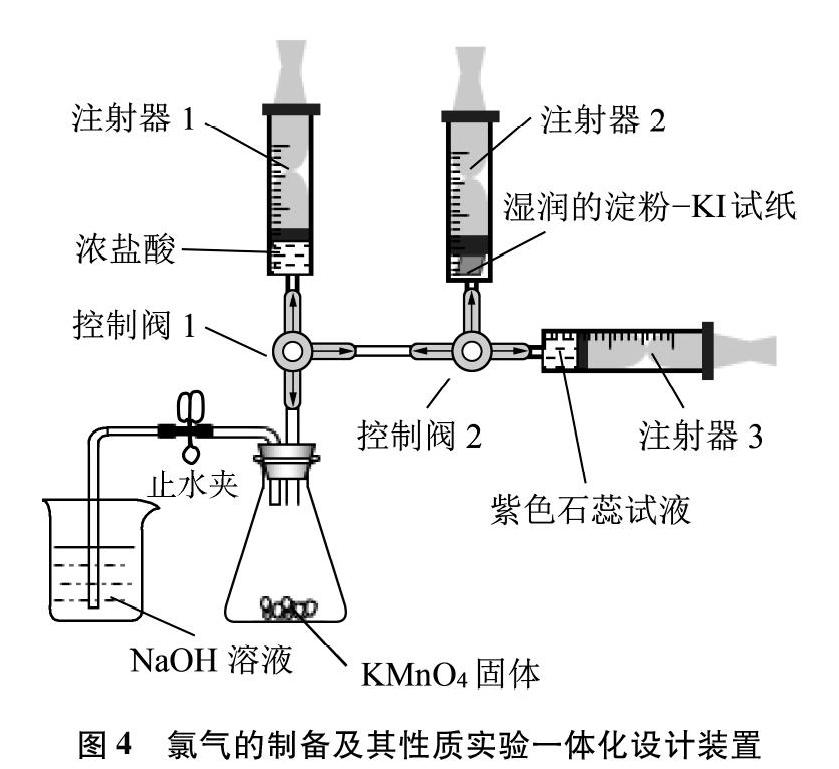
诸如Cl2、 SO2、 NO2等有毒气体的制备和性质实验,往往因其在实验过程中存在气体泄漏、环境污染、不符合绿色化学理念等原因,被现行教材删掉或由教师在教学中用口头实验、黑板实验来代替,这对学生正确认识元素化合物的性质造成一定的认知障碍。如何解决上述问题?笔者认为可以将其制备和性质进行一体化的绿色设计。如在进行Cl2的制备和性质实验教学时,可采用图4所示装置来完成Cl2的教学。
操作过程如下: (1)按图4连接仪器并添加试剂。(2)打开止水夹,旋转控制阀1,連通注射器1和锥形瓶。往下推注射器1活塞,使浓HCl全部推入锥形瓶。然后再旋转控制阀1,切断注射器1和锥形瓶之间的气流通道。可观察到左侧导管口产生气泡。当黄绿色Cl2充满整个锥形瓶时,旋转控制阀1,连通注射器1和锥形瓶,同时关闭止水夹。此时可观察到注射器1的活塞往上移。(3)当注射器1收集到30mL Cl2时,旋转控制阀1,连通控制阀2和注射器1,同时打开止水夹,让锥形瓶内的Cl2逸出后可被NaOH溶液吸收。(4)旋转控制阀2,使注射器2与注射器1连通。通过缓慢下推注射器1的活塞,使部分Cl2进入注射器2,可见淀粉-KI试纸(湿润)变蓝,时间稍长一点,试纸又会变成无色。(5)旋转控制阀2,连通注射器3和1,再向下推注射器1活塞,让Cl2进入注射器3中。可见石蕊试液先变红后褪色。(6)实验结束时,用盛有NaOH溶液的注射器替换注射器1,并将NaOH溶液注入锥形瓶中,振荡锥形瓶,使其瓶内Cl2全部被NaOH溶液吸收。上述实验过程将Cl2的制备、颜色观察、收集、化学性质以及尾气处理融为一体,既环保又节省试剂,还体现化学实验的生活化。
如果将烧杯、锥形瓶、注射器1、注射器2、注射器3中的试剂进行更换,该装置还可用于研究NH3、 H2S、 SO2等的制备与性质(见表1)。
3 借助鲁尔三通和注射器整合“铝三角”中物质间相互转化实验并进行一体化设计
在高中化学中,对于那些滴加顺序不同产物也不同的反应原理的探究实验,也可通过控制用量和反应物的流向来设计实验。如利用图5可研究“铝三角”中物质间的相互转化。其操作过程如下。
(1) 按图5连接好装置,并在注射器1加入20mL 1mol·L-1的NaOH溶液,注射器2中加入5mL 1mol·L-1 AlCl3溶液,在注射器3中加入20mL 1mol·L-1盐酸。
(2) 旋转控制阀,使注射器1与注射器2连通,缓慢推动注射器1的活塞,使NaOH溶液缓慢注入到AlCl3溶液中,直至反应结束。可观察到AlCl3溶液中立即产生白色沉淀,沉淀达到最大量后又开始逐渐溶解。其反应原理为Al3++3OH-Al(OH)3↓, Al(OH)3+OH-AlO-2+2H2O。
(3) 旋转控制阀,使注射器2和注射器3连通。推动注射器2的活塞,使注射器2中的液体缓缓注入到注射器3中,可观察到注射器3中起初没有明显现象,过一段时间后才产生白色沉淀。其反应原理为Al(OH)-4+4H+Al3++4H2O、 3AlO-2+Al3++6H2O4Al(OH)3↓[或缓慢推动注射器3的活塞,使盐酸注入到注射器2中,可观察到先产生沉淀,然后沉淀溶解,反应原理为AlO-2+H++H2OAl(OH)3↓,Al(OH)3+3H+Al3++3H2O]。通过上述操作,可实现“铝三角”中各物质之间的转化,即,加深学生对含铝化合物性质的认识。
如果将上述注射器1中试剂换成5mL 1mol·L-1 NaHCO3溶液,注射器2中试剂换成5mL 1mol·L-1 Na2CO3溶液。注射器3中1mol·L-1盐酸的体积换成15mL。则利用图4、图5的实验装置,可以解释NaHCO3与盐酸反应的速率比Na2CO3要快,是因为HCl与Na2CO3的反应分两步完成(CO2-3+H+HCO-3, HCO-3+H+CO2↑+H2O),且滴加顺序不同,反应原理及现象也不同。
4 借助鲁尔三通和注射器对铜与稀、浓HNO3的反应及其产物验证进行一体化设计
对于铜与硝酸反应的实验改进,有的研究者只对Cu与稀HNO3反应及产物进行综合设计,如刘会文、金丽丽设计的实验装置[9](见图6);也有研究者对Cu与浓、稀HNO3反应及产物验证进行综合设计,如杨香涛、阮方来设计的装置[10](见图7)等。这些装置的改进,都能在一定程度上满足防污染等实验的要求,基本达成实验教学目标。但装置相对复杂,一般只能在讲台上演示使用,不便于教师边演示边走动,让学生都能观察到实验现象。
为了能够将Cu与浓HNO3、稀HNO3的反应及其产物的性质进行综合设计,达到实验方式灵活,又不影响实验的可视化效果,笔者参考前人的研究成果,借助注射器和鲁尔三通实现了这一目标,装置如图8所示。
操作步骤如下: (1)按图8连接装置并在注射器中加入相关物质。(2)旋转控制阀1和2,分别使注射器A和B、注射器C和D连通。向右推动注射器B的活塞,使浓HNO3全部注入到注射器A中。可观察到铜片不断溶解并产生红棕色气体、无色溶液逐渐变成绿色;注射器B的活塞开始向左移动,当反应结束时,在注射器B中收集到气体6mL左右(注: 此步可验证Cu和浓硝酸的反应)。(3)旋转控制阀1和控制阀2,关闭注射器A和注射器B、注射器C和注射器D之间的气体通道,连通注射器A和注射器D之间的气体通道。缓慢推动注射器D的活塞,使注射器D中的O2进入注射器A中,并晃动整套装置,可观察到A中溶液由绿色逐渐变成蓝色[注: 说明溶液呈现绿色是因为生成的NO2溶解在Cu(NO3)2溶液中所致]。(4)旋转控制阀1和2,连通注射器B和C,关闭注射器A和B、 C和D之间的气体通道。推动C的活塞,使水进入B中,并摇动整套装置。可观察到B中红棕色气体逐渐变成无色气体,剩余气体约占原气体的1/3(注: 此步可验证NO2溶于水)。(5)旋转控制阀2,使注射器B与D连通,推动注射器D的活塞,使O2进入注射器B中,并摇动整个装置。可见注射器B中的无色气体逐渐减少,活塞向右移动,直到气体消耗殆尽。旋转控制阀1,关闭注射器A和注射器B之间的气体通道(注: 此步可以验证NO、 O2与H2O的反应4NO+3O2+2H2O4HNO3)。(6)再次旋转控制阀2,切断A和D、连通A和C间的气体通道。将C中的水换成铜片,同时将注射器A中形成的稀HNO3推入注射器C中,可观察到注射器C中产生无色气体,溶液变蓝[注: 此步可与第(2)步构成对比,让学生明确Cu与稀HNO3、浓HNO3反应现象不同、产物不同]。(7)旋转控制阀2,使注射器C和D连通,推动注射器D的活塞,使O2进入注射器C中,C中氣体由无色变成红棕色;摇动装置,红棕色气体又逐渐消失。
