关于金属键的一些思考
2020-12-07耿莉利吴俊明
耿莉利 吴俊明

摘要: 在金属键自由电子理论和能带理论基础上,讨论了化学键和金属键的定义以及金属键与金属-金属键的异同与联系,对如何定义金属键作深入地再思考,初步讨论了中学化学教学中金属键练习题的编制以及关于金属键强度的问题。
关键词: 金属键; 化学键; 低维度金属键; 习题编制; 化学教学
文章编号: 1005-6629(2020)11-0008-05
中图分类号: G633.8
文献标识码: B
1 从一道练习题说起
笔者遇到了这样一道题目:
金属晶体中金属键是指哪些微粒之间强烈作用( )。
A. 金属离子之间
B. 金属原子之间
C. 金属离子与自由电子之间
D. 金属离子与阴离子之间
因为课本中对化学键的定义是“物质中相邻原子之间的强烈相互作用稱为化学键”[1],对金属键的定义是“金属离子间依靠自由电子而产生的强的相互作用就是金属键”[2],按字面理解,相互作用发生在金属离子间,自由电子是作用条件,似应该选A。可是,金属离子带正电荷,彼此之间只有斥力,不可能产生强烈的结合力,似应该选C,但是金属离子和自由电子间的作用又与化学键定义中“原子之间的强烈相互作用”是不一致的。问题在哪里?应该怎样处理?为解决这个困惑,笔者对金属键的形成以及定义做了一些思考。
2 金属键的形成
关于金属键的形成,目前主要有两种理论。
2.1 自由电子理论
金属原子具有以下特点: 一是金属原子的外层电子较少;二是金属的电离能较小,外层电子比较容易脱离,使金属原子的最外层具有稳定的结构而形成金属阳离子;三是金属晶体是由同种原子组成的密堆积结构,配位数多(通常是12或8),虽然不同金属晶体中原子的堆积方式有所不同,但是金属晶体的内部结构都是相似的,即金属阳离子整齐地排列形成晶格,而它们原有的外层价电子则在整个晶体中自由运动,是离域的,为整个晶体所共有(通常被称为“自由电子”)。由价电子共有这一点看来,金属键跟共价键有相似之处,只是金属原子外层电子的共有程度远远大于共价键。由于金属离子的电子亲和能较小,所以每个金属阳离子都很容易捕获自由电子,这种吸引力能够使得金属阳离子克服相互间的斥力而形成金属键。这种状态通常被形象地比喻成“金属晶格沉浸在自由流动的电子云(或电子气)中”。金属键没有方向性和饱和性,导致金属原子最大限度地重叠而形成紧密堆积结构,使体系能量降低而稳定[3]。总之,由于自由电子的存在,使得金属晶体内部的化学键比较特殊。
自由电子理论简单易懂,但是它不能令人信服地解释为什么金属原子的外层价电子能在整个晶体中自由运动,不能全面解释金属的其他性质。
2.2 能带理论
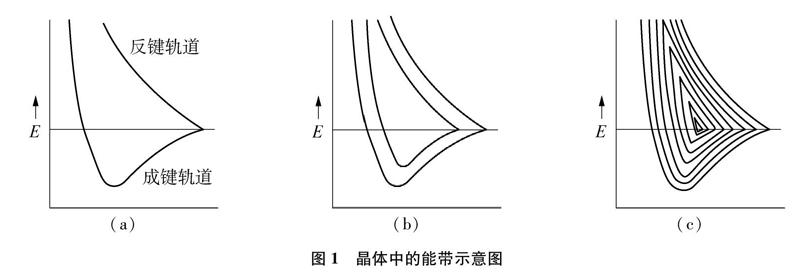
根据分子轨道理论[4],两个原子相互键合时,它们的能量相近、对称性相同的原子轨道通过线性组合可形成两个分子轨道,其中一个是能量低于原子轨道的成键分子轨道,另一个是能量高于原子轨道的反键分子轨道。键合的原子数目愈多,组成相应的分子轨道数目也愈多。当N个原子组成晶体时,N个原子轨道可以组合成N个分子轨道,其中有N/2个成键轨道和N/2个反键轨道,如图1所示。
最低成键轨道为下限,最高反键轨道为上限。在这样狭窄的能量区间内,分子轨道如此之多,轨道之间的能级差必然很小,实际上形成了几乎是连续的能带。
在晶体中,相同能级的原子轨道组合成一个能带。例如原子的价层中ns轨道组成相应的ns能带,np轨道组成相应的np能带。原子的内层轨道原已充满电子,受核的束缚较强,不会参与成键,因此通常可不考虑原子的内层轨道组成的能带。每种能带中可容纳的电子数目有其最高限额,跟原子结构的电子排列规则相一致: 在N个原子组成的晶体中,ns能带最多可容纳2N个电子,np能带最多可容纳6N个电子。这些电子按能量由低到高的顺序,首先填满低能带中的能级,然后才填充到高能带中的能级。
全部能级完全被电子填满的能带称为“满带”,全部能级未被电子填充的能带称为“空带”,如果能带中的能级没有完全被电子填满,即只有部分能级被电子填充的能带称为“导带”。两个相邻能带之间的不重叠区域,表示相邻能带之间的能量差,称为“禁带”。如果原子的价层中相邻轨道的能量很接近,或形成杂化轨道,晶体中相应的相邻能带会相互重叠或形成“杂化”能带而具有导带结构[5]。图2为晶体中的三种能带结构示意图。
金属能带理论把整个金属晶体作为一个巨大的分子处理。金属原子的价层轨道组成许多分子轨道,因为原子数目巨大,所以这些能级差极微小的序列分子轨道会构成一个能带。金属能带的间隙比较小,甚至能带之间有重叠,所以电子很容易得到足够能量,实现轨道跃迁。少量金属原子或离子是不能形成金属能带的,由金属原子或离子形成的金属晶格起着主导作用。
综上所述,金属晶体的形成有两个关键: 一是金属离子堆积成晶格,二是价电子共域(非定域),它们之间强烈地相互作用形成金属晶体内部的作用力,使金属原子得以键合在一起。
能带理论不但可以解释金属单质、非金属单质和半导体的导电性差异,还可解释金属的导热性、可塑性、延展性、金属光泽和光电效应等物理性质,比经典的自由电子理论能更好地说明金属键的本质以及导体、绝缘体和半导体的区别与联系。在实践中,能带理论指导了半导体等固体材料在现代科学技术上的广泛应用。
3 对化学键和金属键定义的思考与讨论
定义是对于一种事物的本质特征或一个概念的内涵和外延的确切而简要的说明,或者是透过列出一个事件或者一个物件的基本属性来描述或规范一个词或一个概念的意义[6];是描述一个概念,并区别于其他相关概念的表述[7]。简而言之,定义是对概念或意义的描述。
恰当的定义不但有利于学生正确地形成和掌握科学概念,为进一步开展科学思维奠定基础,也能为学生思维的进一步发展拓展适当的空间。为此,在下定义时需要遵从必要的规则。
从科学教育的角度看,在下定义时应该遵从下列定义规则:
●定义时以概念的内涵为基础。
●力求准确、明确、简洁扼要、不改变目标事物本身。
●科学概念应该是科学的,即应该是科学过程、科学思维的产物,要避免简单地灌输。
●科学教学中的科学概念应该适合学生的认知能力,有利于学生接受。
●科学概念的定义应该给学生认知的发展留有适当的空间,有利于发展学生认知能力和水平的发展。
关于化学键和金属键的思维应以它们的定义为起点,围绕“成键实体是什么?”“成键实体是怎样相互作用的?它们之间有哪些相互联系?”“成键有哪些类型?”“成键类型对物质性质有何影响、有何规律?”等问题展开,引导学生初步涉及化學键和金属键思维活动。
目前的中学化学教科书在定义化学键时一般沿用“分子或晶体中相邻原子间强烈的相互作用”,或者改用“物质中相邻原子间强烈的相互作用”。这两种定义方式中,前者未包容非晶体等情况,后者则似包容太宽、不太明确。
在定义金属键时存在不同的三种情况: 第一种情况是限定/不限定“在金属单质的晶体中”;第二种情况是把成键实体限定为“金属原子”/“金属离子”/“金属离子与自由电子”;第三种情况则是干脆不做定义、仅做说明(例如“在金属单质的晶体中,原子之间以金属键相互结合”)。
要不要限定“在金属晶体中”?我们认为,金属键是在金属晶体中发现的,若不限定“在金属晶体中”不能解释清楚金属键的形成机理,不利于学生明确金属键的非定域性,也不利于学生理解和牢记“金属键”这个名称。所以,通常情况下还是以限定“在金属晶体中”为好。
能不能把自由电子也作为成键实体?我们认为,虽然自由电子也参与了成键,但它不是作为独立实体参与成键的,就像离子键、共价键形成时的价电子一样。既然在界定离子键、共价键时不把价电子作为独立的成键实体,在界定金属键时,也不把自由电子作为独立的成键实体,这不是顺理成章吗?如果把自由电子也作为成键实体,金属晶体中就同时有了两类不同的成键实体,这就必须在说明自由电子跟金属离子的相互作用之外,还必须分别说明自由电子跟自由电子的相互作用以及金属离子跟金属离子的相互作用。这意味着金属键是由3种不同的相互作用构成的,使问题大大地复杂化。而且,也难以解释在静电场中金属导体中自由电子不均匀分布(感应极化、趋肤效应所致),但金属键不受影响这个事实。
金属键中的成键实体是金属原子还是金属离子?单独把金属离子作为成键实体似不合理,因为金属晶体中的金属离子跟离子化合物中的金属离子是有所不同的,前者是有共域化的电子伴随的。金属键中的成键实体实际上是价电子共域化的金属原子,不能简单地说成是金属离子,也不能简单地说成是金属原子。在说明金属键中的成键实体是金属原子时,一定不能丢了“在金属晶体中”(或者“价电子共域化”)这个前提。
4 思维的拓展: 低维度金属键可能存在吗
金属晶体是三维的,与此相应,其中的金属键也是三维的,这跟s电子云球型对称有关。但是,有不少金属原子的价电子还可能包括p电子,特别是d电子,由此就产生一个问题: 金属键能不能是二维的(具有像多环芳烃和石墨烯那样的层状结构),甚至是一维的(具有线状的结构)?也许有人认为这个问题很无聊、没有意思或者认为难度太大。然而,许多化学的发现、发明,以及新领域的开拓,正是起步于类似的思考。这样的问题对于创造思维和化学兴趣的激发与培养是不无意义的。僵化的灌输式的教学,不但会贻害学生,也会贻害教师,亟需改变。
出于这样的考虑,我们查阅了一些文献,发现了一些令人感兴趣的事实。例如:
有学者在过渡金属杂环纳米团簇中发现了具有芳香性的金属环[8]。纳米团簇(nanoclusters;简称团簇)是由一定数目的原子或者分子等形成的一种相对稳定的微观和亚微观尺度的聚集体。一般来说团簇空间尺寸处于几到几百,它们在许多不同的环境和基础物理化学过程中实际存在。团簇的组成小至三五个原子、十几或几十个原子,大至几百甚至上千、上万个原子,随着微粒数目的增加,团簇可以过渡为大块固体。组成团簇的微粒可以是原子、分子、离子,例如主族金属团簇Al2-4,过渡金属团簇Aun、 Run,过渡金属杂氮团簇Os3N3+、杂氟团簇Re3F32+等。Os3N3+等团簇是苯的无机类似物,具有全局6π离域电子,具有δ-芳香性。δ-键存在于两个过渡金属原子之间,是过渡金属所特有的一种金属间成键,其δ轨道是由d2Z原子轨道组合形成的,因此δ轨道具有较大的重叠程度,比较稳定。然而,δ-键属于共价键,只有两个节面(电子云密度为零的平面),常出现在金属化合物中,尤其是包含钽、铪、铼等过渡金属的系列化合物。此外,还发现在Cr2化合物中两个Cr原子之间存在σ2π4δ4五重键;在U2化合物中也发现了多重键;在Ta3O-3中发现3个Ta原子之间存在三中心两电子离域δ-键,赋予了体系δ-芳香性。
1979年,Hoffmann等人[9]预测一些包含离域键的模型金属环,并认为它们是芳香性的。在他们的假设提出几年后一些研究者便分离出大约25种金属苯并进行了表征[10],其中,Elliot等人于1982年报道第一个稳定的金属苯。1995年,Robinson等人合成了首例仅含有金属原子的芳香族有机金属化合物[11]。2015年,我国学者翟华金和孙忠明成功合成了世界首例全金属芳香性三明治化合物[Sb3Au3Sb3]3-[12]。目前,已有数千例含有金属原子跟金属原子直接键合的化合物被报道,这类新型化合物的化学反应性已经成为新的研究热点。
上述物质的结构特殊性,使得它们具有特殊的性质和特别的用途。例如,有机金属化合物可提供碳负离子、自由基和卡宾等活泼中间体,因此有机金属化合物是一类极为有用的合成试剂;许多有机金属化合物具有生物活性,使它们在药理研究和生化应用中日益深入发展;一些有机金属化合物在军工领域用于制作超高温热障涂层、吸波隐身材料等等。鉴于金属键有机化合物在理论和应用上的重要意义,它已经成为许多化学家关注和研究的热点对象之一。
由金属原子跟金属原子结合形成的“金属-金属键”跟“金属键”是不同的: 金属键一般只在金属晶体中存在,涉及的金属原子数量巨大;而金属-金属键一般只在化合物中存在,涉及的金属原子数一般只有几个到上万个(有人认为金属杂环纳米团簇可以过渡为大块固体)。在有关金属-金属键化合物的文献中,常有人把金属-金属键称为金属键。如果要把金属-金属键称为“金属键”的话,它一般只能算是“微型金属键”。
关于一维的“(微型)金属键”,有人发现了Cu—Cu键、Ni—Ni单键、Ni—Ni双键、Cr—Cr双键、Cr—Cr三键、Al—Al键和Ga—Ga键的存在并进行了研究[13,14]。不过,它们都是双原子的,更长的链状分子我们没有查到。
至此我们看到: 从两个原子简单地共用部分或全部外层电子,到晶格中全部金属原子共用部分或全部外层电子,存在着一系列过渡状态,这是一个十分有趣的现象。金属-金属键的共价性质反映了金属键的“部分共价键”、“不完全共价键”本质。也正因为如此,我们才把金属-金属键称为“低维度金属键”。
上述关于低维度金属键可能存在的事实启发我们,应该对如何定义化学键和金属键作深入的再思考。
5 中学化学中金属键练习题的编制
金属键练习题的编制应该围绕“成键实体是什么?”“成键实体是怎样相互作用的?它们之间有哪些相互联系?”“成键有哪些类型?”“成键类型对物质有何影响、有何规律?”等问题灵活地展开,引导学生开展化学键和金属键思维活动。接受、理解和(能够)应用是金属键认知的基本目标层次。
金属键的特点和本质;金属键与金属性质的关系;影响金属键形成及强度的因素;金属键与其他化学键的区分;化学键类型的识别;化学键与物质类别的关联判断;有关化学键与金属键的正确表征等等,是金属键练习题最重要和常见的题材。
金属键练习题的编制应该以化学键和金属键的正确定义为基础,否则就会出现问题,本文开头列举的那道题足以说明这一点。我们必须以高度的责任心来力求出好题、不出病题。
有一些金属键练习题涉及了金属键的强度。
早在1959年金松寿先生就通过研究指出[15],影响金属键强度的因素比较复杂: 金属的若干物理性质,例如熔点、沸点及机械强度等或多或少均与金属结构及键的强度有关。金属在元素周期表中的位置(左侧还是右侧)、金属原子半径(涉及键长)、升华热、成键价电子数等因数都会影响金属键的强度(键能)。曾经有人设想测定金属原子的气化能,或者用适当的模型计算金属的内聚能,来作为金属键强度的指标[16]。周公度先生明确指出[17,18],金属键的强度可用金属的气化焓来衡量(假定气态为单原子分子)。金属气化焓(ΔHv)是指1mol金属变成气态时焓的增量。金属气化焓的大小及熔点的高低与每个原子的平均净成键电子数及相对论效应有关。例如,第六周期元素从左至右气化焓随成键电子数稳定增长,至W达最高点,此后随净成键电子数减少而降低(Re例外),直至Hg,净成键电子数为0,气化焓最低。金属的气化焓影响金属的许多物理性质。一般说来,气化焓大,金属的结合力大,硬度高,熔点也高。有作者在网上介绍说:“原子半径越小、价电子越多,金属键就越强”;“金属键越强,金属晶体的熔、沸点就越高,硬度就越大”;“同一主族从上到下金属键依次减弱;同一周期从左到右金属键依次增强……”由于没有指明金属键强度的指标,学生可能难以把握影响金属键强度的因素。
致谢: 本文写作中得到宋心琦、周公度和陈敏伯先生的帮助、指点,特表谢忱!
参考文献:
[1][2]上海市中小学(幼儿园)课程改革委员会. 高级中学课本·化学·高中一年级第一学期(试用本)[M]. 上海: 上海科学技术出版社, 2007: 58, 5.
[3][美]Bruce H·马亨著. 复旦大学无机化学教研组译. 大学化学(下册)[M]. 上海: 上海科学技术出版社, 1985: 117~121.
[4]E·卡特迈尔等著. 宁世光译. 原子价与分子结构[M]. 北京: 人民教育出版社, 1981: 139~140.
[5][16][日]细矢治夫等著. 方小任译. 结构与物性[M]. 上海: 上海科学技术出版社, 1979: 170~171, 178~181.
[6]https://baike.baidu.com/item/定义/483965?fr=aladdin.
[7]《GB/T15237.1—2000术语工作 词汇 第1部分: 理论与应用》3. 3. 1 定义.
[8]刘娜. 过渡金属杂环团簇的结构、 成键特性和新型芳香性研究[D]. 太原: 山西大学硕士学位论文, 2019.
[9]D. L. Thorn, R. Hoffmann. Delocalization in metallocycles [J]. Nouv. J. Chim., 1979, (3): 39~45.
[10]J. R. Bleeke. Metallabenzenes [J]. Chem. Rev., 2001, (101): 1205~1227.
[11]X. W. Li, W. T. Pennington, G. H. Robinson. A metallic system with aromatic character. Synthesis and molecular structure of Na2[(Mes2C6H3)Ga]3(Mes=2, 4, 6-Me3C6H2): the first cyclogallane [J]. J. Am. Chem. Soc., 1995, (117): 7578~7579.
[12]邢兆远, 李建斌. 世界首例全金属三明治化合物合成[N]. 光明日报, 2015-09-16.
[13]韩欣彤. 3d双过渡金属与羰基形成低配位数化合物的理论研究[D]. 长春: 东北师范大学硕士学位论文, 2019.
[14]路菲菲. 第三主族双金属三明治及双Cu簇合物中化学键的理论研究[D]. 石家庄: 河北师范大学硕士学位论文, 2015.
[15]金松寿. 金属键的强度[J]. 杭州大学学报, 1959, (5): 25~42.
[17]周公度. 结构和物性——化学原理的应用(第三版)[M]. 北京: 高等教育出版社, 2009: 276.
[18]周公度. 段連运结构化学基础(第5版)[M]. 北京: 北京大学出版社, 2017: 288.
