彩叶矾根‘草莓漩涡’组培再生体系建立及快繁技术研究
2020-12-07吴海红李丹齐鑫赵兴华
吴海红李 丹齐 鑫赵兴华
(辽宁省农业科学院花卉研究所,辽宁 沈阳 110161)
矾根(Heucheramicrantha)又名珊瑚铃,原产于美国中部,为虎耳草科矾根属多年生耐寒草本花卉[1],浅根性,叶基生,阔卵状,基部心形或楔形,掌状浅裂至深裂,边缘波状[2]。 矾根喜中性偏酸、疏松肥沃且排水性良好的土壤,喜阳耐阴[2],是少有的彩叶阴生地被植物,优良宿根花卉,在国外园林景观中广泛应用。 作为新优地被植物,矾根在国内主要应用于林下花镜、地被、庭院绿化及园林景观中[3],因其多彩的叶色,独特的叶型深受人们的喜爱,被誉为“花园的调色板”。 近几年国内矾根在花坛、花境、花带以及立体绿化等方面的用量大幅增加,但矾根种子比较小,对播种条件要求较高[1],常规种子繁殖周期比较长;传统的分株方法由于矾根新品种更新速度快,扦插和分株繁殖方式获得种苗速度慢,同时受限于母株数量,无法满足市场需求,大大制约了矾根新品种的繁殖速度和推广应用。 本试验在辽宁省农业科学院花卉研究所组培实验室内开展,以引进的“草莓漩涡”品种矾根一年生营养钵苗的叶片、叶柄及茎尖为外植体建立有效的矾根组培苗再生及快繁技术体系,为其组培苗的工厂化生产提供可靠的技术指导,满足北方绿化和美化环境的需要。
1 材料与方法
1. 1 试验材料
矾根品种“草莓漩涡”一年生营养钵苗的叶片、叶柄及茎尖。
1. 2 试验方法
1. 2. 1 无菌外植体材料的获得及接种 选用温室内生长良好的一年生营养钵苗的幼嫩叶片、叶柄及茎尖,流水冲洗30 ~60 min,置于超净工作台上用无菌滤纸吸干表面水分备用;再用0. 1%的升汞溶液分别灭菌2、3、4 min,无菌水冲洗3 ~5次,无菌滤纸吸干表面水分;在接种盘内将叶片剪切成1 cm×1 cm 的方块,接种于叶片、叶柄诱导培养基上,每瓶接种一块外植体材料。 培养基添加蔗糖30 g/L,琼脂粉5 g/L,pH 5.8。
1. 2. 2 培养条件 置于光照培养室中培养,培养温度(25±2) ℃,光照时间12 h/d,光照强度2 000 ~2 500 lx。
1. 2. 3 丛生芽诱导培养基的筛选 以 MS 为基本培养基,添加不同浓度的植物激素,生长素NAA 0 ~0.2 mg/L,细胞分裂素选择 6-BA 0 ~0.5 mg/L,试验采用L9(34)正交试验设计,各因素水平如表1 所示,共设计9 个处理,每个处理接种50 个1 cm×1 cm 的叶片、1 cm 长叶柄,茎尖数量比较少,每个处理接种1 个。 观察矾根外植体的生长发育变化,统计叶片及叶柄切口处愈伤组织诱导率和丛生芽诱导率,从而确定最适合矾根初始培养的诱导培养基。

表 1 不定芽诱导培养基正交实验设计L9(34)因素与水平Table 1 Factors and level table of orthogonal design of L9(34) for adventitious bud induction medium
1. 2. 4 丛生芽增殖培养基的筛选 以MS 为基本培养基,添加不同浓度和类型的植物激素,生长素选择IBA 0 ~mg/L 和IAA 0 ~0. 02 mg/L,细胞分 裂 素 选 择 6-BA 0 ~0. 2 mg/L 和 KT 0 ~0.2 mg/L,观察矾根的生长发育状态,确定最适合矾根增殖的增殖培养基。

表 2 丛生芽增殖培养基正交实验设计L9(34)因素与水平Table 2 Factors and level table of orthogonal design of L9(34) for proliferation medium of cluster buds
1. 2. 5 芽苗的生根培养 以 1/2MS 为基本培养基,选择生长素IBA 0 ~0.2 mg/L 和NNA 0 ~0.2 mg/L 为生根激素,开展单因素试验,观察矾根的生根状态,确定最适合矾根的生根培养基。
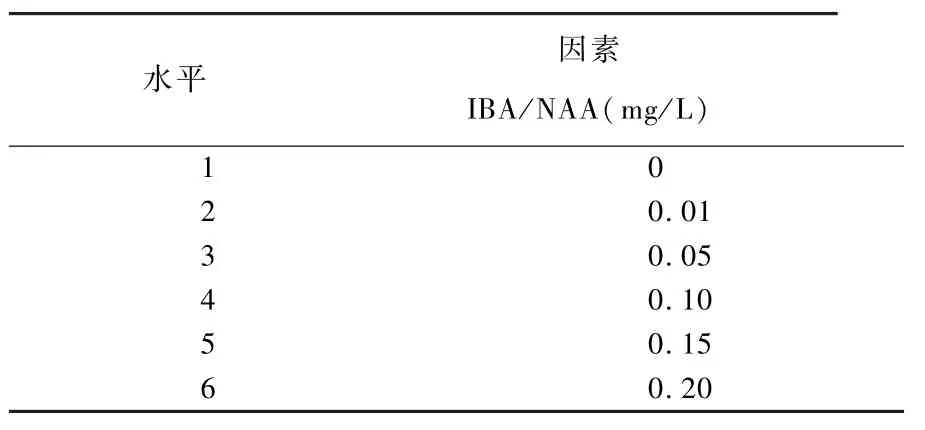
表 3 IBA、NAA 对诱导矾根苗生根的试验Table 3 Test table of Heuchera micrantha root induction with IBA、NAA
1. 2. 6 试管苗的移栽 以珍珠岩、草炭+珍珠岩(3 ∶1)、椰糠为栽培基质对试管苗进行移栽定植试验,不同基质的每次重复均定植40 株。
2 结果与分析
2. 1 外植体表面灭菌剂不同处理时间的筛选
如表4 所示,灭菌时间2 min 的外植体污染率超过50%;灭菌时间3 min 的外植体污染率6%;当灭菌时间增加到4 min 时,污染率最小为4%,但增加了外植体材料的死亡率,保留有活性外植体瓶数仅剩18 瓶。 综上所示,最佳外植体灭菌时间为3 min。
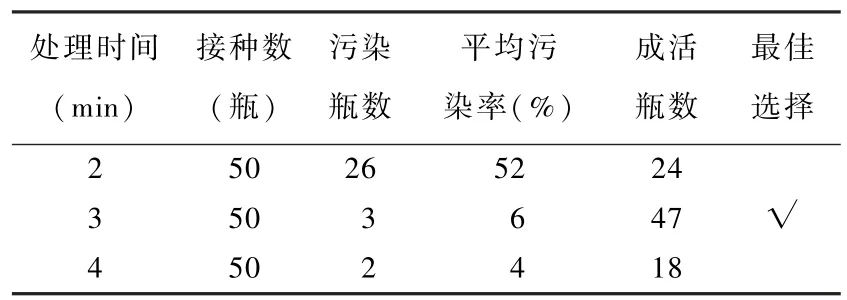
表 4 外植体灭菌时间处理Table 4 Explant sterilization time table
2. 2 不同浓度6-BA 和NAA 对矾根诱导丛生芽的影响
矾根的叶片及叶柄在诱导培养基上培养28 d 后,在叶片切口处和叶柄上,均可见到明显的淡绿色膨大组织和突起,进一步培养21 ~28 d后可诱导出成簇的小苗。
在按照正交设计的L9(34)矾根丛生芽诱导培养基中,矾根外植体都能百分之百诱导出愈伤组织;随着6-BA 浓度的增高丛生芽出现玻璃化现象,使有效丛生芽利用率下降。 丛生芽诱导率和丛生芽利用率最佳6-BA 和NAA 的组合为试验号4 和5 (表5)。
2. 3 不同激素组合对矾根丛生芽增殖的影响
由表7 可知,叶片、叶柄诱导出来的丛生芽转接到丛生芽增殖培养基上,培养30 d 后随着细胞分裂素浓度的增加丛生芽增殖系数增加,试验5、7、8 号有玻璃化现象,并且分化系数过大;试验4、9 号有轻微玻璃化,分化系数过大,苗细弱。
2. 4 不同激素配比对矾根试管苗生根的影响
由表7 可知,矾根生根IBA 单因素试验显示,随着IBA 量的增加,根数量增多;出现了当IBA浓度0.05 mg/L 时组培苗均未生根和叶色变绿的情况,根的整体状态是须状根。 矾根生根NAA 单因素试验表明,苗上部生长正常,生根情况整体表现都不如添加IBA。
2. 5 炼苗与移栽
由表8 可知,炼苗移栽后5 d 观察,最早发新叶的是椰糠;10 d 后发新叶最多的是珍珠岩;30 d后成活最多的是珍珠岩。 经过第二、第三次重复试验发现,移栽30 d 的组培苗成活率最高的是珍珠岩。
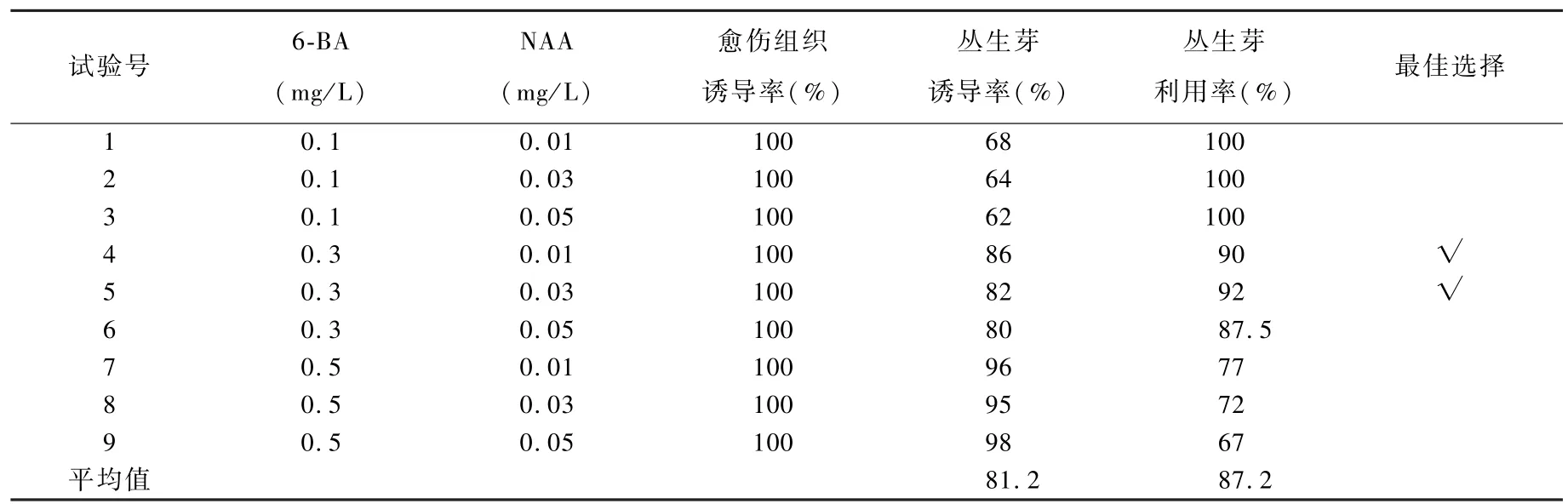
表 5 不同浓度6-BA 和NAA 组合对矾根诱导丛生芽的影响Table 5 Effects of different concentrations of 6-BA and NAA on the induction of cluster buds for Heuchera micrantha
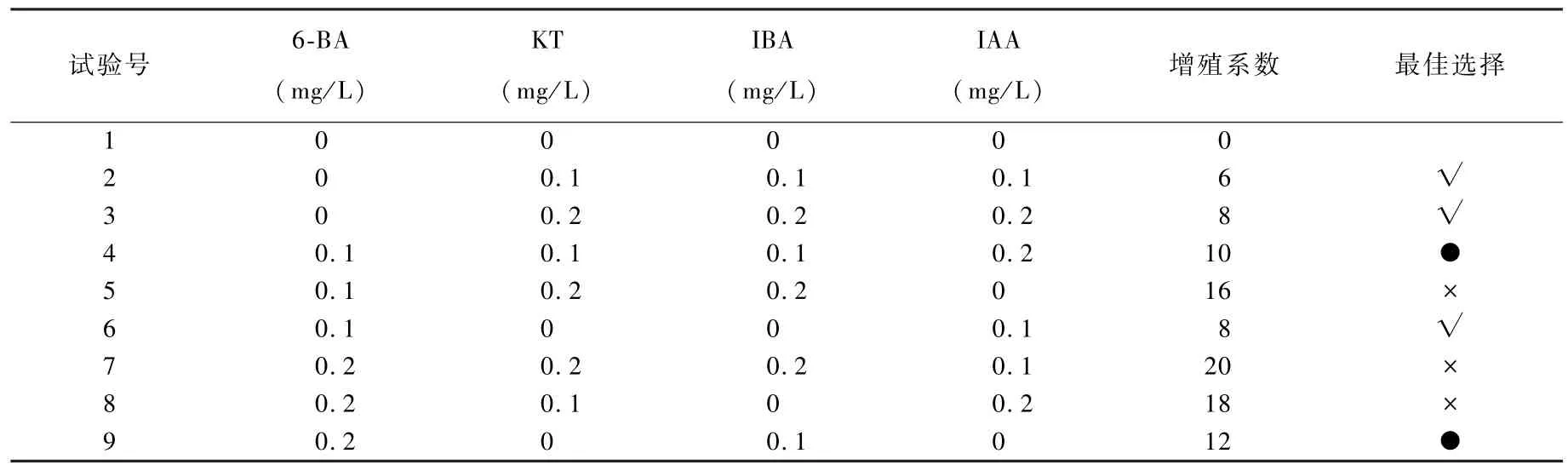
表 6 不同浓度6-BA 和NAA 组合对矾根诱导丛生芽的影响Table 6 Effects of different concentrations of 6-BA and NAA on the induction of cluster buds for Heuchera micrantha
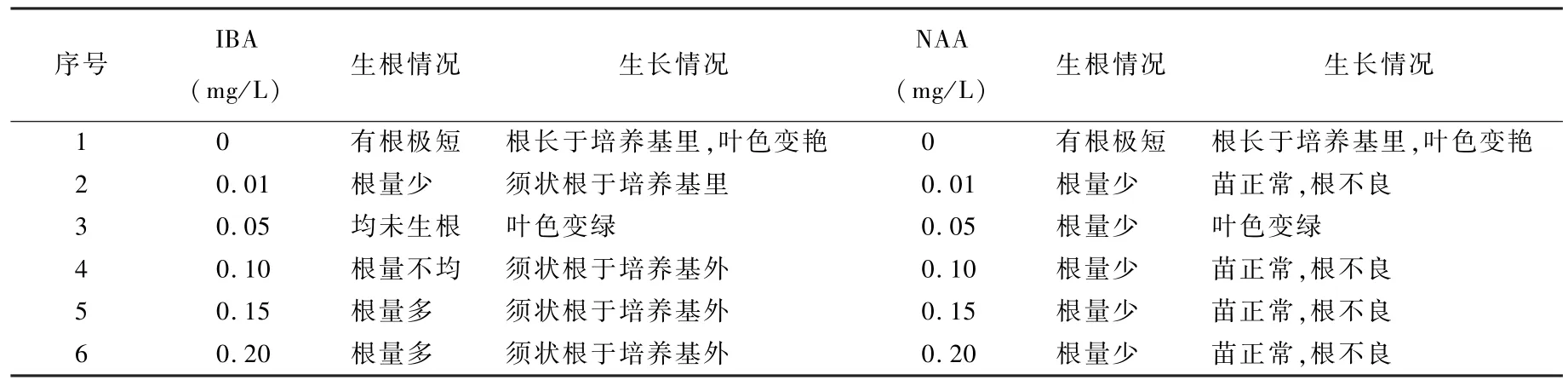
表 7 IBA、NAA 不同浓度对矾根试管苗生根的影响Table 7 Effect of different concentrations of IBA and NAA on Rooting of Heuchera micrantha in vitro

表 8 不同栽培基质对组培苗移栽炼苗的影响Table 8 Effects of different culture media on transplanting and refining of tissue cultured seedlings
3 结论
通过本次试验可知,矾根组培再生体系建立比较容易,外植体茎尖、叶片、叶柄在短期内均能诱导出苗,但叶片、叶柄是外植体的最好选择,材料丰富,表面杀菌容易,在短期内能获得大量组培苗。 最佳丛生芽诱导培养基为 MS + 6-BA 0.5 mg/L+ NAA 0. 1 mg/L, 平 均 诱 导 率 达 到81.2%,增殖系数平均可达9。 最佳生根培养基配方为1/2 MS+IBA 0. 1 mg/L,生根率达100%,最佳组培苗炼苗基质为珍珠岩,移栽基质为草炭+珍珠岩(3 ∶1)。 本次试验在快繁过程中的生根阶段还不是很理想,不同梯度浓度处理的组培苗的根都呈须根状,不方便组培苗的移栽炼苗操作,致使移栽成活率不高,需要进一步试验研究,如选用使生根和炼苗合二为一的小型无糖组培栽培盒,能解决组培苗移栽炼苗成活率问题。
