动态CEUS-TIC定量分析技术在肝癌立体定向放射治疗疗效评估中的应用研究*
2020-12-05唐一植靳丽嘉
陈 鹏 唐一植* 申 芹 靳丽嘉 左 丹
原发性肝癌(primary hepatic carcinoma,PHC)是最常见且恶性程度最高的肿瘤之一,发病率在恶性肿瘤中位居世界第5位,病死率位居第3位[1]。根据迄今为止的回顾性研究,对于肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)、射频消融术(radiofrequency ablation,RFA)和放射性栓塞治疗不能切除的肝癌,立体定量放射治疗(stereotactic body radiation therapy,SBRT)是一种新兴的替代传统肝移植的方法。因此,放射治疗成为失去手术机会的PHC不可或缺的治疗手段[2-3]。体部伽马刀通过图像引导定位系统在线定位、校正及验证,可以明显减少了体部伽马刀的分次间摆位误差,提高精确度,既显著提高肿瘤局部放射治疗剂量,又降低周围正常组织剂量[4]。以往评价SBRT疗效的方法主要是增强CT(contrast-enhanced CT,CECT)、核磁共振成像(magnetic resonance imaging,MRI)以及数字减影血管造影(digital subtraction angiography,DSA),其疗效虽然较确切,但都存在一定的局限性[5]。而超声造影(contrast-enhanced ultrasonography,CEUS)检查便捷、无辐射,并且能够实时动态显示。基于此,本研究利用CEUS时间-强度曲线(CEUS-timeintensity curve,CEUS-TIC)动态评估肝癌SBRT前后血流动力学改变,探讨CEUS-TIC分析技术在SBRT后疗效评价的临床价值,减少“假性进展”率,以提高肝癌立体定向放射治疗疗效评价准确性。
1 资料与方法
1.1 一般资料
选取2018年6月至2019年1月在三六三医院确诊的17例原发性及继发性肝癌患者,其中男性7例,女性10例;年龄49~84岁,平均年龄(67±11)岁;所有患者均行SBRT,本研究经医院伦理委员会批准,所有患者均签署知情同意书。
1.2 纳入与排除标准
(1)纳入标准:①年龄≥18岁;②一般情况较好,KPS评分>70;③病理学诊断或临床诊断明确,Child-pugh分级A-B级,无手术适应证或拒绝手术;④肝内单发肿瘤或多个肿瘤聚集一处;⑤合并门静脉栓塞者原发肿瘤与癌栓直接相连;⑥血清肌酐<1.5×正常值上限按Coclcroft-Gault公式计算的肌酐清除率≥50 ml/min;⑦预计生存期≥3月。
(2)排除标准:①肿瘤边界在影像学上无法确认的患者;②Child-pugh分级C级;③无法完成疗效观察;④影响认知能力的神经或精神异常;⑤中枢神经系统转移患者;⑥合并其他疾病;⑦妊娠或哺乳患者;⑧其他恶性肿瘤病史,但无疾病生存期未超过5年。
1.3 仪器设备
采用昆仑5彩超机(深圳迈瑞公司);OUR-QGD型体部伽玛刀(深圳奥沃公司)。
1.4 治疗方法
(1)SBRT:患者平卧于立体定位床中,负压袋抽真空固定;在定位架下采用CT层距2 mm螺旋扫描,扫描范围自膈顶上3 cm至肝下缘下3 cm;应用OURQGD型体部伽玛刀,用50%的等剂量曲线包绕95%以上的肿瘤体积,靶周边剂量40~50 Gy,中位剂45 Gy,分割剂量3~7 Gy;周一至周五进行治疗,每疗程8~14次,1次/d。记录放射治疗每次的剂量、分割的方法、总剂量及放射治疗总时间。
(2)超声造影:于治疗前3 d,治疗后3 d、3个月及6个月时行超声造影,造影前先将探头定位于肿瘤中心部位,启用双幅造影模式,然后经肘部浅静脉团注法快速推注sonovue造影剂2.4 ml,随后注射5 ml生理盐水,注入造影剂后开始计时、录像并实时观察,确保每个被重点观察的病灶都有完整的各个时相记录资料,利用定量分析软件根据感兴趣区域(region of interest,ROI)内信号强度随时间的变化拟合出ROI组织的TIC。
1.5 观察与评价指标
(1)肿瘤最大径线:利用超声二维图像测量肿瘤直径最大值。
(2)超声造影观察指标:利用TIC曲线获取不同组织灌注参数值达峰时间(time to peak,TTP)、峰值强度(peak intensity,PI)以及曲线下面积(area under curve,AUC)。
1.6 统计学方法
选用SPSS20.0软件对研究数据进行分析和处理。符合正态分布的计量资料结果以均值±标准差()表示,计数资料采取率(%)表示。采集时间-强度量化分析软件检测治疗后残留病灶内血流灌注信息。分别测定治疗前后TTP、PI及AUC。样本中两个均数的比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤最大径线观察指标
SBRT治疗后3 d肿瘤最大径线与治疗前3 d比较,差异无统计学意义,治疗后3个月和治疗后6个月比较肿瘤最大径线有所缩小,差异有统计学意义(F=31.435,P<0.0167),见表1和图1。
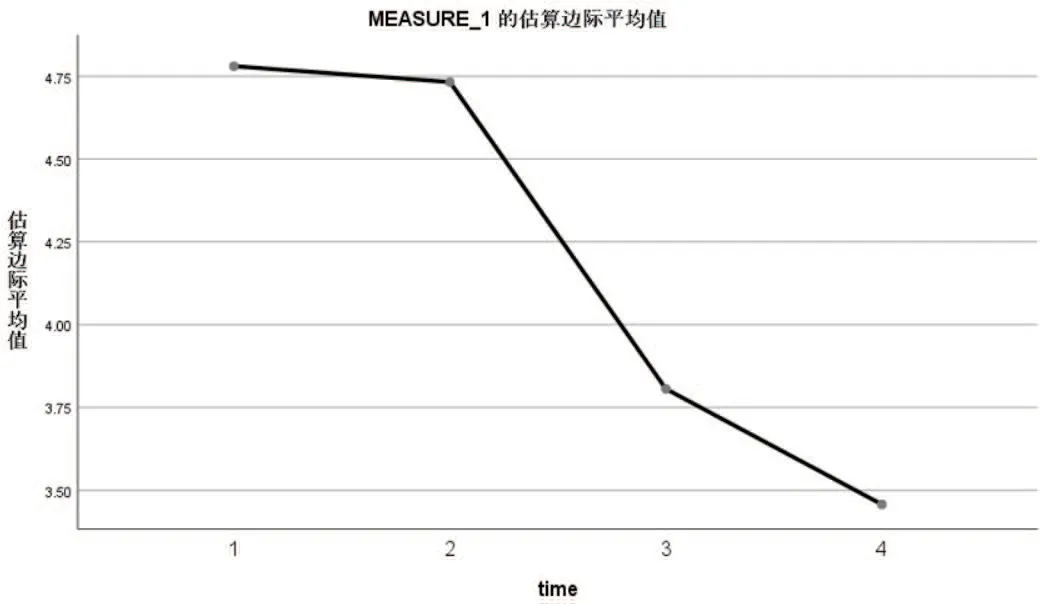
图1 不同时间肿瘤最大径线比较曲线图
2.2 超声造影观察指标
SBRT治疗前3 d,治疗后3 d、3个月及6个月时TTP无统计学差异(F=1.604,P>0.0167);SBRT治疗前3 d,治疗后3 d、3个月及6个月时PI及AUC逐渐降低,差异均有统计学意义(F=62.174,F=133.722;P<0.0167),见表2和图2。
表1 患者不同时间肿瘤最大径线比较()

表1 患者不同时间肿瘤最大径线比较()
注:表中*为治疗后3 d与治疗前3 d比较,P>0.0167;△为治疗后3个月与治疗后3 d比较,t=2.676,P<0.0167;☆为治疗后6个月与治疗后3个月比较,t=2.676,P<0.0167
表2 患者不同时间超声造影各指标比较()
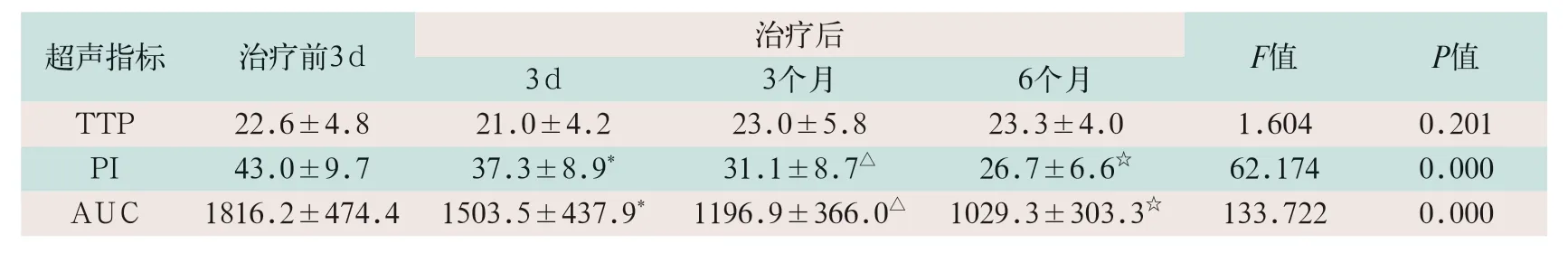
表2 患者不同时间超声造影各指标比较()
注:①表中TTP为达峰时间,PI为峰值强度,AUC为曲线下面积;②*为放射治疗后3 d与放射治疗前3 d比较,t=2.676,P<0.0167,△为放射治疗后3个月与放射治疗后3 d比较,t=2.676,P<0.0167;☆为放射治疗后6个月与放射治疗后3个月比较,t=2.676,P<0.0167

图2 不同时间超声造影各指标比较曲线图
由于不同时间点数据的不独立性,采用重复测量方差分析,发现不同时间点的患者,在最大径线、PI和AUC存在统计学差异,为了进一步进行分析,调整后进行配对t检验,并调整检验水平为0.0167。
3 讨论
临床中CECT常被用于SBRT定位,也用于其治疗后的疗效评价。CECT可以从肿瘤治疗后的大小、密度、强化特点及周围肝组织变化方面反映肿瘤治疗后疗效,能够为临床制定治疗计划提供可靠依据[6]。但CECT存在自身局限性,加之其短期内需多次反复检查可致患者遭受较大辐射,且价格昂贵,而增强碘造影剂主要以肾进行排泄,对于肾功能较差的患者极大加重了肾功能损害的可能,对于医师而言CECT的增强模式及强度易受诊断医师主观性影响。
超声因其检查的方便快捷、价格低廉、无辐射等优点广泛应用于临床治疗疗效评估,且能够实时动态的进行观测,可利用彩色多普勒对病灶内部血流进行简单的分析。而CEUS利用造影剂微泡的谐波成像可最大限度地发现肿瘤新生血管在管径大小、分支及分布异常,客观真实地反映肿瘤的血流灌注信息[7]。肝癌CEUS观察主要内容包括增强时相、增强水平、造影剂分布特征及增强模式4个方面,这些都是主观性指标,易受医师主观影响[8]。随着超声造影技术的发展,运用定量分析软件获得病灶的TIC,造影后绘制出的曲线可以定量评价组织结构微循环血流灌注,能够极大降低超声医师的临床经验不足及诊断主观性,减少误诊及漏诊。且超声造影剂极少对人体产生不良反应,即使出现也只是瞬间反应,且程度很弱[9-10]。
本研究利用CEUS对肝癌SBRT治疗后疗效分析,发现治疗后3 d病灶最大径线较治疗前差异无统计学意义,而治疗后3个月及6个月病灶最大径线较前有所缩小,且结果有统计学差异。综合临床分析考虑,由于治疗计划靶体积较所见病灶要大,治疗后早期反应局部改变表现为肿瘤组织变性、肿胀、坏死和肿瘤周围正常肝组织的放射性损伤,且坏死组织尚未完全吸收[11]。而3个月后因肿瘤坏死组织的吸收,周围放射性损伤的修复引起病灶范围的缩小。与此同时在TIC曲线中治疗前3 d,治疗后3 d、3个月及6个月时TTP差异无统计学差异,考虑因肿瘤被定向放射治疗后,会导致中央小静脉血管收缩、肝窦内血流缓慢,照射区内缺血严重,最终诱导肝细胞损伤、坏死及照射区发生炎症反应[12]。而局部组织的炎性反应、水肿及血管通透性改变,引起炎性反应区域对于造影剂微泡的趋化游走较为明显,而肿瘤内部因坏死、吸收及内部血管损伤,导致内部血流减少,综合影响TTP,导致TTP波动较大。在本研究中治疗前3 d,治疗后3 d、3个月及6个月时达峰强度逐渐降低,差异有统计学意义,综合分析因肿瘤坏死,自身对坏死组织的吸收,导致内部血供逐渐减少,且早期病灶周围正常肝组织的放射损伤也存在自身的吸收及修复,引起病灶组织内部血供逐渐减少。且放射治疗后3 d,3个月及6个月时曲线下面积较治疗前3 d逐渐降低,差异有统计学意义,AUC描述的即使病灶内部造影剂微泡的数量变化,当肿瘤因立体定向放射治疗后内部血供减少,随之病灶内部造影剂摄取数量减少。肿瘤在经过治疗后虽然组织学并未出现改变,但其内部血供已在治疗后发生变化。CEUS及可以利用肿瘤内部的血供变化进行疗效评价,而且通过TIC曲线的PI及AUC可以对放射治疗疗效进行定量的分析,即在放射治疗后3 d时PI及AUC已发生变化。与CECT相比,CEUS能够更好地描述肝脏的肿瘤灌注和治疗变化[13]。CT或普通MRI的检查要等治疗2~3个月后,肿瘤形态缩小或不变时才可判断放射治疗的疗效,如果肿瘤缩小或是消失,即认为对放射治疗敏感,肿瘤死亡;而肿瘤体积无变化或变化不明显时,则可能肿瘤已经死亡被纤维组织代替,也可能肿瘤确实未死亡,此时往往已错过了放射治疗增量的最佳时机[14]。而CEUS-TIC曲线分析数值,能够较CECT早期即可做出疗效评价,并且能够对肿瘤内部的血供情况进行定量分析,为后续临床治疗方案做出相应的调整,使临床治疗达到很好的疗效。而多数SBRT治疗后常常引起胃肠道放射性水肿,引起胃肠道恶心、呕吐、食欲不振反酸等症状[15]。虽然徐雪晶等[16]研究显示在一定剂量范围内,不同累计剂量的患者不良反应发生率有差异,而Park等[17]研究认为,肿瘤照射剂量不足是影响原发性肝癌疗效的主要因素之一,所以临床可以通过超声造影TIC曲线较早做出疗效判断,并通过早期调整治疗方案来尽可能降低不良反应发生的风险,并提高肝癌治疗疗效。
4 结论
SBRT是一种无创、安全且有效的治疗肝癌的方法,因此在治疗恶性肿瘤时是一种可行的选择[18]。而超声利用定量分析方法不仅能够早于肿瘤大小变化做出疗效评价,也能优于CT对肝癌SBRT治疗后作出疗效评价。CEUS不仅能为肿瘤的治疗提供准确定位,还可显示肝癌立体定向放射治疗后治疗区的形态以及微循环信息,判断灭活范围及疗效,对肿瘤灭活不全或局部复发病灶可及时进行有针对性的补充治疗,不仅能提高临床的治疗效果,还能减少患者的不良反应发生率[19]。因超声造影方便快捷、价格低廉,且无辐射等优点,对于需要反复评估的患者能够减少患者负担,也可减少患者辐射等伤害。所以CEUS-TIC定量分析能够早期并准确的对肝癌SBRT治疗后疗效做出评价。