白术同源四倍体诱导及其快繁体系构建的探讨
2020-12-05黄燕芬姜金仲朱守引任佳欣
黄燕芬,2, 姜金仲,2, 朱守引, 赵 银, 任佳欣
(1.贵州师范学院生物科学学院, 贵阳 550018;2.贵州省生物资源开发利用特色重点实验室, 贵阳 550018)
白术(AtractylodesmacrocephalaKiodz)属菊科多年生草本植物[1],为我国特产药材之一,主产湖南、安徽等地,以根茎入药。近现代药理研究表明,白术主要含内酯类化合物、多糖和挥发油[2]。白术具有调节免疫、调节胃肠功能、抗衰老、利尿、扩张血管、抗炎、抑菌、镇静、降血糖等重要作用[3]。而目前我国白术中药材的栽培存在产量低下、品种迅速退化、药材质量逐年降低、有效成分含量不稳定等问题,优质白术药材在市场上供不应求。白术适宜在海拔高、阴凉的山地生长,不宜连作,需不断采取开荒的方式种植,这对自然植被的损坏很大,也造成了种植地生态环境的破坏。为改善这类状况,基于多倍体具有抗逆性强、巨型性、药用有效成分高等特点[4],利用人工诱导多倍体技术诱导培育多倍体白术种苗,一方面能够提高白术种植的经济效益,为白术人工培育提供较优质的种质资源,改变品种杂乱、质量低下的现状和防止病虫害的影响,另一方面能够使白术种植的环境成本降低,有效避免对自然植被的毁坏。此外,在药材生产应用上也具有很大的潜力。
1 材料与方法
1.1 材 料
白术试管播种快繁芽苗,保存于贵州省生物资源开发利用特色重点实验室,白术种子采自贵阳金实农业科技开发有限公司中药材种植基地。
1.2 方 法
1.2.1白术同源多倍体诱导及生根培养
1) 多倍体诱导单因素实验。选择对诱导白术同源四倍体有直接影响的因素,秋水仙素灭菌方式、秋水仙素浓度、诱导处理时间等,分别进行单因素试验,从芽苗成活率、芽苗变异率、四倍体诱导率等3方面考察其对白术多倍体苗诱导的影响。
2) 多倍体诱导正交实验设计。在单因素试验基础上,确定秋水仙素灭菌方式的条件下,对秋水仙素浓度X 1、诱导处理时间X 2进行考察,每个因素取3个水平,以芽苗存活率(%)、芽苗变异率(%)、四倍体诱导率(%)为试验指标,试验设计见表1。
3) 芽苗生根培养。选择经秋水仙素处理表现茎比较粗,叶片较厚且深绿的芽苗与二倍体芽苗一同转接于1/2 MS+0.5 mg·L-1NAA的生根培养基诱导生根,培养完整植株并获得染色体倍数鉴定材料。
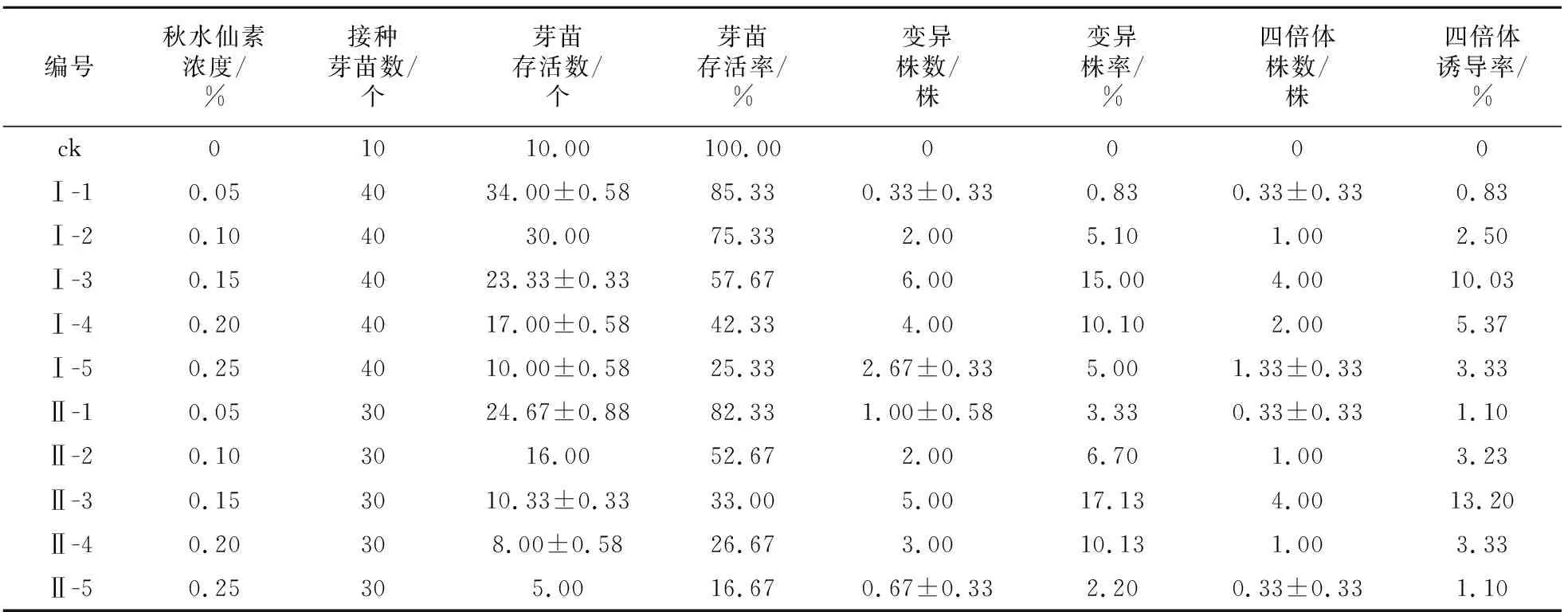
表2 秋水仙素不同灭菌方式及浓度对诱导白术多倍体的影响
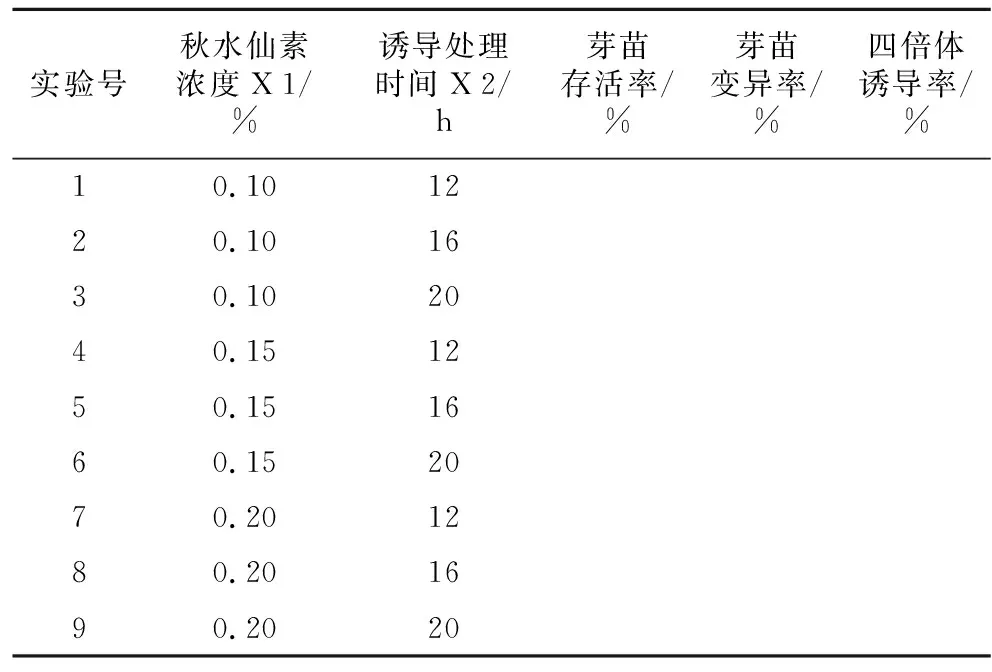
表1 白术同源多倍体诱导正交实验
1.2.2白术同源四倍体形态解剖学观察鉴定
参照汪卫星等[5]和姚焱等[6]的方法(稍有调整)进行鉴定。将白术二倍体和经诱导处理的多倍体无菌试管苗的叶片,分别置于卡诺氏固定溶液中(乙醇∶冰醋酸=3∶1)固定2~3 h后清洗干净,撕下叶片同一部位的下表皮于载玻片上展平,滴1滴1% I-KI溶液,制成临时装片。每张片子随机取5个视野观察气孔的大小及分布,统计叶片保卫细胞叶绿体数目,用显微测微尺随机测量10个气孔横径、纵径。以平均数比较,初步筛选同源四倍体试管苗。观察白术生根试管苗叶片的大小,茎的粗细,叶片厚度和颜色,并与白术二倍体试管苗做对比。
1.2.3白术同源四倍体细胞学鉴定
待二倍体苗和通过形态解剖鉴定筛选出的诱导苗根长至1~2 cm长时,参照向增旭等[7]和聂杨眉等[8]的方法,分别将其根尖切下,放入浓度为0.002 mol·L-1的8-羟基喹啉溶液中进行预处理,温度为10~20 ℃。处理4 h后,洗干净放入卡诺氏固定液中固定24 h。之后用蒸馏水洗净放入0.075 mol·L-1KCl溶液中前低渗处理20~30 min,再放入0.2 mol·L-1HCl溶液中水浴解离5~10 min,温度60 ℃,然后浸泡在蒸馏水中,低渗处理30 min,之后将根尖制成临时装片用显微镜观察,统计染色体数量。
1.2.4白术同源四倍体植株扩繁及生根
通过形态解剖观察鉴定和细胞染色体数量鉴定,初步筛选出同源四倍体试管苗。将其在无菌条件下切成单芽,接种于MS基本培养基附加6-BA 0.5 mg·L-1、1 mg·L-1、1.5 mg·L-1,NAA 0.1 mg·L-1、0.2 mg·L-1、0.3 mg·L-1,IBA 0.2 mg·L-1、0.4 mg·L-1、0.6 mg·L-1的增殖培养正交实验设计培养基中培养,观察记录增殖倍数、增殖周期、芽苗生长情况。待增殖培养结束,从中选择壮苗接种于上述生根培养基中诱导长根,获得完整再生植株。
1.3 培养条件
培养温度(24±1)℃;相对湿度75%~85%;每天光照时间16 h;光照度1 500~2 000 lx。
2 结果与分析
2.1 白术多倍体诱导
2.1.1秋水仙素不同灭菌方式、浓度、处理时间对白术幼芽四倍体诱导率的影响
从表2和表3可以看出,高压和抽滤灭菌的秋水仙素溶液处理的白术幼芽的存活率均存在随着秋水仙素溶液浓度的升高而降低的趋势。当秋水仙素处理浓度为0.15%时,2种灭菌方式的四倍体诱导率均达最高,且抽滤灭菌秋水仙素溶液处理的四倍体诱导率比高压灭菌秋水仙素溶液处理提高2.9%;2种灭菌方式的秋水仙素溶液处理幼芽,随着处理时间加长,毒害加重存活率逐渐降低,而诱导率则呈先逐渐升高随后逐渐降低的趋势。当处理时间为16 h时,2种灭菌方式的诱导率均达最高,分别为7.83%和10.23%,抽滤灭菌明显高于高压灭菌。综合考虑确定以抽滤灭菌为诱导白术四倍体的秋水仙素最佳灭菌方式,正交实验秋水仙素溶液诱导浓度选择0.1%,0.15%,0.2%,处理时间选择12 h,16 h,20 h。

图1 二倍体试管植株与同源四倍体试管植株
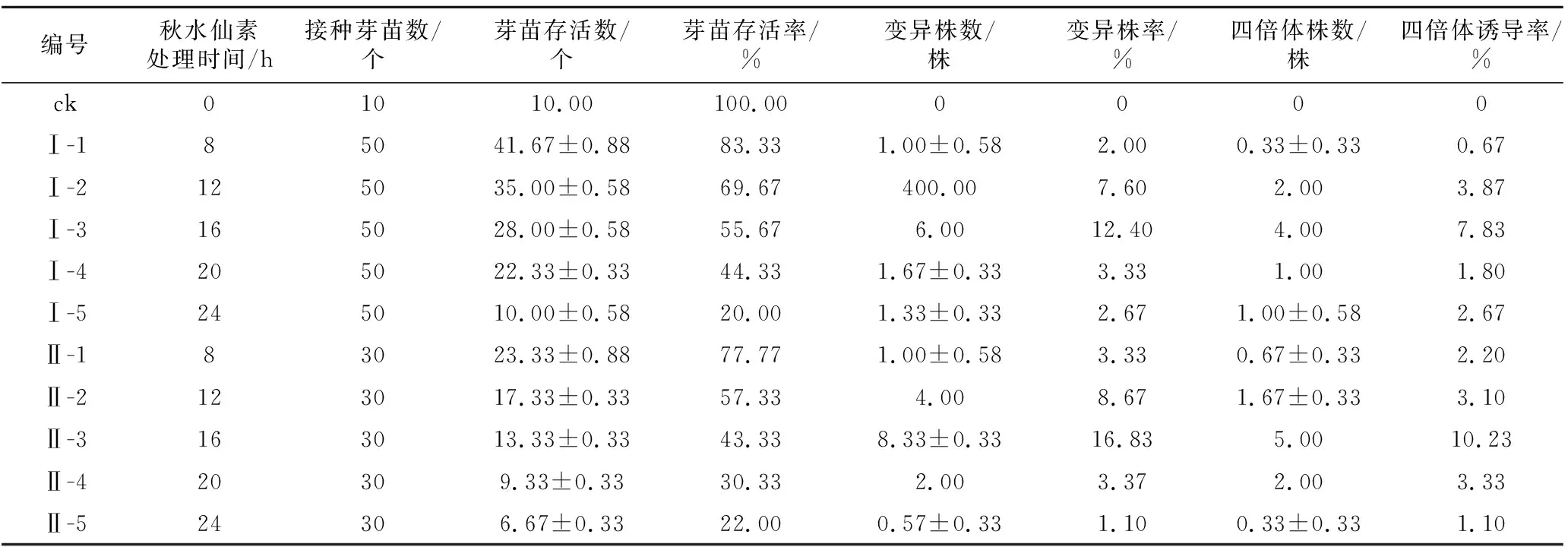
表3 秋水仙素不同灭菌方式及处理时间对诱导白术多倍体的影响
2.1.2抽滤灭菌秋水仙素溶液处理芽苗正交试验结果
由表4结果可知,抽滤灭菌方式处理秋水仙素溶液后,秋水仙素的浓度为主要影响白术幼芽的存活率和四倍体诱导率的因素,处理时间次之;处理时间为影响白术幼芽变异率的主要因素。综合分析存活率、变异率和四倍体诱导率结果,得到秋水仙素的浓度和处理时间的组合是X12X22,即秋水仙素处理浓度为0.15%,最佳处理时间16 h。
2.2 形态学鉴定
2.2.1白术二倍体与同源四倍体植株的形态特征比较
如图1,观察得出白术二倍体植株与同源四倍体植株在形态上表现出明显的差异,白术二倍体植株苗小,叶片薄且小,叶色较浅,叶片锯齿少;
白术四倍体植株茎粗,叶片大且厚,叶片褶皱,锯齿多,呈深绿色,初步显示出了四倍体植株巨型性的特征。
2.2.2二倍体和四倍体的气孔大小和叶绿体数量
由表5可以看出,白术四倍体植株气孔的纵径、横径、面积分别为白术二倍体植株的1.4倍、1.6倍、2.2倍。二倍体植株的气孔明显比四倍体植株的小,但其气孔分布多,白术二倍体植株叶片平均每视野气孔个数是四倍体植株的2.3倍;白术四倍体植株叶片保卫细胞叶绿体数目是二倍体的1.9倍。二者显现出很明显的差异,见图2。
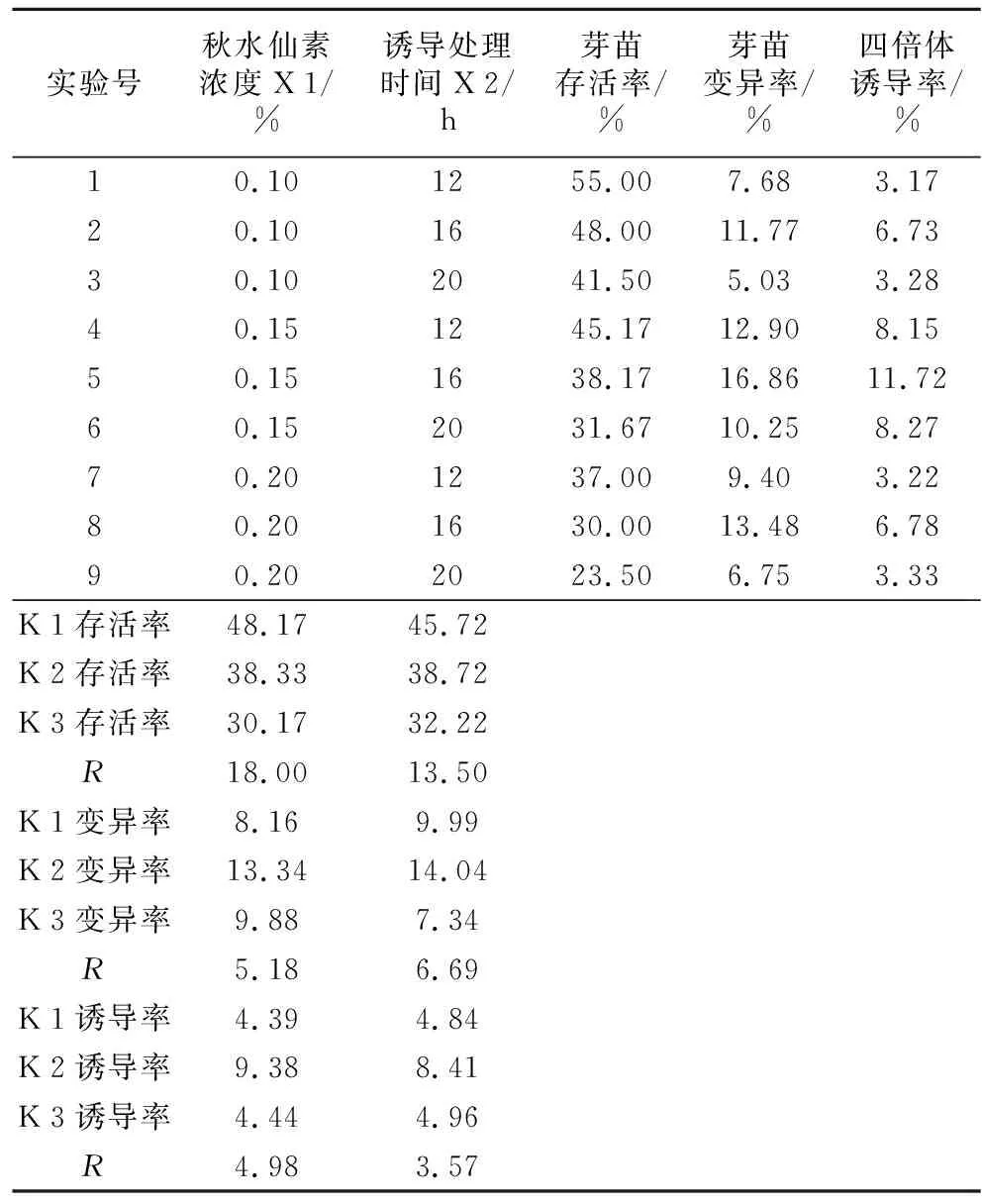
表4 抽滤灭菌秋水仙素溶液处理芽苗正交试验结果
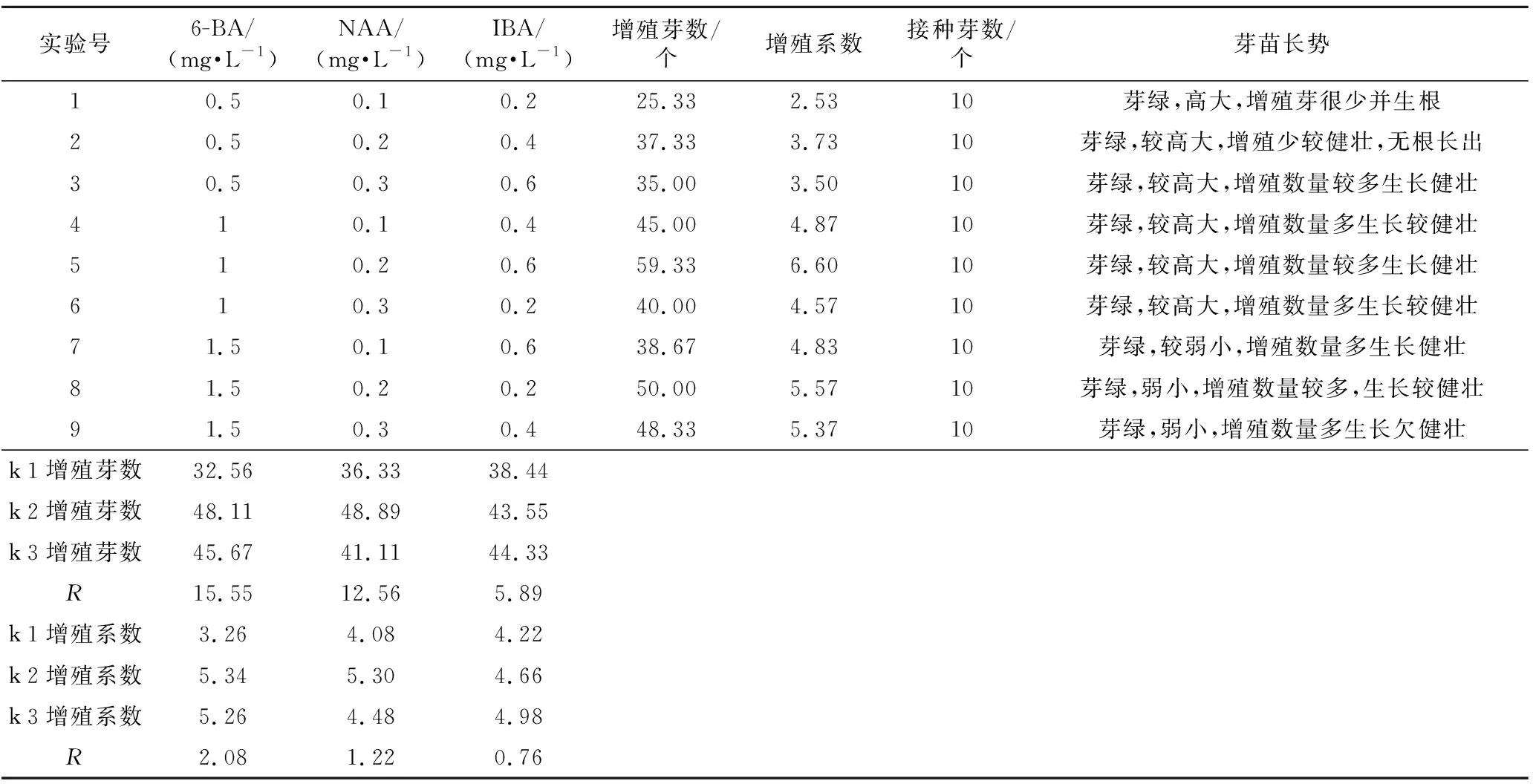
表6 不同植物激素配比对白术增殖的影响正交实验结果
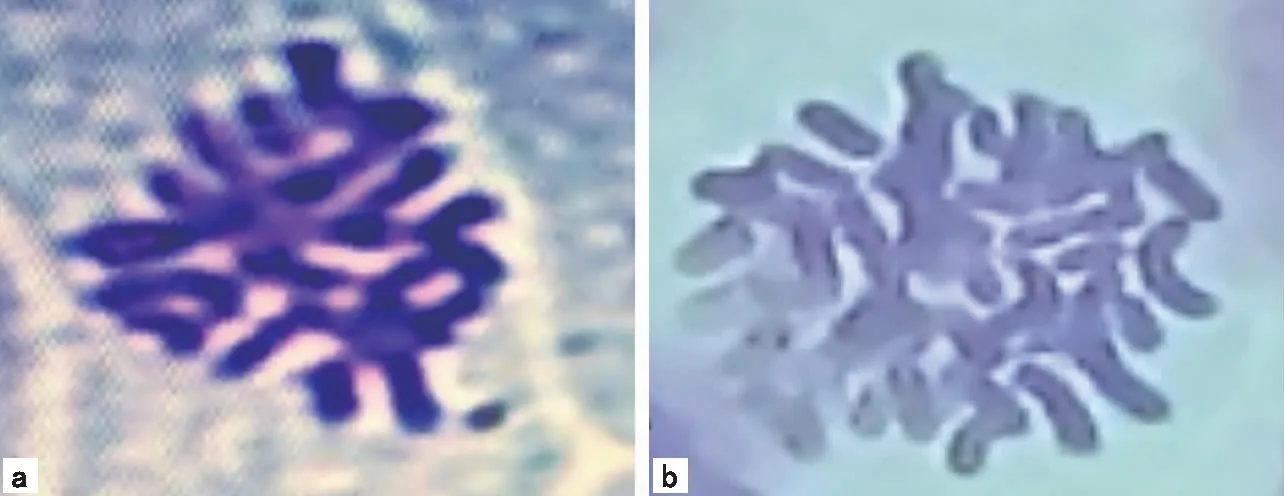
注:a为二倍体染色体(10×100倍);b为四倍体染色体(10×100倍)。图3 白术试管植株染色体
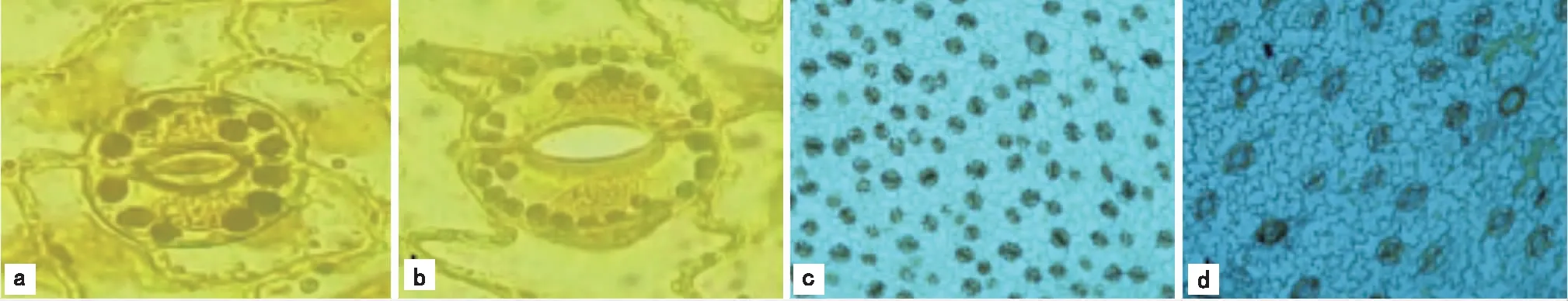
注:a为二倍体叶片保卫细胞叶绿体(10×100倍);b为四倍体叶片保卫细胞叶绿体(10×100倍);c为二倍体叶片气孔分布(10×10倍);d为四倍体叶片气孔分布(10×10倍)。 图2 白术二倍体与同源四倍体试管植株叶片气孔
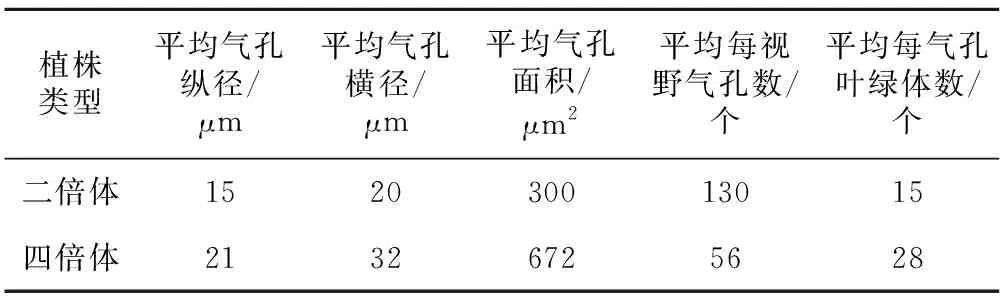
表5 气孔大小和叶片气孔保卫细胞叶绿体数量
2.3 细胞学鉴定
在显微镜下观察根尖制成的临时装片结果如图3:白术二倍体植株的染色体条数为2 n=2 x=24,经初步形态鉴定为四倍体的植株染色体条数为2 n=4 x=48。与程心旻等[9]的研究结果一致。
2.4 同源四倍体快繁体系的建立
预实验中接种在不同激素的MS培养基上的芽苗培养20 d后,发现其增殖率不同,6-BA浓度低于0.5 mg·L-1或者NAA浓度低于0.1 mg·L-1时增殖效果差,且增殖苗比较弱小,而6-BA浓度高于2 mg·L-1时增殖率反而降低,由此可见6-BA和NAA的浓度过高或者过低都会使白术的增殖率受影响。由正交实验结果(表6)看出,白术试管苗的增殖培养,6-BA的影响最大,其次是NAA,IBA的作用较弱。综合分析增殖芽数和增殖系数的实验结果,可以得到最佳增殖培养基激素组合是6-BA 1 mg·L-1+NAA 0.2 mg·L-1+IBA 0.6 mg·L-1。白术试管苗在此培养基上增殖倍数最大,芽苗长势良好,增殖效果最佳,可以此指标建立同源四倍体快繁体系。
3 小结与讨论
乔永刚等[10]和王朝梁等[11]发现,党参和三七加倍后出现叶片变大、变厚、叶色加深等特性。本实验中获得的同源四倍体白术试管植株也有类似特征,白术同源四倍体试管植株的形态特征与二倍体植株存在明显的差异;白术同源四倍体试管植株叶片的气孔密度、保卫细胞的叶绿体数量和面积与二倍体相比存在显著的差别;染色体鉴定结果白术二倍体植株的染色体数为2 n=2 x=24,四倍体植株染色体为2 n=4 x=48。
对诱变的多倍体进行倍性鉴定是获得四倍体的重要环节。形态特征鉴定只能是作为初步确定,必须结合染色体计数才能作为真实倍性的确定依据。目前较为流行的流式细胞仪倍性鉴定技术操作简单、快速,可减少细胞学鉴定的工作量,但存在一定的假阳性,且费用较高。本实验结合试管植株的形态、气孔特征、染色体数量等3个方面对白术四倍体进行了鉴定,染色体倍数鉴定仍采用传统的压片法。
秋水仙素是一种被广泛应用的动植物多倍体诱导剂,对于植物微管蛋白的亲合性要低于对动物微管蛋白的亲合性[12]。本研究虽较成功地获得了秋水仙素诱导白术同源四倍体的实验结果,但仍希望进一步探寻一些更适合白术同源四倍体诱导的多倍体诱导程度高、用量少、药害轻的诱导剂,如某些除草剂、微管抑制剂等,以提升白术同源四倍体的诱导效益。
