响应面优化略阳黄精组培快繁技术
2020-12-05欣1豆佳媛马存德3琪1彭修娟
赵 欣1, 豆佳媛, 马存德3, 王 琪1, 彭修娟
(1.陕西国际商贸学院医药学院, 陕西 咸阳 712046;2.陕西国际商贸学院中药研究院, 陕西 咸阳 712046;3.陕西步长制药有限公司, 西安 710075)
略阳黄精,百合科黄精属(Polygonatum)多年生草本植物,产于陕西省汉中市略阳县,2017年被评为中国国家地理标志产品。其根茎呈结节状弯柱形,单节鸡头状,肉质油润,色泽黄褐透亮,断面透明,味甜筋少[1]。含有黄精多糖、皂苷、生物碱、维生素、氨基酸、黄酮及蒽醌类化合物、木脂素及微量元素等多种物质,是我国传统的大宗药材,具有补气养阴、健脾、润肺、益肾、抑制肿瘤细胞、延缓衰老、降血糖血脂、抗病毒、消炎等功效[2-4]。兼具食用、药用和观赏价值,也是规模化、工业化生产药品、保健品的重要原料,具有广阔的开发利用前景[5,6]。
黄精的自然繁殖方式有2种:有性繁殖(种子繁殖)和无性繁殖(根茎芽繁殖),在自然条件下黄精种子发芽率低,育苗周期长且收集难度大,采用自然繁殖手段生产效率低,无法满足市场的需求[7]。随着组培快繁技术的发展,建立略阳黄精的组培快繁技术体系,利用组织培养方式快速育苗,可有效解决种苗供不应求的问题[8,9]。黄精组培快繁过程中的关键点就是培养基,培养基是否合适会影响黄精愈伤组织形成、不定芽增殖以及生根率等。吴宇函等[10]报道,在培养基中添加6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)、2,4-二氯苯氧乙酸(2,4-D)、吲哚丁酸(IBA)、吲哚乙酸(IAA)等激素,可以显著提高增殖率和生根率。常用的激素主要有细胞分裂素和生长素两大类,其中细胞分裂素影响细胞的分裂、生长和分化,而生长素诱导刺激细胞分裂和根的分化,二者以不同浓度的配合使用,可以达到诱导分生苗增殖、促进组培苗生长以及诱导根的形成的目的[11,12]。
关于略阳黄精的研究仅限于资源调查方面,组培方面的研究较少[13]。因此,本实验在前人研究的基础上,开展略阳黄精组培技术研究。通过响应面法优化组培过程中初代培养基、不定芽诱导培养基及生根培养基的配方,筛选出适合略阳黄精组培苗各个阶段生长的最适培养基,优化略阳黄精的组培快繁技术体系。
1 材料与方法
1.1 实验材料
略阳黄精根茎芽取自陕西省汉中市略阳县,4—6月选取当年生、生长健壮、无病虫害的植株。
1.2 实验方法
1.2.1外植体预处理及消毒
预处理:将外植体用洗洁精(5%,w/w)溶液浸泡30 min,然后用流水冲洗30 min,清洗干净后,切成1 cm×1 cm的带芽根茎,加入0.5 g·L-1多菌灵处理12 h。
接种前表皮消毒:将预处理后的外植体转移至无菌超净工作台中并进行如下操作:75%的酒精浸泡30 s→无菌水冲洗3遍→0.2%的HgCl2浸泡6 min→无菌水冲洗3遍→10%的NaClO浸泡5 min→无菌水冲洗3遍→取出用无菌滤纸吸干水分,将与HgCl2接触的切面部分切掉,接种到MS培养基上进行培养[14]。
1.2.2根茎芽的初代培养
将预处理及消毒后的黄精根茎芽转接到初代培养基中,培养基为MS+30 g·L-1蔗糖+5.0 g·L-1琼脂粉,同时添加不同浓度组合的植物激素6-BA、NAA和TDZ[15],每个处理接种40个,每瓶接种3个,3次重复,45 d后观察并统计萌发率,采用响应面优化实验筛选出适合黄精根茎芽的最佳初代培养基。
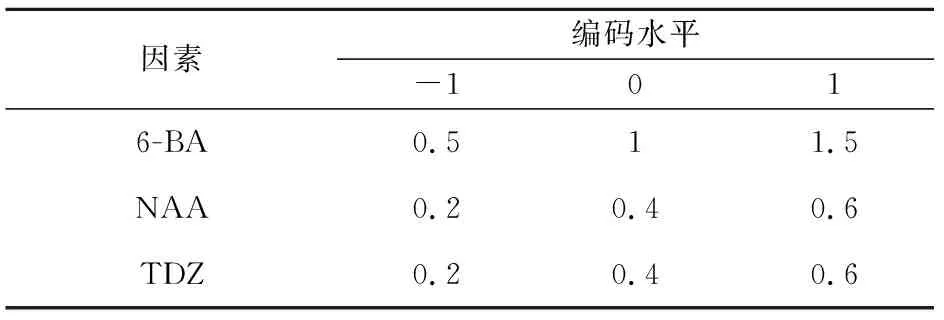
表1 响应面组合因素水平
1.2.3不定芽的诱导培养
将萌发后的健壮根茎芽转接到诱导培养基中,培养基为MS+30 g·L-1蔗糖+5.0 g·L-1琼脂粉,同时添加不同浓度组合的植物激素6-BA、NAA和2,4-D[16],每个处理接种30个,每瓶接种3个,3次重复,45 d后观察并统计不定芽的分化数,采用响应面优化实验筛选出适合黄精不定芽分化的最佳培养基。

表2 响应面组合因素水平
1.2.4生根培养
将粗壮无根苗接入生根培养基中培养,培养基为1/2 MS+15 g·L-1蔗糖+5.0 g·L-1琼脂粉,同时添加不同浓度组合的植物激素IBA、NAA和AC[18],每个处理接种30株,45 d后统计生根率,采用响应面优化实验筛选出略阳黄精最佳生根培养基。
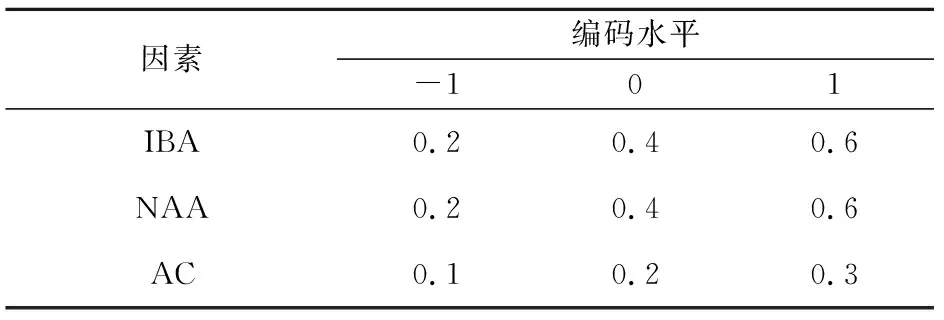
表3 响应面组合因素水平
1.2.5培养基及培养条件
以上培养基均调pH至5.8~6.0,在121 ℃下灭菌20 min。组培室培养温度除生根暗处理外均是(25±2)℃,光照强度控制在1 600~2 000 lx之间,连续光照每天16 h,湿度控制在70%左右。
1.3 统计方法
萌发率(%)=(萌发个数/接种个数)×100%;
不定芽平均个数=诱导出的所有不定芽数/接种个数;
生根率(%)=(生根苗数/接种苗数)×100%。
1.4 数据处理
采用Design Expert(Version 8.0)软件进行作图,采用SPSS(Version 17.0)软件进行统计学分析。
2 结果与分析
2.1 初代培养
2.1.1响应面优化设计与结果
在Version 8.0软件中以Box-Behnken中心组合原则进行设计,以6-BA、NAA、TDZ添加量为自变量,黄精萌发率为响应值,设计三因素三水平响应面优化试验,结果见表4。对表4中实验数据进行二次多项式逐步回归拟合,得回归模型方程如下:
Y=30.88+2.64a+1.09b+1.05c-1.20ab+0.63ac-0.83bc+3.01a2+1.36b2+2.19c2
2.1.2回归模型方差分析
方差分析及相关系数可以评价模型的可靠性。由表5可知,模型F值为29.78,所得培养基配方萌发率的回归方程极显著(p<0.000 1);失拟项F值为5.60(p>0.05),所以该模型可以对初代培养基配方进行准确的预测和分析。R2=97.45%,说明萌发率的变化有97.45%来源于6-BA、NAA和TDZ添加量。方差分析结果显示:一次项和二次项都有显著性因素,其中a、b、c、ab、a2、b2、c2显著,说明3种因素对萌发率具有显著影响,对萌发率的贡献大小依次为6-BA>NAA>TDZ。可以使用该回归模型确定最佳初代培养基配方。
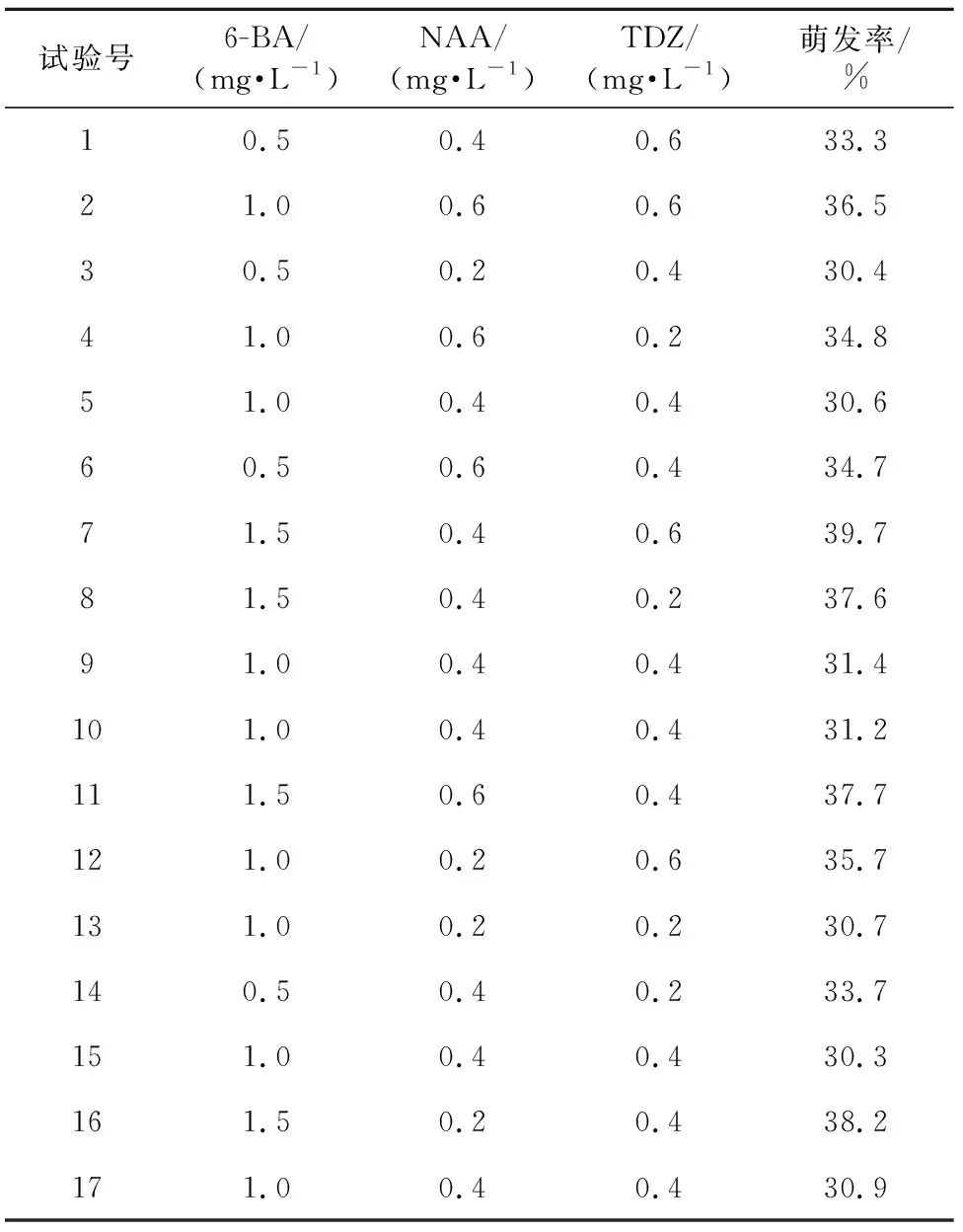
表4 Box-Behnken实验方案及实验结果
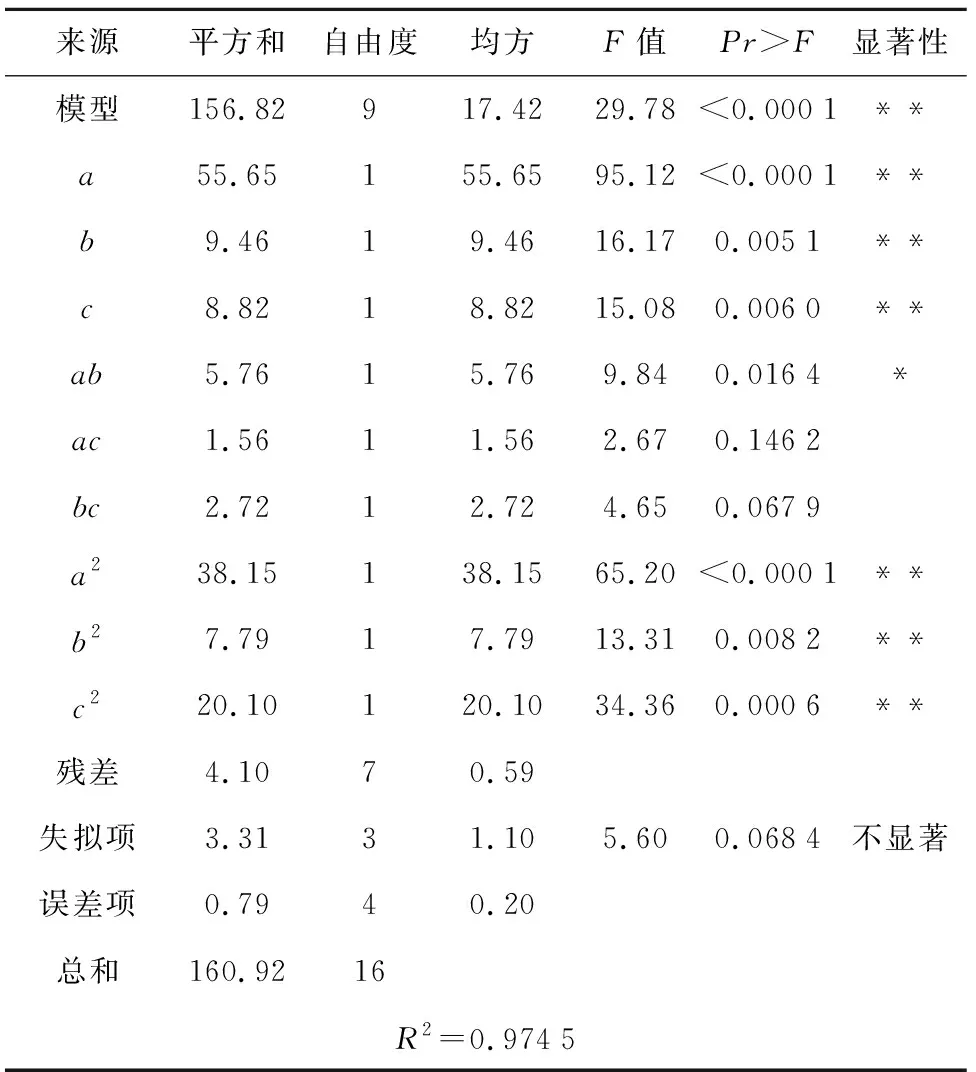
表5 回归模型方差分析
2.1.3响应面分析
由图1可知,在NAA添加量较少时,萌发率随着
6-BA添加量增加呈升高趋势,随着NAA添加量逐渐增加,萌发率随6-BA添加量变化趋势逐渐变缓。在6-BA添加量较低时,其萌发率随NAA添加量增加呈升高趋势,随着6-BA添加量逐渐增高,其萌发率变化幅度越来越小。由方差分析可知,两者对黄精萌发率影响显著,与其相对应的等高线形状为椭圆形。结果表明,6-BA和NAA添加量交互作用显著。根据实验所得回归方程,得到初代培养基最佳配方为:6-BA添加量1.49 mg·L-1,NAA添加量0.31 mg·L-1,TDZ添加量0.60 mg·L-1,由回归方程预测在此条件下萌发率为40.8%。
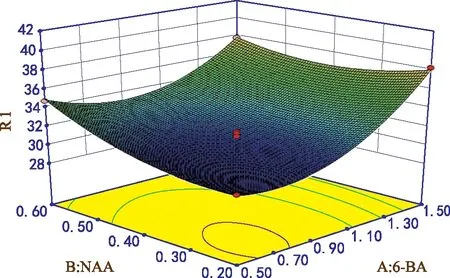
图1 6-BA和NAA添加量对萌发率的影响
2.2 不定芽的诱导培养
2.2.1响应面优化设计与结果
在Version 8.0软件中以Box-Behnken中心组合原则进行设计,以6-BA、NAA、2,4-D添加量为自变量,平均不定芽个数为响应值,设计三因素三水平响应面实验,结果见表6。将表6实验数据进行二次多项式逐步回归拟合,得回归模型方程为:
Y=3.19+0.35a+0.18b+0.36c+0.023ab-0.17ac+0.028bc+0.48a2-0.12b2-0.19c2
2.2.2回归模型方差分析
由表7可知,所得模型F值为21.81,平均不定芽个数的回归方程极显著(p<0.0001);失拟项F值为5.06(p>0.05),该模型可以对不定芽诱导培养基配方进行准确的预测和分析。R2=96.56%,说明平均不定芽个数的变化有96.56%来源于6-BA、NAA和2,4-D添加量。方差分析结果显示,一次项和二次项都有显著性因素,其中a、b、c、ac、a2、c2显著,3种因素对平均不定芽个数具有显著影响,对不定芽诱导的贡献大小依次为2,4-D>6-BA>NAA。可以利用响应面回归方程确定最佳不定芽诱导培养基配方。
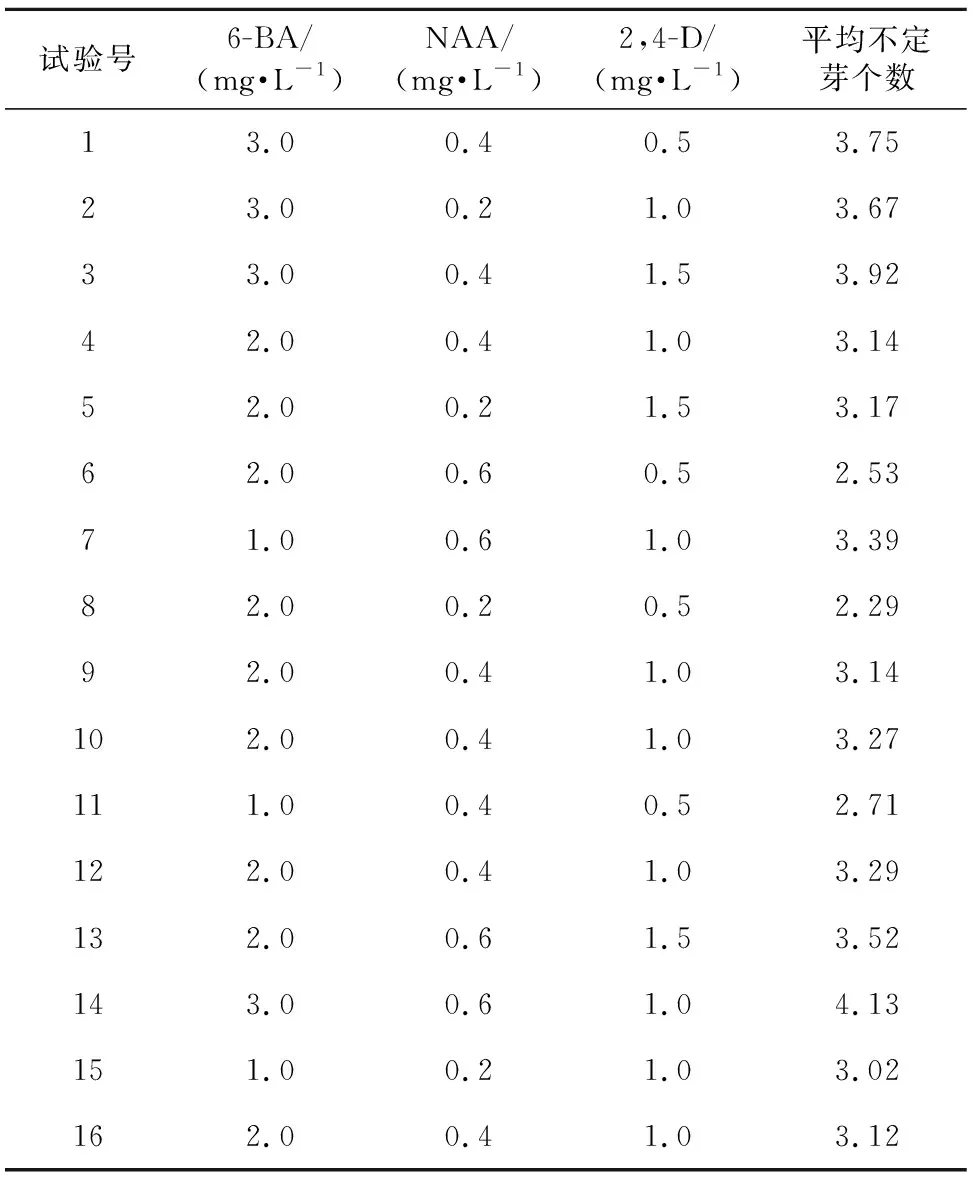
表6 Box-Behnken实验方案及实验结果
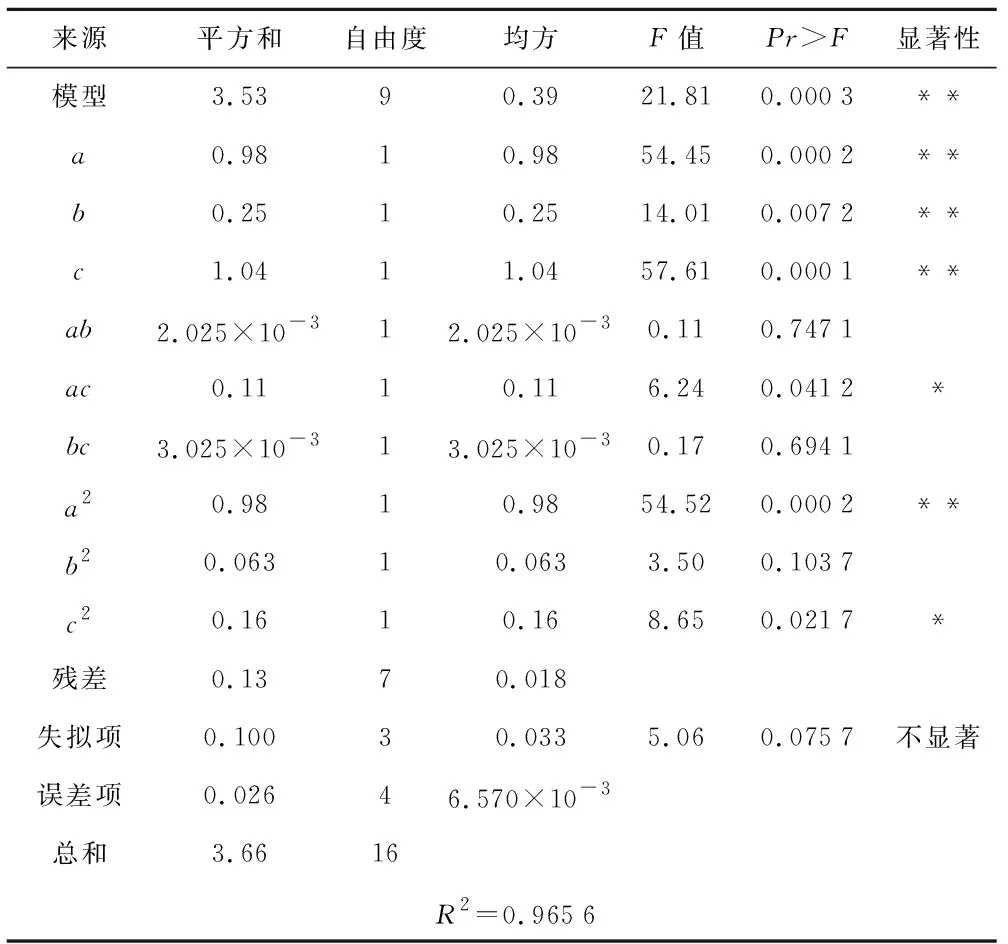
表7 回归模型方差分析
2.2.3响应面分析
由图2可知,无论6-BA添加量处于何种水平,平均不定芽诱导个数随着2,4-D添加量增加呈升高趋势,无论2,4-D处于何种水平,平均不定芽诱导个数随着6-BA添加量增加先保持不变后缓慢增加。由方差分析可知,两者交互作用对不定芽诱导影响显著。细胞分裂素6-BA与生长素配合对不定芽分化的促进作用优于单独使用。
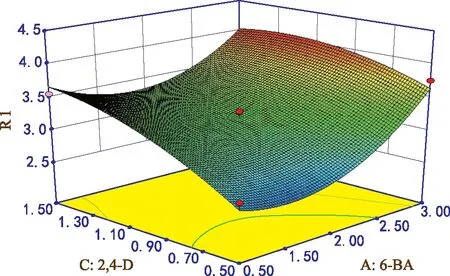
图2 6-BA和2,4-D添加量对不定芽诱导的影响
根据所得模型方程,得到不定芽诱导培养基的最佳配方为:6-BA添加量3.00 mg·L-1,NAA添加量0.49 mg·L-1,2,4-D添加量1.26 mg·L-1,由回归方程预测在此条件下平均不定芽个数为4.14个。在该条件下实际测定平均不定芽个数达4.02个,因此该模型可以很好的反映不定芽诱导培养基的最佳配比。
2.3 生根培养
2.3.1响应面优化设计与结果
在Version 8.0软件中以Box-Behnken中心组合原则进行设计,以IBA、NAA、AC添加量为自变量,生根率为响应值,设计三因素三水平响应面试验,结果见表8。采用软件对实验数据进行二次多项式逐步回归拟合,得回归模型方程为:
Y=87.12+2.41a+1.29b+1.33c+0.55ab+0.13ac-0.025bc+1.41a2-1.09b2+0.09c2
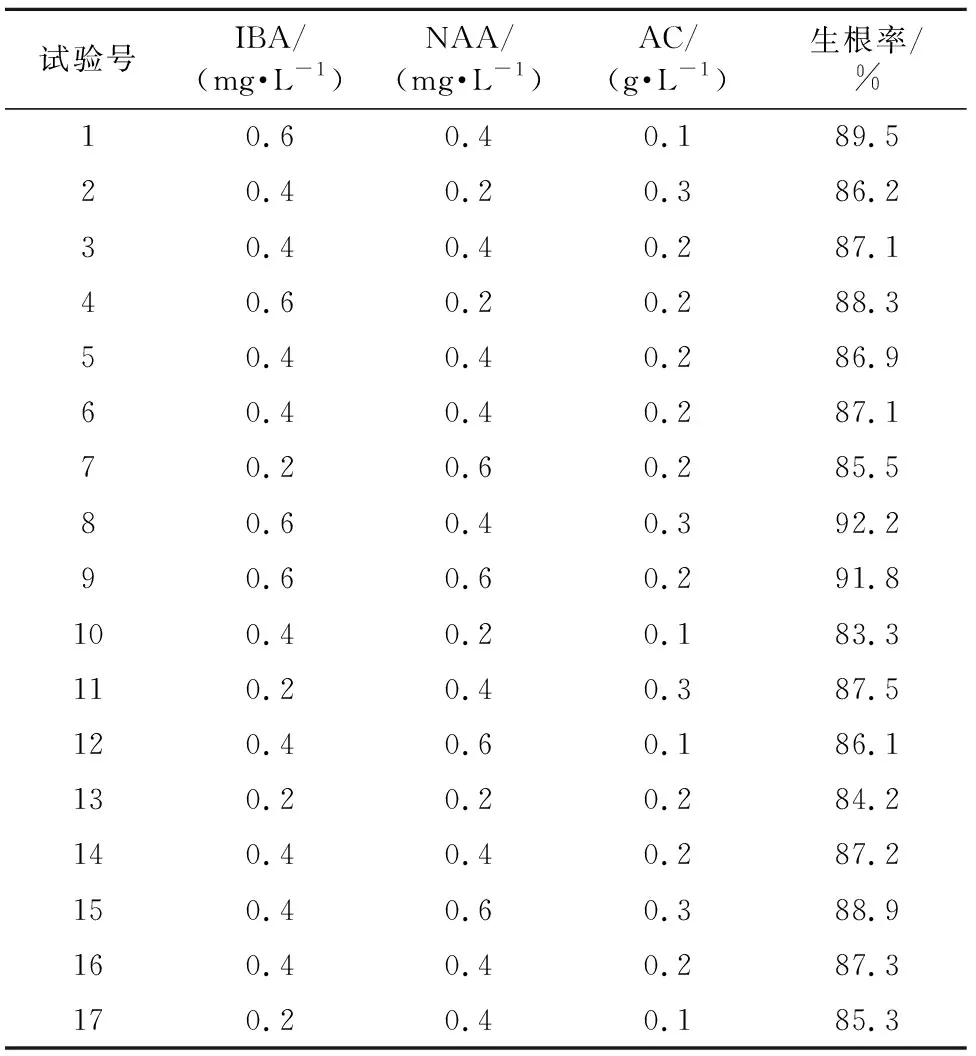
表8 Box-Behnken实验方案及实验结果

注:a和b分别代表不定芽诱导阶段的对照组和优化组,c和d分别代表生根培养阶段的对照组和优化组。 图4 略阳黄精组培苗生长趋势
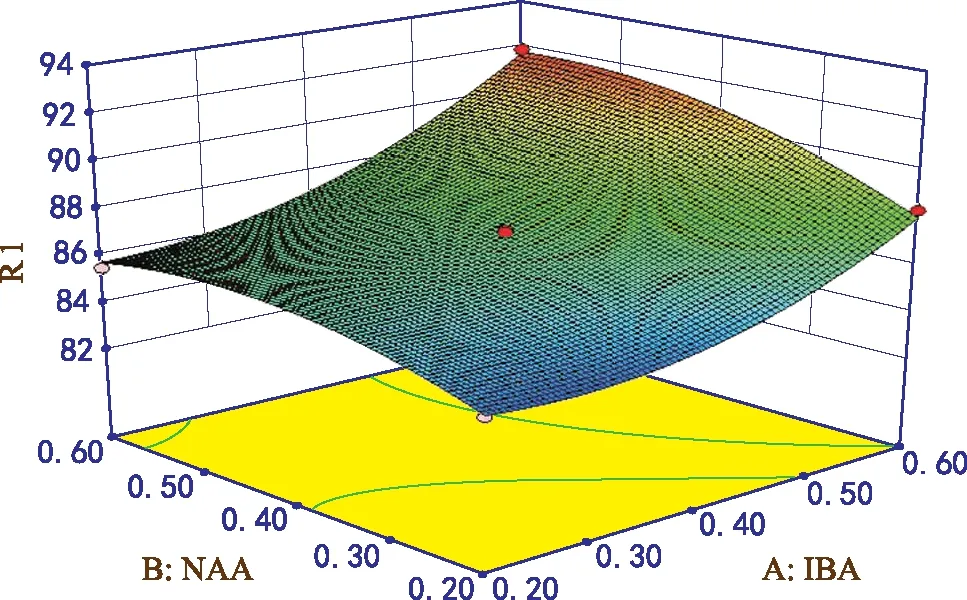
图3 IBA和NAA添加量对生根率的影响
2.3.2回归模型显著性分析
由表9可知,模型F值为133.97,所得生根培养基配方生根率的回归方程极显著(p<0.0001);失拟项F值为6.40(p>0.05),该模型可以对生根培养基配方进行准确的预测和分析。R2=99.42%,说明生根率的变化有99.42%来源于IBA、NAA和AC添加量。方差分析结果显示:一次项和二次项都有显著性因素,其中a、b、c、ab、a2、b2显著,3种因素对生根率具有显著影响,对生根率的贡献大小依次为IBA>AC>NAA。可以利用回归方程确定最佳生根培养基配方。
2.3.3响应面分析
由图3可知,无论NAA添加量处于何种水平,生根率随着IBA添加量增加呈升高趋势;在IBA含量较低时,生根率随NAA添加量增加变化不大,随着IBA含量逐渐升高,生根率随NAA添加量增加升高趋势越来越明显。由方差分析可知,两者交互作用对生根率影响显著。
根据所得模型方程,得到生根培养基的最佳配方为:IBA添加量0.60 mg·L-1,NAA添加量0.59 mg·L-1,AC添加量0.24 g·L-1,由回归方程预测在此条件下萌发率为92.3%。在该条件下实际测定培养基生根率的平均值达91.5%,因此该模型可以很好的反映生根培养基的最佳配比。
3 讨论与结论
图4为培养基优化前后略阳黄精组培苗生长趋势,对照图中a/b和c/d可以明显看出,优化培养基后平均不定芽个数和生根率明显升高。优化后的初代培养基能够使黄精萌发率平均值达39.5%,与直接处理黄精种子并接种到MS培养基中(测定出多花黄精发芽率仅为27.6%)[18]相比,添加了细胞分裂素和生长素的初代培养基会显著增加黄精萌发率。影响组培苗生根的因素有很多,激素种类和浓度、培养基类型、蔗糖浓度、光照、浸蘸浓度以及一些附加物等,其中激素种类和浓度以及培养基类型影响最大[19]。生长素对不定根的形成具有诱导作用,不同种类的生长素诱导效果在不同的植物中表现不同,生长素IBA和NAA对不定根的诱导比较稳定,且在多种植物中IBA对不定根的诱导作用效果较好[20]。而培养基中加入活性炭(AC)可使根变得更加粗壮,苗的长势也更加健壮,陆静等报道,通过在培养基中添加NAA 1.0 mg·L-1+IBA 0.2 mg·L-1+AC 0.2 g·L-1,生根率达89%[21]。高浓度无机盐会使组培苗根少,粗又短,且为黄色,不利于组培苗生根[22]。因此,一般不用完全MS诱导生根,而是将大量元素适当减少,其它如微量、有机等元素保持不变。
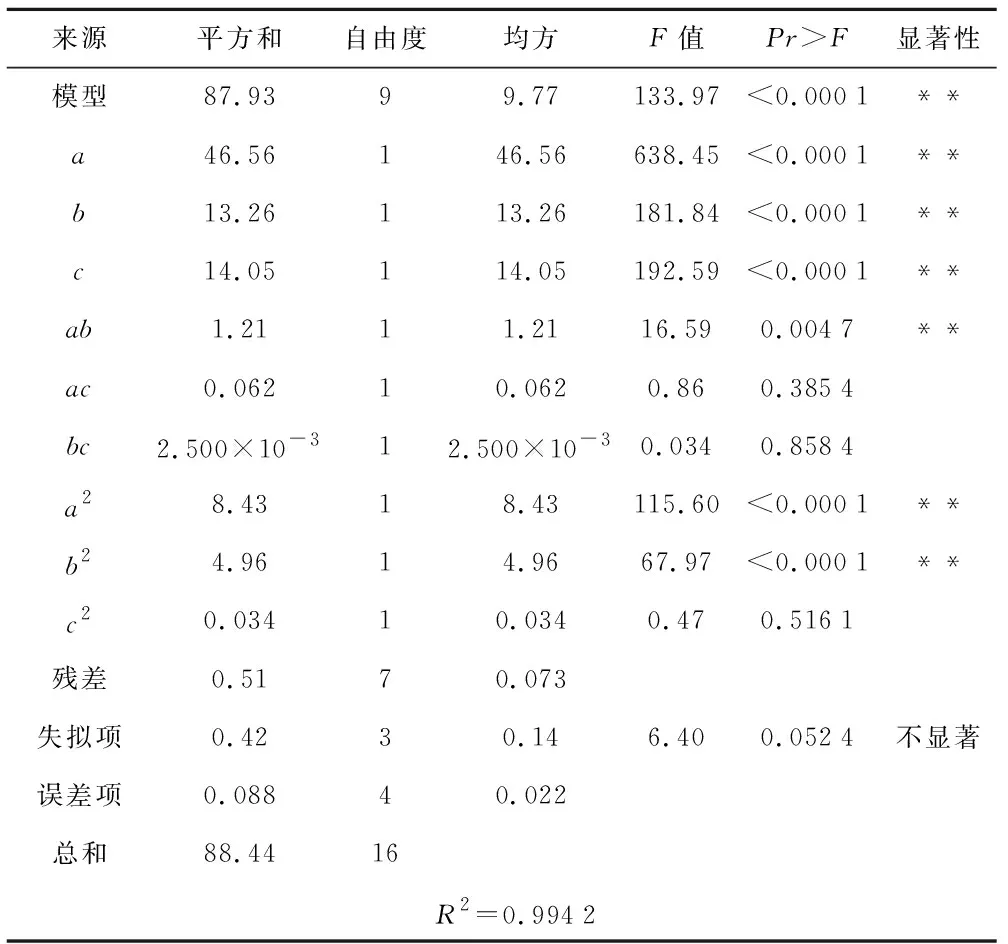
表9 回归模型方差分析
本研究通过比较细胞分裂素(6-BA、IBA、TDZ)和生长素(NAA、2,4-D、AC)不同浓度配比对略阳黄精组培苗不同生长阶段的影响,并通过响应面优化实验对培养基配方进行优化,得出最适初代培养基为MS+30 g·L-1蔗糖+5.0 g·L-1琼脂粉+1.49 mg·L-16-BA+0.31 mg·L-1NAA+0.60 mg·L-1TDZ,萌发率平均值达39.5%;最适不定芽诱导培养基为MS+30 g·L-1蔗糖+5.0 g·L-1琼脂粉+3.00 mg·L-16-BA+0.49 mg·L-1NAA+1.26 mg·L-12,4-D,平均不定芽个数达4.02个;最适生根培养基为1/2 MS+15 g·L-1蔗糖+5.0 g·L-1琼脂粉+0.60 mg·L-1IBA+0.59 mg·L-1NAA+0.59 mg·L-1AC,生根率的平均值达91.5%。随着黄精市场需求的持续旺盛,陕西略阳地区分布的野生黄精资源蕴藏量下降严重,目前国内外对略阳黄精规范化快速繁殖栽培技术的相关报道极少,因此开发略阳黄精组培快繁技术具有重要的应用价值,但关于不同激素配比上的组合实验,以及不同生长阶段的组合实验上有待于得出一个更好的、更加经济的优化配方。
