EMS诱变对晋谷21号种子萌发的影响
2020-12-05
(山西省农业科学院谷子研究所/特色杂粮种质资源发掘与育种山西省重点试验室, 山西 长治 046011)
谷子(Setariaitalica(L.)Beauv.)是重要的区域性特色杂粮作物,抗旱耐瘠薄,水分利用率高,是应对未来水资源短缺的战略储备作物。谷子营养丰富,含有包括维生素B 1、叶酸、钙、铁、锌、硒等45种人体必需的营养成分,被誉为“天然全价植物营养师”。谷子是二倍体作物,基因组较小,适宜作为C4植物功能基因组研究的模式作物。谷子与水稻、小麦等主要作物相比,生产投入小,基础研究相对薄弱,目前尚无可供利用的突变体库,而构建突变体库是研究谷子功能基因最直接最有效的方法。
构建作物丰富多样的突变体库是研究其功能基因组学的重要基础。甲基磺酸乙酯(EMS,ethyl methane sulfonate)作为诱变剂获得突变体,具有诱变效率高、操作简便、后代遗传稳定等多重优点,是理想的诱变方法[1]。EMS突变体库的构建在玉米、水稻、小麦、大白菜、芸豆、苜蓿等多种作物[2-4]中均有报道。有关谷子EMS诱变的研究较少,Gupta等[5]1975年利用γ射线加0.1% EMS、0.1% DES诱变谷子叶绿素突变体,研究发现,0.1% EMS诱变谷子24 h,M1植株突变率为15.3%,M2植株突变率为4.58%;24 h处理的谷子M1植株突变率明显高于6 h、12 h和18 h处理。李伟等[6]采用裂区实验,设置不同浓度和时间梯度处理豫谷1号种子,发现豫谷1号的适宜诱变条件为清水浸种过夜,1.0% EMS处理8 h。王军等[7]分别用0.8%和1.0%的EMS诱变长农35号,明确了1.0% EMS处理长农35号可产生更多的突变单株。
晋谷21号因品质优良、适口性好,外观品质佳,已成为山西省的主栽品种,但晋谷21号受白发病困扰已久,本试验选用晋谷21号种子作为EMS诱变的试验材料,探讨不同处理浓度及时间对种子萌发、胚根伸长及成苗的影响,旨在揭示EMS不同处理浓度对晋谷21号种子萌发的影响,筛选出最适的诱变条件,同时探究EMS对种子植株产生的影响,为后期谷子EMS抗病突变体库的建立及优良品种的筛选提供参考。
1 材料与方法
1.1 材料与试剂
供试材料为山西省优良谷子品种晋谷21号成熟种子,由山西省农业科学院谷子研究所提供;EMS(M 0880-5 G)购自上海生工,由美国Sigma公司生产,以1×磷酸缓冲液(0.01 mol·L-1PBS溶液,pH=7.2)的稀释配制。以5%硫代硫酸钠(Na2S2O3)作为终止和解毒剂,化学试剂均为分析纯试剂。
1.2 试验方法
本试验在2018年0.2%~1.6% EMS浓度筛选的基础上,参照李伟等[6]的方法采用裂区试验设计,主处理(A)为EMS浓度处理,设5个水平,依次是A1~A5(0.8%、0.9%、1.0%、1.1%、1.2%)EMS浓度处理。副处理(B)为种子不浸种或清水浸种过夜,根据诱导时间设8个水平,依次为B1:浸种,诱导8 h处理;B2:不浸种,诱导8 h处理;B3:浸种,诱导9 h处理;B4:不浸种,诱导9 h处理;B5:浸种,诱导10 h处理;B6:不浸种,诱导10 h处理;B7:浸种,诱导11 h处理;B8:不浸种,诱导11 h处理,共计40个组合。以1×PBS溶液浸种处理作对照。处理时将三角瓶置于40 r·min-1的摇床上,保证种子与处理液充分接触。处理结束后,加5% Na2S2O3洗涤3次,再用蒸馏水清洗3次,将清洗后的种子放在滤纸上吸干水分,每种处理挑选100粒饱满的种子均匀置于铺有2层湿润生根滤纸的培养皿中,将培养皿置于组培室中30 ℃培养,每天10 h正常光照,及时补充水分。3 d后调查发芽势,7 d后调查发芽率,分别在每个处理组中随机抽取10株幼苗,测定其茎长、胚根长。
发芽势(%)=(第3天发芽的种子数/供试种子总粒数)×100%;
发芽率(%)=(第7天发芽的种子数/供试种子总粒数)×100%;
平均茎长(cm)=∑第7天发芽种子的长度(茎基部到叶尖的长度)/N;(N表示计算发芽长度的种子个数)。
平均胚根长(cm)=∑第7天发芽种子的长度(种子基部到根尖的长度)/N;(N表示计算发芽长度的种子个数)[8]。
1.3 EMS处理对田间幼苗的影响
确定半致死剂量后,采取相应条件的处理种子,在试验田的小区内开沟播种,行距30 cm。出苗后免间苗,及时蹲苗保证幼苗茁壮生长,田间管理采用常规方式进行。
1.4 数据分析
将观测记录的数据进行统计分析,多因素试验结果的差异显著性测验采用DPS分析软件进行,多重比较采用Ducan法。
2 结果与分析
2.1 EMS处理对晋谷21号种子萌发的影响
2.1.1浸种对晋谷21号种子发芽势、发芽率的影响
相同浓度EMS处理下,提前浸种的种子较未浸种种子的发芽势和发芽率高。如图1和表1所示,对照组在浸种与未浸种条件下,种子平均发芽势分别为94.54%和92.37%,平均发芽率分别为98.54%和96.25%,无显著差异,表明浸泡与否对谷种的发芽势、发芽率无显著影响;而在其他浓度EMS处理下,提前浸种发芽势较未浸种高1.46%~11.67%,发芽率较未浸种高1.31%~12.59%。0.8%的EMS处理9 h,浸种与未浸种种子发芽势分别为65.67%和58.67%,相差7.0%,发芽率相差11.11%;1.0%的EMS处理9 h,浸种与未浸种种子发芽势分别为48.25%和39.25%,相差9.0%,发芽率分别为59.02%和47.78%,相差11.54%,差异显著;而当EMS提高至1.2%时,浸种与未浸种种子间的发芽率差异较小。可能是随着处理时间延长,较未浸种种子相比,提前浸种的种子达到吸胀状态,吸收EMS溶液量减少。由此可知,晋谷21号种子的发芽势与发芽率均随着EMS浓度的升高而降低,同一处理水平下,提前浸种比未浸种种子的发芽势和发芽率高,EMS浓度越低差异越显著。
2.1.2EMS处理对晋谷21种子发芽率的影响
如图1所示,与对照相比,随着EMS浓度的增大和处理时间的延长,晋谷21号的发芽率呈逐渐降低的趋势,与马海新等[9]研究结果一致。其中EMS浓度为0.8%,处理时间11 h,晋谷21号的发芽率由对照组的98.54%降到46.44%,而当浓度增大到1.1%、1.2%时,晋谷21号的发芽率分别降至28.58%和16.02%,说明晋谷21号对EMS较敏感,且EMS浓度越高,对种子的生理损伤越大,其发芽率越低。1.0% EMS浓度处理10 h,种子发芽率为49.03%,最接近半致死率(植株存活率50%)。结合表1,综合考虑相对发芽势、相对发芽率,确定EMS的最佳诱变组合为提前浸种的种子利用1.0% EMS处理10 h。
2.1.3EMS处理对晋谷21号种子茎长、胚根长的影响
EMS处理晋谷21号种子7 d后,每个处理分别随机抽取10株幼苗,测定其茎长、胚根长,由图2可以看出,随着EMS浓度的增大和处理时间延长,晋谷21号的茎长、胚根长较对照组变短,呈下降趋势。在EMS浓度为0.8%、0.9%时,4个时间组处理下晋谷21号的茎长、胚根长的差异不显著;在EMS浓度为1.1%、1.2%时,4个时间组处理下茎长、胚根长的差异逐渐变大,其中以1.2% EMS处理11 h最明显。ck的茎长和胚根长分别为4.19 cm、7.91 cm,而EMS浓度1.2%处理11 h时的茎长和胚根长分别为1.19 cm、1.84 cm,仅为ck的28.40%和23.26%。表明EMS能够抑制晋谷21号种子的茎、胚根的生长。EMS浓度越高,晋谷21号种子萌发受抑制效应越大,茎长、胚根长越短,所需发芽时间越长。
2.2 田间观察与分析
使用EMS浓度为1.0%、处理时间10 h的最适诱变条件处理5 000粒种子,开沟播种于试验田的小区内,其中能够萌发的种子有2 439粒,最终能够成苗的M1代诱变株为1 468株。由于一些隐性变异要到M2代才会发生性状分离,因此M1代出现的变异类型不多,总体上有黄化苗、白化苗、叶色变异、分蘖、茎秆红色、穗型突变体等变异。对黄化苗和白化苗进行统计发现,EMS处理的种子幼苗更容易出现黄化苗,黄化苗的突变率(1.25%)大于白化苗的突变率(1.13%);统计结果见表2。幼苗期黄化苗表现为2种类型:第1种整个幼苗都发生黄化;第2种只有部分叶片发生黄化,有的幼苗同一叶片上只有一半发生黄化;白化苗表现为整个幼苗都发生白化。有的黄化苗慢慢死去,有的黄化苗逐渐转绿,但由于叶绿素含量较低,植株的长势较对照差。而白化苗由于光合作用能力差很快死亡。
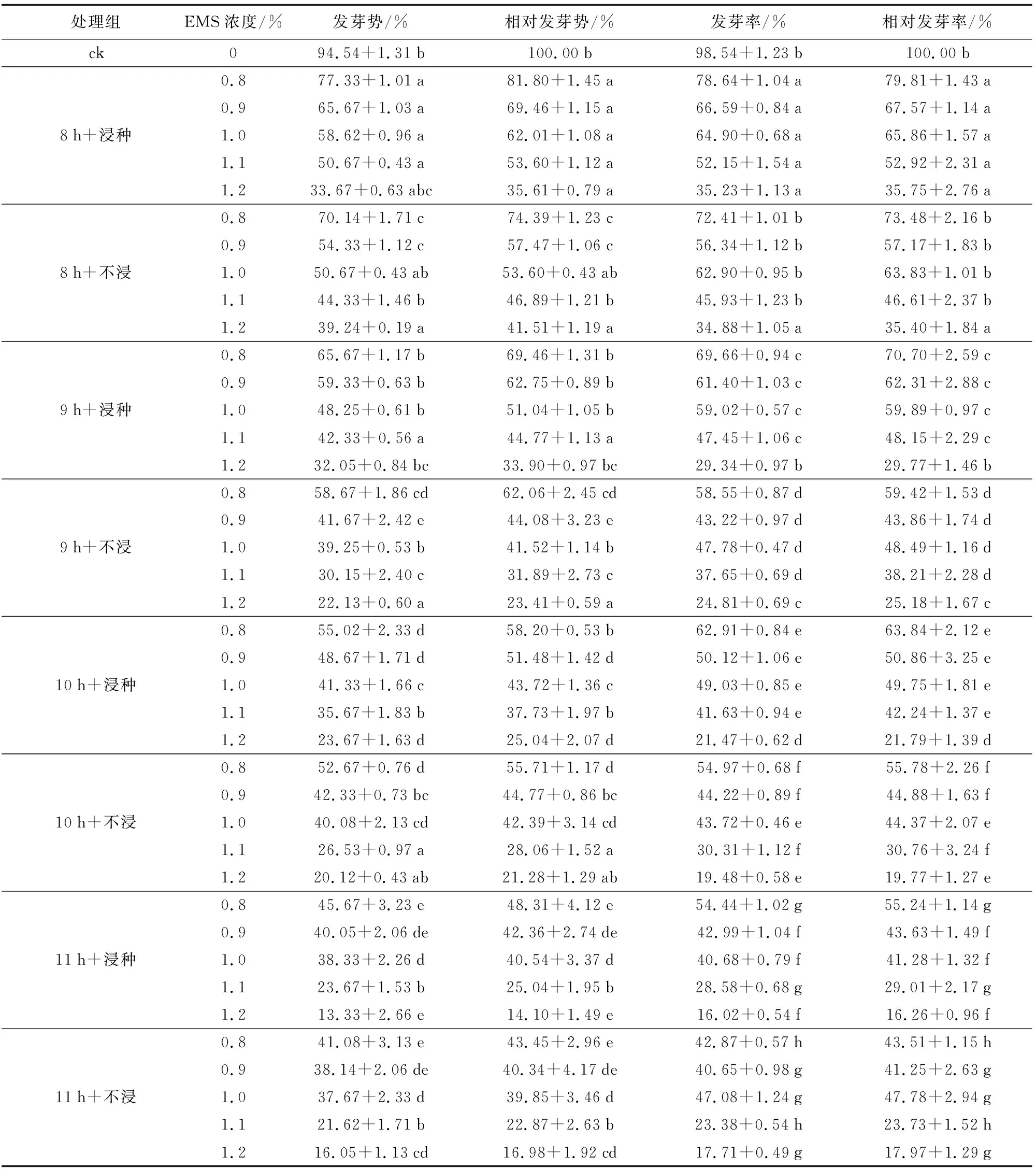
表1 EMS处理对晋谷21号种子发芽势和发芽率的影响
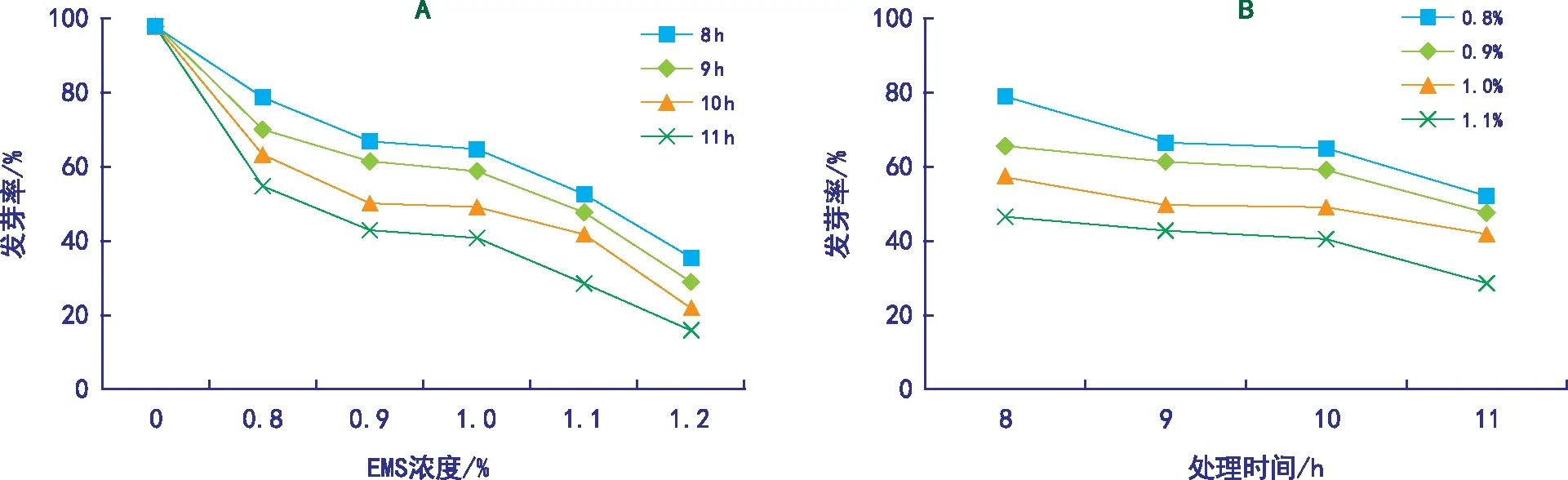
图1 不同处理对晋谷21号种子发芽率的影响
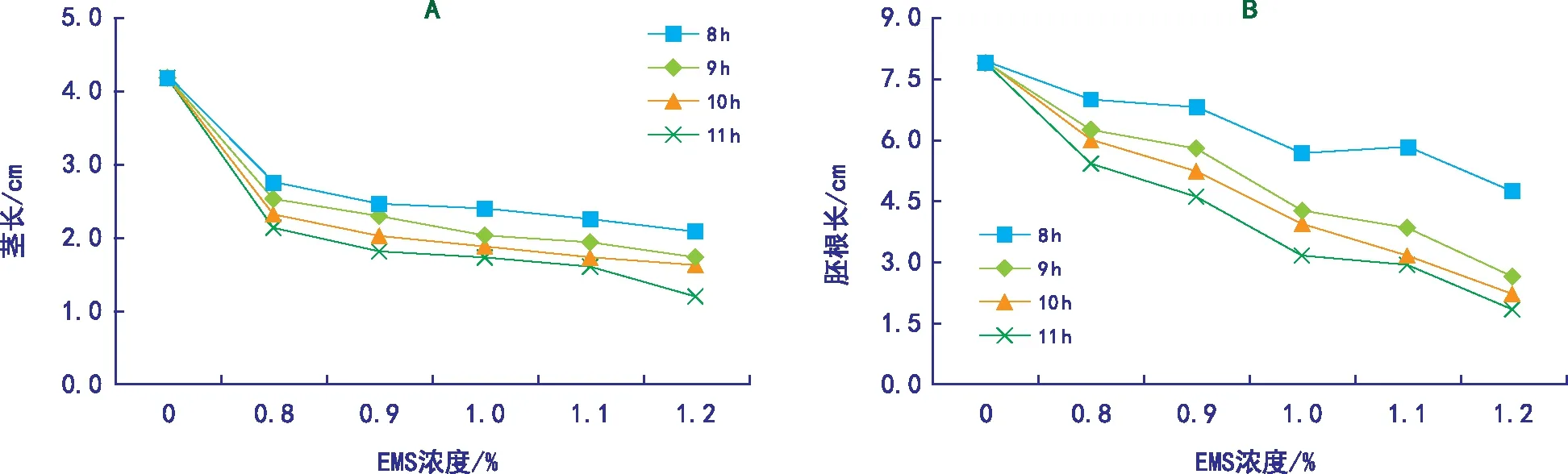
图2 不同浓度EMS处理对晋谷21号种子茎长和胚根长的影响
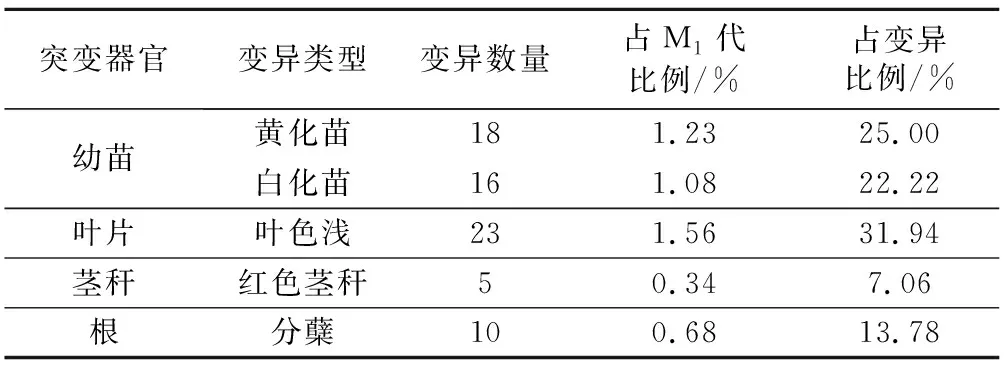
表2 EMS诱变晋谷21号M1群体突变表型分类
3 讨 论
近年来,EMS广泛用于禾本科不同作物如水稻、玉米、小麦、大麦、高粱、苦荞等诱变育种[10-12],利用EMS诱变构建的突变群体在基因功能研究上具有独特优势。研究表明,适宜的诱变浓度和诱变时间是EMS诱变育种提高变异率、获得理想突变体的关键[13]。只有在适宜的浓度范围内,作物才能保持其优良性状并产生更多新的变异,一般以诱变后植株存活50%所需的EMS浓度即半致死剂量(LD50)作为诱变敏感性指标[14]。不同作物所需的EMS诱变浓度和诱变时间不同。许云峰等[15]利用0.3%的EMS处理小麦品种“烟农15”4 h,获得11个农艺性状发生明显变异的突变系;张维宏等[16]采用1.0%的EMS处理小麦“TcLr 19”8 h,获得较稳定的小麦感叶锈病突变体;董文科等[17]对黑麦草品种“首相”种子进行诱变处理,结果表明,0.8%EMS处理24 h可作为适宜诱变组合;甜荞EMS诱变的最适浓度为1.0%,处理时间为4 h[28]。即使相同作物的不同品种EMS诱变浓度和诱变时间也不尽相同。冀谷31的最佳诱变条件为1.0% EMS处理6 h,而冀谷25的最佳诱变条件为0.8% EMS处理10 h[18];谷子十里香的适宜诱变条件是1.2% EMS处理16 h[19]。本研究结合各处理的种子发芽势、相对发芽势、发芽率、相对发芽率、茎长、根长,最终确定晋谷21号最佳诱变浓度为种子提前浸种,1.0% EMS处理10 h。
EMS诱变能够抑制种子的萌发,抑制幼苗茎尖、胚根的生长。研究发现,EMS浓度越高越易溶解产生有机酸,毒害作用越强,会对种子产生不可逆的严重损伤[20]。臧辉等[21]利用EMS处理羊草种子发现,EMS浓度越高,对种子萌发和幼苗的抑制作用越强,表现为萌发时间延迟、发芽率降低、苗长和根长变短;邱婷婷等[22]利用不同浓度EMS处理华南5号木薯种子,发现EMS浓度越高,对种子的生理损伤越大,并导致其发芽率越低。齐晓花等[23]利用EMS诱变构建黄瓜突变体库时发现,种子出苗率随着EMS浓度的提高而下降,2.5% EMS处理的种子出苗率只有19%,比对照降低了76%。本研究中0.8% EMS处理种子11 h,发芽率比对照组低52.1%,当浓度增加到1.2%时,晋谷21号的发芽率比对照组低82.52%,茎长和胚根仅为对照的28.40%和23.26%。说明EMS诱变抑制了晋谷21号种子萌发时茎尖、胚根的生长,对种子萌发的抑制作用随着浓度提高而增强,这可能是高浓度的EMS和长时间的处理对种子产生了不可逆的毒害作用。
EMS诱发的突变一般为显性突变,诱变性状一般为主基因控制的性状,易于突变体的筛选[24]。EMS诱变芝麻的M1代植株出现了叶片黄化、花序突变、花冠突变等现象,诱变率为7.60%[25];在裸燕麦种子诱变中产生了茎秆颜色变异、株高变异、叶型变异、叶色变异类型[26],EMS诱变番茄出现花柱性状、果实形态和株型变异[27]。本研究中也发现M1代谷子出现黄化苗、白化苗、茎秆红色等变异,说明EMS诱变对种子产生影响,引起其植株的表型变化,甚至可能会引起植株遗传水平的变异。因此在后续研究中,可利用EMS持续诱变乳熟期、蜡熟期的穗,获得有效的突变体。在本实验中筛选的突变体表型变异性状与遗传水平变化的联系需要进一步研究。在后期构建谷子突变体库过程中,依据EMS诱变一般为显性突变的特点,将M1候选突变体上收获的所有种子用于M2性状测定,变异鉴定,并判定这些变异能否遗传。性状优良的突变体材料可进一步进行特异性、一致性、稳定性测试(DUS测试),为晋谷21号抗病突变体库的建立奠定基础。
