基因剪刀和基因编辑
2020-12-04田地
田地

2020年的诺贝尔化学奖授予美国加州大学伯克利分校教授詹妮弗·杜德纳(Jennifer Doudna)和在德国马克斯·普朗克感染生物学研究所工作的法国教授埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier),以表彰她们发明基因修饰方法CRISPR-Cas9。
基因剪刀和基因编辑的原理
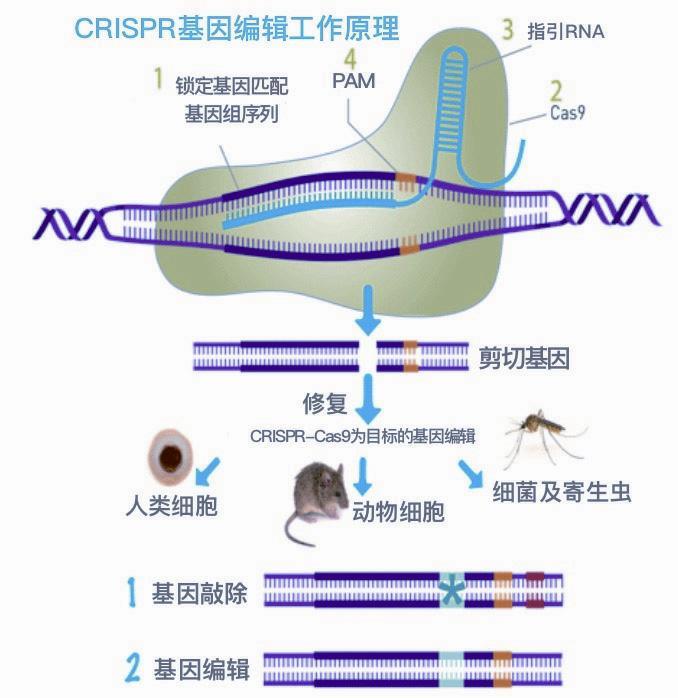
CRISPR的全称有些拗口,为“规律成簇间隔短回文重复”(Clustered regularly interspaced short palindromic repeats)。Cas是Caspase的简称,全称是含半胱氨酸的天冬氨酸蛋白水解酶。这是一组蛋白酶,Cas9是其中之一。此外,与CRISPR一起发挥功能的还有其他酶,如核酸酶蛋白Cpf1,因此也可称为CRISPR/Cas系统,包括CRISPR-Cas9、CRISPR-Cpf1、CRISPR-C2c1和CRISPR- C2c2等,它们都是基因剪刀,但应用最多的是CRISPR-Cas9。
CRISPR-Cas9是目前比较精确,而且切割速度较快的一种基因剪刀,利用这把剪刀可以对动物、植物和微生物的DNA进行有目标性的编辑加工(剪切、删除、位移和增加等),从而治疗疾病,尤其是遗传病,以及获得人们想要的作物和生物产品。
研究人员早就发现,CRISPR与很多能够侵入细菌的噬菌体DNA序列相同,噬菌体DNA的这些序列在被转录为RNA后,就成为靶向RNA(gRNA),能够和细菌产生的Cas蛋白形成复合体,并引导Cas蛋白。当复合体检测到入侵的DNA和靶向RNA序列一致时,Cas蛋白就能够切割入侵的DNA,据此细菌可以保护自己,防御噬菌体的入侵。可以说,这是生物的一种天生的免疫防御机制。
当CRISPR与Cas9结合成为CRISPRCas9系统时,就成为一种有目标和能精确控制的基因剪刀,能比较准确地切割某种基因。
杜德纳和卡彭蒂耶正是因为证明了CRISPR-Cas9基因剪刀的准确和有效而获得今年的诺贝尔化学奖。卡彭蒂耶在对人类造成极大伤害的化脓性链球菌的研究中首先发现一种以前未知的分子—tracrRNA。研究表明,tracrRNA是细菌古老的免疫系统CRISPR/Cas的一部分,该系统通过切割噬菌体的DNA而解除其武装,从而抵抗噬菌体DNA的侵入。2011年卡彭蒂耶发表了她的研究结果。
同一年,卡彭蒂耶与拥有丰富RNA知识的资深生物化学家杜德纳合作,获得突破性的成果。她们在2012年6月发表的论文中称,其团队纯化了Cas9蛋白,发现它是双RNA引导的DNA内切酶,并首次在体外(试管中)证明使用Cas9的CRISPR系统可以切割任意DNA链,说明CRISPR在活细胞中有修改基因的能力。同时,她们简化了基因剪刀的分子成分,创建了CRISPR-Cas9基因剪刀,因此更易于使用。她们是最早把细菌天然免疫系统转化为CRISPR-Cas9基因剪刀的,并使其具有任意切割基因的功能。后来,卡彭蒂耶和杜德纳又用CRISPR-Cas9基因剪刀成功编辑了大肠杆菌的基因,结果表明CRISPR-Cas9比起之前的其他基因剪刀更有效和准确。
发现历程和争议
CRISPR被视为一种能改变整个生物领域的工具和成果,在疾病治疗、农业生产等方面有极大的应用潜力。但是,CRISPR和CRISPR-Cas9的发现和发明并非只有获奖者两个人的贡献,而是一大批科学家不断研究、相互印证的结果。
美国的《细胞》杂志曾发文回顾过CRISPR技术的早期发展过程,同时美国麻省理工学院-哈佛大学博德研究所所长埃里克·兰德也对CRISPR基因编辑技术的发明过程有过总结。结合这两者及其他研究,可以简单归纳CRISPR和CRISPR-Cas9的发明过程。
1987年,日本科学家石野良纯团队在分析大肠杆菌iap基因及周边序列时偶然发现了一段位于3端存在29个核苷酸高度同源的重复序列,它们被含32个核苷酸的序列间隔开,由此揭开了CRISPR的面纱。
1993年,西班牙科学家弗朗西斯科·莫伊卡在嗜盐古细菌的基因组中发现了大约30个碱基对(bp)长度的回文重复序列(CRISPR),这些序列由36个碱基对的间隔序列隔开。2005年,莫伊卡又发现CRISPR序列中2/3的间隔序列为病毒或外源质粒的序列,因而认定CRISPR系统与细菌的获得性免疫有关。
2005年,法國科学家吉利斯·维格诺德和俄罗斯科学家亚历山大·博洛廷也证明,CRISPR与细菌的获得性免疫有关。
2007年,服务于杜邦公司的法国分子生物学家菲利普·霍瓦特等人在研究生产酸奶的乳酸杆菌对噬菌体的抗性时,发现了Cas7和Cas9蛋白在CRISPR中的作用,Cas7产生间隔和重复序列,Cas9则是核酸酶。

2008年8月,荷兰科学家范德欧斯特等人鉴定了一系列Cas蛋白,发现这些蛋白需要切割61个碱基对的前体RNA(crRNA)才有功能,由此弄清了crRNA的作用。他们据此人工设计相应的crRNA序列,使细菌获得了抵抗噬菌体的特性。这是人类首次编辑CRISPR系统。
2008年12月,阿根廷科学家卢西亚诺·马拉夫尼团队证实CRISPR系统的底物是DNA,并且提出该系统有可能用于DNA编辑,是一种有效的基因剪刀。
2010年12月,加拿大拉瓦尔大学的西尔万·莫伊诺证实了Cas9可以在crRNA的指导下切割特定序列的DNA。
2011年7月,立陶宛科学家维吉尼亚斯·斯克斯尼斯在大肠杆菌中重组了嗜热链球菌的CRISPR系统,提出CRISPR-Cas9要成为一把精准有效的基因剪刀至少需要Cas9、crRNA和反式激活crRNA(tracrRNA)。
2012年8月,卡彭蒂耶和杜德纳发表论文,揭示CRISPR-Cas9基因剪刀可以进行准确的基因编辑。她们对CRISPR-Cas9系统进行了简化,将tracrRNA与crRNA嵌合成一条单链向导(sgRNA),只需sgRNA和Cas9蛋白两个组分即可靶向特定的序列,至此CRISPR-Cas9这种高效简单的基因组编辑技术(基因剪刀)问世。
2013年1月,麻省理工学院教授、华裔科学家张锋和哈佛大学医学院教授乔治·邱奇同时在《科学》杂志上分别发表论文,证明CRISPR-Cas9可以编辑哺乳动物细胞基因,而且成功地编辑了小鼠和人类细胞的基因。几周之后,杜德纳实验室也发表了类似的结果。
因此有人认为,张锋也有可能因为发现CRISPR-Cas9可应用于人类细胞而获得诺贝尔奖,并且张锋与杜德纳等人在过去也打了多起关于CRISPR-Cas9技术应用的专利官司,双方各有胜负。而且石野良纯因为首先发现了CRISPR也可能获奖,另外西班牙的莫伊卡最先认识到CRISPR的重要性,并且对其从结构到功能的揭示都有卓越贡献,也应当获奖。但是,在诺贝尔奖委员会看来,在发现CRISPRCas9基因剪刀的过程中,只有卡彭蒂耶和杜德纳二人的成果才是最关键的核心贡献。
实际应用
作为一种比较精准而高效的基因剪刀,CRISPR-Cas9在各个领域,如生物、医学、农业、化学等方面有着广泛的用武之地。这种基因剪刀可以用来删除、添加、激活或抑制其他生物体的目标基因,包括人、老鼠、斑马鱼、细菌、果蝇、酵母、线虫和农作物细胞内的基因,因此,它是一种用途极为广泛的生物技术。
在农作物方面,人们可以利用这一基因剪刀来生产抵抗霉菌、害虫和干旱的农作物,而且已经取得了不少成果。2019年,肯尼亚国际热带农业研究所的雅因达拉·特里帕斯团队就采用基因剪刀CRISPR-Cas9剪切了一种大香蕉基因组中的病毒DNA,使其不再让香蕉产生条纹病。与未经基因编辑的大香蕉相比,经过编辑的大香蕉有75%没有出现香蕉条纹病毒症状,这也意味着即便暴露在干旱压力下,也能让这种香蕉不受病毒的侵害,让香蕉保产和增产。
在改造动物基因方面,基因剪刀也表现出了重要的价值。中国南京医科大学生殖医学国家重点实验室等机构的研究团队利用CRISPRCas9基因剪刀,首次在全球创造和孕育了两只靶向基因编辑猴。创造靶向基因编辑猴的目的是建立猴子疾病模型,用来模拟人类、试验药物和治疗遗传病,从而降低药物研究和以人为试验对象的风险。
研究人员利用CRISPR-Cas9基因剪刀修改了3个基因,即调节代谢的基因Ppar-γ、调节免疫功能的基因Rag1以及调节干细胞和性别决定的基因。研究人员在180多个单细胞期猴胚胎中同时靶向编辑了这3个基因,然后对15个胚胎的基因组进行测序,结果发现其中有8个胚胎显示出两个靶基因同时突变的证据。这两个基因就是调节代谢的基因Ppar-γ和调节免疫功能的基因Rag1。此后,研究人员将这种经过遗传修饰的胚胎转移到代孕母猴体内,其中一只母猴分娩出了一对孪生猴。对这对孪生猴的基因组进行检测后发现,它们的DNA中确实存在两个突变的靶基因。也因此把这两只猴称为靶向基因编辑猴。
2014年,美国贝勒医学院张普民研究团队也采用CRISPR-Cas9基因剪刀制造出了能够产生人类白蛋白的基因编辑猪。
2016年初,包括张锋在内的多个研究机构的团队利用CRISPR-Cas9基因剪刀来治疗动物的杜兴氏肌肉萎缩症遗传病,结果提高了它们的预期寿命和生活质量,这显然是为治疗人的杜兴氏肌肉萎缩症进行的動物试验。
此外,邱奇团队也正在利用CRISPR-Cas9基因剪刀来大量编辑猪的基因,去除猪的基因中对人有害的微生物,使其可以为人类提供器官,从而解决人体器官移植供不应求的现状。
伦理和限制
CRISPR-Cas9基因剪刀同样存在短板和缺陷,最大的短板是它可能脱靶,即这一基因剪刀可能会在DNA错误的位置进行剪切,或脱离原有的设计目标,造成意外伤害。如果是用于治疗人的疾病,就有可能产生不可预控的严重后果。
2018年9月,《自然方法》发表一篇文章指出,在对小鼠的试验中,CRISPR确实能够成功矫正引发失明的基因,从而治疗小鼠的失明。但是,有两只接受基因剪刀治疗的小鼠的基因组中存在超过1500个单核苷酸突变以及超过100处更大基因片段的缺失和插入。这便是脱靶造成的后果,而且可能危及小鼠的生命。
目前已知有超过4000种遗传性单基因疾病,影响全球超过1%的新生儿。从理论上讲,可以利用CRISPR-Cas9基因剪刀剪掉致病基因,以预防这些疾病,让每个家庭都获得健康婴儿。这显然比胎儿出生前的基因检测更先进。
但是,在实际操作中由于CRISPR-Cas9基因剪刀有脱靶的危险,因而用来治疗人类疾病有巨大的风险。2015年,中山大学的黄军就团队采用基因剪刀CRISPR-Cas9修改导 致β地中海贫血的β珠蛋白基因(将有问题的鸟嘌呤G修改成腺嘌呤A,从而纠正地中海贫血的基因根源)获得部分成功,但是这一研究结果被英国的《自然》和美国的《科学》杂志拒稿。理由是,这将引发无法预料的风险。对人类胚胎的研究不進行严格限制可能会导致不安全和不符合伦理地使用这种技术。
实际情况也表明,黄军就团队采用CRISPRCas9基因剪刀的成功率并不高,脱靶明显。他们对胚胎修改β地中海贫血的致病基因时,试验了86个废弃胚胎细胞,最终只有28个的基因被成功编辑修改,成功率约为33%。这个成功率并不足以获得安全性和成功率的保障,也让人们对此技术抱有疑虑。
2018年,中国南方科技大学生物系副教授贺建奎团队利用CRISPR-Cas9基因剪刀编辑了胚胎细胞中与艾滋病免疫有关的CCR5基因,以使婴儿出生后具备先天性的免疫艾滋病的能力。研究团队称,首先是利用猴子胚胎和小鼠来进行CRISPR-Cas9编辑实验,取得预期的效果,并发现小鼠的组织及行为与正常小鼠没有显著差异。2017年3月至2018年11月,贺建奎团队招募8对夫妇志愿者(艾滋病病毒抗体男方阳性、女方阴性)参与实验。最终有2名志愿者怀孕,其中一人生下一对化名“露露”“娜娜”的双胞胎女婴。
这一事件引发了巨大争议,由于CRISPRCas9基因剪刀存在不可避免的脱靶后果,将可能对后代产生其他方面的意想不到的危险,因此,这是一种违反医学伦理的严重事件。2019年12月30日,基因编辑婴儿事件在深圳市南山区人民法院一审公开宣判。贺建奎以非法行医罪被判3年有期徒刑,并处罚金300万元人民币。
CRISPR-Cas9基因剪刀固然有巨大的应用前景,而且也获得了诺贝尔奖,但是在应用于人和动物时,还存在巨大的风险,需要由人类的伦理和法律来监管。


