浙江红山茶CcFAD2基因克隆及其在籽仁发育中的表达分析
2020-12-04王仲伟徐立安汤诗杰
王仲伟,王 波,董 乐,徐立安,汤诗杰,温 强,①
〔1. 江西省林业科学院 植物生物技术重点实验室,江西 南昌 330032;2. 江苏省中国科学院植物研究所(南京中山植物园),江苏 南京 210014; 3. 南京林业大学林学院,江苏 南京 210037〕
浙江红山茶(CamelliachekiangoleosaHu)隶属于山茶科(Theaceae)山茶属(CamelliaLinn.)红山茶组〔Sect.Camellia(Linn.) Dyer〕,又名浙江红花油茶,自然分布于江西东部至西部、浙江南部、福建北部和湖南东部海拔600~1 300 m的山地[1]。浙江红山茶的种植面积和年产量在具有油用价值的山茶属种类中居第4位[2],属高油酸型山茶属种类[3],其籽油率及油质普遍高于栽培面积最广的油茶(CamelliaoleiferaAbel.)[4],且其油脂的理化指标和主要营养成分的综合评分与南山茶(CamelliasemiserrataChi,又名广宁红花油茶)和滇山茶(CamelliareticulataLindl.,又名腾冲红花油茶)相比也较高,分别为0.892和1.000[5]。植物种子的脂肪酸组成决定油的品质和用途[6]。茶油中不饱和脂肪酸主要包括油酸和亚油酸等,具有降低胆固醇和血脂、改善血液流变性及预防冠心病等功能[7]。油酸是单不饱和脂肪酸,其氧化稳定性高于多不饱和脂肪酸亚油酸,且亚油酸含量高会降低茶油的贮藏稳定性。近年来,如何提高浙江红山茶的油酸含量成为品种选育的一个重要方向。
FAD(fatty acid desaturase)基因是重要的脂肪酸脱氢酶基因,按反应底物和催化产物可分为催化单不饱和脂肪酸向双不饱和脂肪酸转化的ω-6型(FAD2和FAD6)和催化三不饱和脂肪酸合成的ω-3型(FAD3、FAD7和FAD8)2大类。Δ12-脂肪酸脱氢酶FAD2催化油酸脱氢形成亚油酸[8],而FAD6是其质体型同工酶[9]。Byfield等[10]研究环境温度对大豆〔Glycinemax(Linn.) Merr.〕不同品种种子发育过程中脂肪酸变化的影响,结果显示:环境温度差异可造成大豆FAD2-1基因表达存在差异,从而调节油酸与亚油酸含量的变化,其中,低温下FAD2基因的mRNA水平显著升高,且与油酸含量呈负相关。Chen等[11]研究FAD2基因表达对欧洲油菜(BrassicanapusLinn.) W-4株系脂肪酸及品质的影响,发现FAD2基因表达水平显著影响种子中脂肪酸的合成和积累,该基因表达下调时种子中油酸含量明显升高,而亚油酸含量显著降低。这些研究结果表明通过诱导FAD2基因表达可引起油料植物中油酸与亚油酸含量的变化,为浙江红山茶FAD2基因的功能研究提供了借鉴。
浙江红山茶作为典型的高油酸型油茶树种,3月开花,9月果熟[12]。目前,已有研究人员从同属植物油茶中克隆得到2个FAD2家族成员(登录号分别为KJ995981和JQ739518)[13-14],林萍等[15]随后对其进行了序列比较和表达模式分析,并通过表达载体的构建初步分析了其功能。对浙江红山茶FAD2基因功能进行深入研究不仅可为今后定向调控不饱和脂肪酸的含量和组分奠定基础,还可为该树种油质改良提供技术支持。鉴于此,本研究基于转录组数据[16]克隆得到了浙江红山茶FAD2基因,并进行生物信息学分析,通过分析浙江红山茶籽仁中油酸与亚油酸相对含量的变化规律及该基因在籽仁发育不同阶段的表达模式,为进一步阐明浙江红山茶籽仁中FAD2基因对油脂成分形成的影响提供科学依据,并为通过分子手段选育高油酸含量浙江红山茶品种奠定了基础。
1 材料和方法
1.1 材料
供试浙江红山茶种植于江西省林木育种中心山茶属种质基因库(东经115°39′36″、北纬28°54′36″,平均海拔30 m),选择生长健壮且无病虫害的同龄成年植株,分别于7月14日(籽仁形成初期)、7月29日(籽仁快速生长期)、8月11日(籽仁快速生长期)、8月25日(籽仁内含物充实转化期)、9月9日(籽仁内含物充实转化期)和9月23日(籽仁脱水成熟期)进行取样,每次选择3株,每株取3个果实,鲜果采摘后立即去壳取出籽仁,置于液氮中冷冻带回,然后置于-80 ℃冰箱中保存、备用。
1.2 方法
1.2.1 总RNA提取及反转录 称取浙江红山茶籽仁发育过程中不同时间相同质量的籽仁,液氮速冻研磨成粉末后,称取0.3 g,采用改良的CTAB法[17]提取总RNA。总RNA中的基因组DNA污染利用DNase Ⅰ〔宝生物工程(大连)有限公司〕去除,采用质量体积分数1%琼脂糖凝胶电泳检测总RNA的质量,剩余的置于-80 ℃冰箱保存、备用。利用购自宝生物工程(大连)有限公司的3′-Full RACE Core Set Ver.2.0和5′-Full RACE Kit合成cDNA第1链。
1.2.2 基因全长的克隆与序列分析 根据转录组测序获得的浙江红山茶FAD2基因的EST序列,设计特异性引物进行巢式PCR(nested PCR)。反应体系总体积50.0 μL,包含10×ExTaqBuffer Ⅱ(Mg2+Free)5.0 μL、25 mmol·L-1MgCl24.0 μL、10 mmol·L-1dNTP Mixture(each)4.0 μL、ExTaqDNA Polymerase 0.3 μL、正向和反向引物各2.0 μL、模板cDNA 2.0 μL及ddH2O 30.7 μL。扩增程序:94 ℃预变性3 min;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸2 min,共32个循环;72 ℃延伸10 min。使用普通琼脂糖凝胶DNA回收试剂盒(DP209)〔天根(北京)生化科技有限公司〕回收目的条带,与pMD19-T载体〔宝生物工程(大连)有限公司〕连接,转化大肠杆菌Top10菌株,选取阳性克隆送南京金斯瑞生物科技公司测序。
使用BioEdit软件预测浙江红山茶FAD2基因全长的开放阅读框及编码氨基酸。使用NCBI数据库中的BLASTn(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列相似性比对。使用ProtParam(http:∥web.expasy.org/protparam/)分析蛋白质的理化性质。使用Pfam(http:∥pfam.xfam.org/)数据库推测蛋白质的结构域。使用SinalP(http:∥www.cbs.dtu.dk/services/SignalP/)和TMHMM(http:∥www.cbs.dtu.dk/services/TMHMM/)分别预测蛋白质的信号肽及跨膜区。使用SOPMA工具(http:∥npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测蛋白质的二级结构。使用I-TASSER(http:∥zhanglab.ccmb.med.umich.edu/I-TASSER)预测蛋白质的三级结构。使用ClustalX2进行氨基酸序列的同源性比对。使用MEGA 5.0中的邻接法构建系统进化树。使用Wolf PSORT(https:∥wolfpsort.hgc.jp/)预测亚细胞定位。
1.2.3 基因表达分析 采用实时荧光定量PCR(qRT-PCR)分析FAD2基因在浙江红山茶籽仁发育6个阶段中的表达差异。qRT-PCR采用SYBR®PremixExTaqTMⅡ〔宝生物工程(大连)有限公司〕,在ABI 7500 Real-time PCR System(美国ABI公司)上完成,内参基因为α-tubulin基因,每个样品3次重复。qRT-PCR引物见表1。反应体系总体积20.0 μL,包含SYBR®PremixExTaqTMⅡ10.0 μL、正向和反向引物各0.4 μL、模板cDNA 2.0 μL、ROX Reference Dye Ⅱ(50×)0.4 μL及ddH2O 6.8 μL。扩增程序:94 ℃预变性30 s;94 ℃变性5 s、60 ℃退火34 s、95 ℃延伸15 s,共40个循环。

表1 用于实时荧光定量PCR的引物
1.2.4 籽油提取及主要不饱和脂肪酸含量测定 参照GB/T 14488.1—2008的方法,采用索氏提取法提取浙江红山茶籽仁的籽油并测定脂肪酸总量,参照GB 5009.168—2016的方法对籽油样品进行甲酯化,参考Zhong等[18]的方法,使用GC2010-Plus 气相色谱仪(日本岛津公司)进行检测。色谱条件:Elite-WAX色谱柱(30 m×0.25 mm×0.25 μm,德国PerkinElmer公司),进样口温度220 ℃;FID检测器,检测器温度280 ℃,氮气流速1.0 mL·min-1,分流比30∶1。升温程序:初始温度150 ℃,保持2 min;以10 ℃·min-1升温至260 ℃,保持10 min。通过与脂肪酸甲酯混合标准品(10 mg·mL-1,CDAB-O83811AMP,上海安谱实验科技股份有限公司)对比鉴别油酸和亚油酸。采用峰面积归一化法[19]计算油酸和亚油酸的相对含量。每组实验3次重复,每个重复测定2次,结果取平均值。
1.3 数据处理
采用EXCEL 2007和SPSS 17.0软件进行数据分析,采用Duncan’s新复极差法进行多重比较。
2 结果和分析
2.1 基因克隆及序列分析
根据浙江红山茶全长转录组数据库中注释为FAD2基因的部分序列信息设计引物,克隆得到的CcFAD2基因(登录号KC342951)全长1 482 bp(图1),开放阅读框长度为1 149 bp,编码383个氨基酸,5′UTR(非翻译区)和3′UTR长度分别为141和189 bp(图2)。BLASTn比对结果显示:CcFAD2基因与油茶CoFAD2基因(登录号JQ739518)的相似性最高,达98%。CcFAD2基因编码的氨基酸序列在105~110、141~145和315~319位具有3个保守的组氨酸簇,分别是HECGHH、HRRHH和HVAHH。
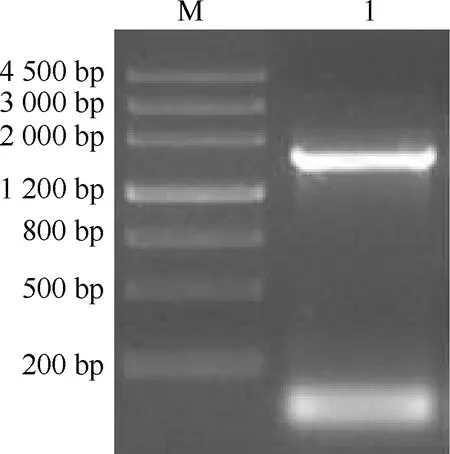
M: DNA标记DNA marker; 1: CcFAD2基因CcFAD2 gene.

下划线分别示起始密码子ATG和终止密码子TGA The underlines show initiation codon ATG and termination codon TGA,respectively; 方框示保守的组氨酸簇The boxes show conservative histidine clusters.
2.2 蛋白质结构分析及亚细胞定位预测
浙江红山茶CcFAD2蛋白的理论相对分子质量为44 240,理论等电点为pI 8.43,无信号肽,具有4个跨膜结构域(图3),分别位于55~77、82~104、178~200和250~272位。二级结构预测结果显示:CcFAD2蛋白包含44.39%的α螺旋、11.49%的延伸链、3.92%的β折叠和40.21%的无规卷曲。三级结构预测结果(图4)显示:CcFAD2蛋白的C值为-2.19(C值在-5.00~2.00之间,C值越大,预测结果越可靠),具有32个配体结合位点。亚细胞定位预测结果显示:CcFAD2蛋白定位于内质网膜。

: 跨膜区Transmembrane; : 膜内Inside; : 膜外Outside.
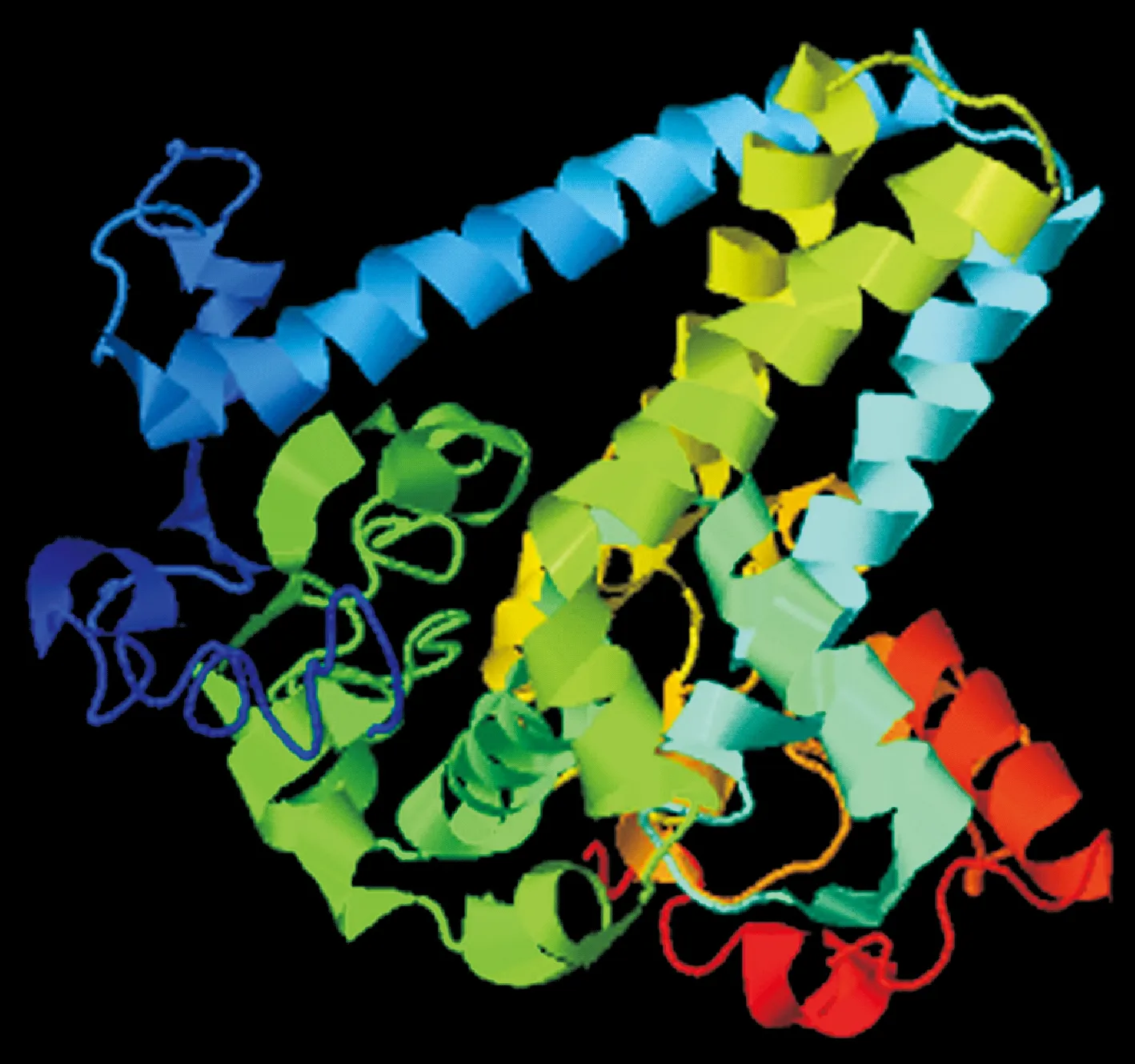
图4 浙江红山茶CcFAD2蛋白的三级结构
2.3 同源性比对及系统进化树分析
对浙江红山茶CcFAD2蛋白与其他8种油料植物FAD2蛋白的氨基酸序列进行同源性比对,结果(图5)显示:浙江红山茶CcFAD2蛋白与其他油料植物FAD2蛋白的氨基酸序列存在高度的保守性,均存在3个保守的组氨酸簇。根据比对结果,排除缺口位置,构建浙江红山茶CcFAD2蛋白与其他8种油料植物FAD2蛋白的系统进化树(图6),结果显示:浙江红山茶CcFAD2蛋白与油茶CoFAD2蛋白(登录号AFK31315)先聚为一亚组,再与油橄榄(OleaeuropaeaLinn.)OeFAD2蛋白(登录号AAW63041)聚为一组,说明三者的遗传关系较近;蓖麻(RicinuscommunisLinn.)RcFAD2蛋白(登录号NP001310648)、亚麻(LinumusitatissimumLinn.)LuFAD2蛋白(登录号AGJ01133)、大豆GmFAD2蛋白(登录号BAD89862)和芝麻(SesamumindicumLinn.)SiFAD2蛋白(登录号XP011080227)4种草本油料植物与麻疯树(JatrophacurcasLinn.)JcFAD2蛋白(登录号AEW43690)和油桐〔Verniciafordii(Hemsl.) Airy Shaw〕VfFAD2蛋白(登录号AEE69021)聚为另一组。

Jc: 麻疯树Jatropha curcas Linn.; Vf: 油桐Vernicia fordii (Hemsl.) Airy Shaw; Rc: 蓖麻Ricinus communis Linn.; Lu: 亚麻Linum usitatissimum Linn.; Gm: 大豆Glycine max (Linn.) Merr.; Si: 芝麻Sesamum indicum Linn.; Cc: 浙江红山茶Camellia chekiangoleosa Hu; Co: 油茶Camellia oleifera Abel.; Oe: 油橄榄Olea europaea Linn. 下划线示保守的组氨酸簇The underlines show conservative histidine clusters.
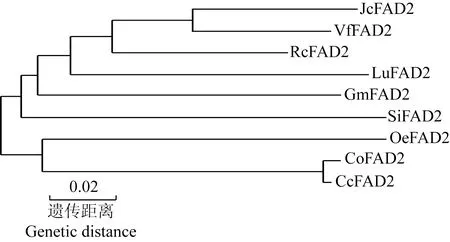
Jc: 麻疯树Jatropha curcas Linn.; Vf: 油桐Vernicia fordii (Hemsl.) Airy Shaw; Rc: 蓖麻Ricinus communis Linn.; Lu: 亚麻Linum usitatissimum Linn.; Gm: 大豆Glycine max (Linn.) Merr.; Si: 芝麻Sesamum indicum Linn.; Cc: 浙江红山茶Camellia chekiangoleosa Hu; Co: 油茶Camellia oleifera Abel.; Oe: 油橄榄Olea europaea Linn.
2.4 浙江红山茶籽仁中脂肪酸含量及CcFAD2基因表达的分析
浙江红山茶籽仁发育过程中脂肪酸含量及CcFAD2基因表达见图7。结果显示:随着浙江红山茶籽仁的发育,脂肪酸总量先稳步上升,成熟后略有下降。在籽仁发育过程中,油酸和亚油酸的相对含量差异明显。7月14日(籽仁形成初期)油酸相对含量最低,7月29日(籽仁快速生长期)油酸相对含量升高,之后一直处于较高的水平。亚油酸相对含量在籽仁形成初期最高,达到13.8%,之后显著降低,且趋于稳定。

同一指标中不同小写字母表示在不同时间差异显著(P<0.05)Different lowercases of the same index indicate the significant (P<0.05) difference among different times.
实时荧光定量PCR结果显示:在浙江红山茶籽仁发育过程中,CcFAD2基因均有表达。CcFAD2基因的相对表达量在籽仁形成初期最高,显著高于其他时期,之后迅速降低,相对表达量维持在较低水平且差异不显著。
3 讨论和结论
浙江红山茶是中国南方地区集观赏和油用于一身的重要木本油料树种。茶油中含有多种脂肪酸,主要包括棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸等,其中,油酸和亚油酸占80%以上[3],食用保健价值较高。油酸较亚油酸少1个不饱和键,不易氧化变质,且在烹饪中产生的油烟少,因此,提高油酸含量、降低亚油酸含量是浙江红山茶品质改良和良种选育的热点之一。
已有研究结果显示:FAD2基因是控制油酸含量的主要基因[20-21],且在高等植物中常以多拷贝的形式存在,构成了FAD2基因家族[22-23]。本研究克隆得到浙江红山茶CcFAD2基因,该基因与油茶CoFAD2基因(登录号JQ739518)[14]的相似性最高(98%),符合同一属的分类定位,但与油茶FAD2基因家族另一成员(登录号KJ995981)[13]的差异较大。林萍等[15]认为,油茶2个FAD2基因均具有1个脂肪酸去饱和酶结构域,属于脂酰-脂去饱和酶基因家族,二者编码的蛋白质均为跨膜蛋白,本研究中浙江红山茶CcFAD2基因与之结构类似,符合FAD2基因的典型特征[8,24-25],也验证了本研究中CcFAD2序列的正确性。
浙江红山茶CcFAD2蛋白与其他8种油料植物FAD2蛋白的系统进化树分析结果显示:FAD2蛋白的氨基酸序列在不同植物中较保守,浙江红山茶与同为木本油料植物的油茶和油橄榄聚为一组,而与草本油料植物间区别相对较大。浙江红山茶和油茶同属于山茶科山茶属,茶油组分相似,含量各异[4],亲缘关系近,但与不同科属的油橄榄也聚为一组,推测前两者与油橄榄的OeFAD2蛋白在进化上分歧时间较短,可能存在平行进化的关系,最终形成相似的油脂品质[26]。亚细胞定位预测结果显示:CcFAD2蛋白定位于内质网膜。油茶中CoFAD2-1蛋白也主要定位在内质网膜[27],与二者序列相近、结构类似、功能一致相符。
多种植物种子脂肪酸累积模式显示:脂肪酸含量总体呈先上升后小幅度下降的变化趋势,推测随着种子成熟,种子含水量不断降低,脂肪酸合成逐渐停止,而种子内含物中其他成分(如蛋白质和部分单糖)的合成需要消耗部分油脂,最终导致种子含油量下降[28-30]。生产上可以根据该趋势确定采种时间,降低脂肪酸的损耗,提高种子出油率。本研究中,浙江红山茶籽仁中的脂肪酸总量随着籽仁发育进程逐步增加,成熟后略有下降,亚油酸相对含量在籽仁形成初期较高到籽仁趋于成熟时下降且趋于稳定,但作为主要成分的油酸则呈现先升高然后略有降低的变化趋势,该结果可以为确定浙江红山茶合适的采种时间提供依据。综合CcFAD2基因的相对表达量和脂肪酸含量,CcFAD2基因的表达模式与亚油酸相对含量的变化规律基本吻合,说明浙江红山茶籽仁发育中后期油酸的合成速率远远高于油酸转化为亚油酸的速率,油茶的相关研究也得到了类似结果[31-32],这从侧面验证了CcFAD2基因在浙江红山茶籽仁发育过程中的功能。本研究结果显示:浙江红山茶CcFAD2基因影响籽仁中油酸和亚油酸的比例,这为浙江红山茶品质改良和分子辅助育种提供了候选研究对象。此外,浙江红山茶是二倍体油茶树种,开花结实期短,脂肪酸组分优于油茶,将来可以作为油茶油脂改良基因工程育种的模式物种进一步深入研究CcFAD2基因的功能。
