玉米中过表达 ZmMRP-1基因的遗传转化与产量鉴定
2020-12-04金如昌杜邓襄李旭欣刘江江郭金洁张方东
金如昌,杜邓襄,李旭欣,杨 涵,刘江江,郭金洁,张 丹,张方东
(华中农业大学 植物科学技术学院, 武汉 430070)
玉米是中国第一大作物,不仅可以作为粮食直接食用,又可作为饲料、工业原料等,对国民经济发展具有重要的作用。随着人口快速的增长,可耕地面积的不断减少,全球气候变暖等问题,使得粮食生产遭受巨大的挑战,提高玉米单位面积产量显得更加重要。玉米产量是一个较为复杂的农艺性状,受多种基因与环境作用所控制。其中,光合作用、氮素同化、碳源分配、植株株型等生理过程是产量形成的基础[1]。近几十年来,随着一些控制产量形成过程中相关基因逐渐被发现,基因工程技术在提高玉米产量方面取得巨大进展[2]。Li等[3]研究发现,在玉米中过表达shrunken-2基因和brittle-2基因,增加15%玉米种子产量。Xie等[4]发现过表达Zmdar1、Zmda1基因玉米纯合株系中穗粒数增加,粒质量显著增加,小区产量提高15%~22%。最近,Wang等[5]在玉米中过表达ZmNF-YB16基因,其中过表达株系在正常条件下百粒质量提高10%~16%,在干旱胁迫处理后百粒质量提高61%~69%。以上说明通过增强产量形成相关基因的表达,可以获得使产量性状明显改善的转基因玉米。
玉米籽粒胚乳约占玉米体积和干质量的80%,胚乳发育过程中库容的建成与库容的充实程度一定程度上决定了玉米的粒质量[6]。谷物种子的发育依靠从母体组织中吸收营养物质来生长,但是由于母体和种子间不存在共生关系,韧皮部中的营养物质需要从籽粒的母体一侧卸下进入质外体,并由专门负责溶质运输的胚乳细胞进入体内,这些细胞位于籽粒基部,形成胚乳基部传递细胞层(Basal Endosperm Transfer Layer,BETL)[7-9]。授粉后6~10d,位于胚乳基部的细胞转化为传递细胞,传递细胞形成一个广泛的细胞壁生长网络,外层胚乳传递细胞向内形成了明显的溶质梯度,从而有利于营养物质向胚乳内部的运输[10-11]。目前在玉米BETL细胞表达的许多基因,已经被鉴定出来[12-15]。其中ZmMRP-1(ZeamaysMYB-related-Protein1),是第一个鉴定出来的具有反式特异激活传递细胞表达的转录因子。ZmMRP-1编码一个MYB结构域转录因子,该转录因子属于R1MYB蛋白SHAQKYF家族[15]。ZmMRP-1的转录起始于胚乳发育的早期阶段,在授粉3d后首先检测到ZmMRP-1表达,并且在传递细胞发育的过程中持续存在。ZmMRP-1可与MEG1、ZmTCRR-1、ZmBETL-1、ZmBETL-2等传递细胞发育相关基因结合[16-18],调控胚乳传递细胞发育相关基因的表达,从而在玉米传递细胞发育中发挥中重要作用。最近Zhang等[19]发现,在开放授粉的Krug黄马齿(Krug Yellow Dent)群体中选育出来的大粒(Krug Large Seed,KLS)和小粒(Krug Small Seed,KSS)自交系群体,比较大种子和小种子群体的转录水平时,KLS出现较高的ZmMRP-1表达水平,且表现为籽粒灌浆速率增加,提示ZmMRP-1在这一过程中可能通过对传递细胞层的分化和功能具有重要作用。
本试验构建携带有玉米ZmMRP-1基因过表达载体pHZM1N-PZmMRP-1::ZmMRP-1,利用农杆菌侵染愈伤组织的方法导入玉米自交系A188中,通过提高该基因在玉米中的表达,以期望获得产量性状改良的玉米新株系,为高产转基因玉米新品种的选育提供材料支持。
1 材料与方法
1.1 试验材料
玉米(ZeamaysL.)自交系A188、根癌农杆菌(Agrobactriumtumefaciens)菌株EHA105、中间载体质粒pHZM1N-Rsc[20],均由华中农业大学玉米课题组保存。
1.2 载体的构建与鉴定
ZmMRP-1启动子序列和ZmMRP-1orf序列均来源于Gómez 等[15],ZmMRP-1的转录终止序列term来自玉米Rs基因的终止序列[21],4XEnhancer序列来自Odell等[22],以上序列设计好连接,合成在pUC57质粒的HindIII-EcoR1,然后亚克隆到pHZM1N-Rsc的pfi23II-XmaJ1位置,构成pHZM1N-PZmMRP-1::ZmMRP-1转化载体,由南京金斯瑞公司完成。将构建好的载体质粒经电击法转入根癌农杆菌菌株EHA105中,挑取单菌落,提取质粒进行PCR检测,由于ZmMRP-1是玉米内源基因,根据目的基因序列与启动子序列设计特异性引物,扩增产物大小662 bp,引物序列ZmMRP-1F:5′-ATCAACCCGGCTAGTCCAAC-3′,ZmMRP-1R:5′-CATCA- GGTAGCCCTGCATCA-3′;标记基因egfp-iptII,扩增产物大小960 bp,egfp-iptIIF: 5′-CAAAGACCCAACGAGAAGC-3′,egfp-iptIIR:5′-AAAGCCCTCACCATCTCCATCTCCTC-3′。PCR反应体系(15 μL):模板DNA 30 ng,Primer R(5 μmol/L)0.5 μL,Primer F(5 μmol/L)0.5 μL,2×Taqplus Master Mix 7.5 μL,ddH2O补至15 μL。PCR反应程序:94 ℃ 5 min,94 ℃ 30 s, 57 ℃ 30 s,72℃ 1 min(30循环),72 ℃ 5 min。
1.3 农杆菌侵染玉米愈伤组织转化玉米 ZmMRP-1基因
1.3.1 农杆菌菌液制备 将携带有pHZM1N-P::ZmMRP-1载体质粒的农杆菌EHA105,在含有抗生素利福平(50 mg/L)和卡那霉素 (50 mg/L)的固体LB培养基上划线,28 ℃倒置暗培养2 d,挑取单克隆于加有抗生素的液体LB培养基中28 ℃、200 r/min震荡培养,低速离心,收集菌液至50 mL的离心管中,加入含有 0.1 mmol/L的乙酰丁香酮(AS)侵染液,28 ℃、200 r/min震荡培养。测定OD600值,将OD值调至0.4~0.5。
1.3.2 农杆菌介导转化玉米愈伤组织 选取授粉10 d左右的A188幼胚诱导愈伤,挑选颜色鲜亮、质地松软的玉米愈伤组织;将愈伤组织置入含农杆菌的侵染液中浸泡30 min,共培养基中 19 ℃暗培养3 d。3 d后,用加特美汀的无菌水清洗愈伤组织5~6次直至水澄清为止;吹干愈伤组织后,转入恢复培养基中。待愈伤组织恢复后,在荧光灯下挑取带有绿色荧光愈伤组织,在42 ℃条件下热激2 h,重复3次,以完全剔除标记基因[20]。将热激处理过后的愈伤组织转至分化培养基,时间为3~4周,之后将大小为2~3 cm左右的再生芽转移到生根培养基中诱导生根,待苗长5~8 cm,根数达到 20 条左右时,揭盖炼苗 2 d,挑选健壮的小苗转入温室种植[23]。
1.4 转基因植株的PCR检测
通过CTAB法小量提取植株幼嫩叶片总DNA,对目的基因ZmMRP-1进行PCR检测,所用引物及体系见“1.2”,筛选阳性植株。
1.5 转基因植株的Southern blot检测
根据ZmMRP-1基因设计特异性探针,以质粒为模板扩增1 169 bp片段,回收目的片段,采用Roche试剂盒对探针进行地高辛标记(Cat.No.11585614910)。CTAB法提取高纯度大量基因组DNA,DNA 30 μg,10×L buffer 4 μL,KpnI50U,补ddH2O至40 μL,37 ℃酶切 16 h。酶切产物在0.8%琼脂糖凝胶下,30 V电压,电泳16 h。利用毛细管法将电泳后的酶切产物印迹到尼龙膜上;依据地高辛试剂盒说明书进行杂交及显影过程。
1.6 转 ZmMRP-1基因T2代植株转录水平的检测
T2代阳性及野生型植株统一自交授粉后 3 d、6 d、12 d、15 d、21 d和30 d,用手术解剖刀分离胚乳,迅速放入液氮中保存。采用Trizol法,提取籽粒胚乳总RNA,用RNase-free DNaseⅠ(Thermo)消除基因组DNA;利用M-MLV反转录酶(Invitrogen)把RNA样品反转录成cDNA。所用引物qZmMRP-1F:5′-CCGAACTTCAACAGCGTGTG-3′,qZmMRP-1R:5′-CAGGTAGCCCTGCATCAT-3′,以玉米Actin基因(GRMZM2G126010)为内参基因,根据SYBR Green qRT-PCR(Bio-Rad,Hercules,CA,USA)试剂盒进行操作,qRT-PCR反应在Bio-Rad CFX96 Touch Realtime PCR detection system上进行。试验设置3次生物学重复,以WT中的ZmMRP-1表达量设为1,所有表达倍数使用2-△△Ct计算。反应体系(20 μL):AceQ qPCR SYBR Green Master Mix 10 μL,Primer R (5 μmol/L)0.5 μL,Primer F(5 μmol/L) 0.5 μL ,ROX Reference Dye 0.5 μL,cDNA模板2 μL,ddH2O 6.5 μL。qRT-PCR反应程序:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s(30循环),72 ℃ 5 min。
1.7 转基因材料产量性状分析
以T2代转基因阳性株系OE-8、OE-19,受体材料A188自交系为对照于2019年4月,播种在华中农业大学玉米转基因试验田中,各株系及对照在重复内随机排列,施肥及田间管理一致。待抽雄时,统计株高、穗位高。果穗成熟后,人工收获,统计穗长,穗行数等性状,晒干脱水至恒质量后,测定穗质量、穗粗、粒长、粒宽,称量百粒质量等产量相关性状。
1.8 统计分析方法
采用Excel 2018对试验数据进行初步整理,使用SPSS(版本22.0.0)软件进行单因素方差分析,Duncan’s多重比对完成。
2 结果与分析
2.1 过表达 ZmMRP-1基因载体构建及鉴定
本载体pHZM1N-PZmMRP-1::ZmMRP-1由pHZM1N-Rsc为骨架构建而来,载体中(图1)使用融合基因egfp-iptII作为筛选标记基因,通过热激处理,hsp70热激启动子驱动Cre重组酶基因表达,切除载体LoxP位点间的序列,从而获得无筛选标记的转基因植株。
对构建好的载体通过电击法转入根癌农杆菌菌株EHA105中,提取质粒分别对目的基因ZmMRP-1,筛选标记基因egfp-iptII进行PCR检测(图2),结果表明阳性对照(载体质粒)和农杆菌中提取出来的质粒均扩增出来ZmMRP-1基因片段、筛选标记基因egfp-iptII片段,阴性对照(ddH2O)无条带,并通过测序验证和已知序列一致,表明成功将pH ZM1N-PZmMRP-1::ZmMRP-1表达载体导入到农杆菌EHA105中 。
2.2 农杆菌介导的玉米愈伤遗传转化和转基因植株的PCR检测
采用玉米愈伤组织转基因方法,对ZmMRP-1基因进行玉米遗传转化,转化流程如图3,共获得了121个农艺性状良好的的转基因T0代植株,由于ZmMRP-1来源于玉米,结合对ZmMRP-1基因序列及启动子序列分析,设计鉴定转基因植株特异性引物,检测上游引物在启动子上,而下游引物在目的基因上。通过PCR反应鉴定,来源于12个独立转化事件的30个玉米植株扩增出633 bp与阳性对照相同的目的片段,阴性对照未转基因植株自交系A188无条带,部分检测结果见图4-A。初步说明ZmMRP-1基因已经进入植物体内,阳性率为24.7%。对PCR检测呈阳性幼苗,严格自交授粉,单穂收获。

图1 载体pHZM1N-P ZmMRP-1::ZmMRP-1 T-DNA区Fig.1 Schematic of T-DNA region of pHZM1N-P ZmMRP-1::ZmMRP-1 vector
2.3 转基因植株的整合情况与表达量检测
对部分阳性T1代株系,提取基因组DNA进行酶切,使用ZmMRP-1基因标记特异性探针进行Southern blot检测(图4-B),结果表明OE-8、OE-10、OE-19只有一条杂交信号,且阴性对照非转基因受体植株无条带,说明ZmMRP-1基因已经整合到玉米基因组上,并且以单拷贝的形式存在。为了更加细致的了解ZmMRP-1在转基因玉米中的表达情况,我们利用qRT-PCR对T2代OE-8、OE-19单拷贝株系籽粒胚乳在自交授粉后3 d、6d、12 d、15 d、21 d和30 d进行表达量检测。以同时期野生型材料为对照,发现转基因植株胚乳中ZmMRP-1基因从授粉后3 d开始显著上调,授粉后12 d表达强度达到最高,之后表达量降低,授粉后30 d基本不表达(图4-C)。
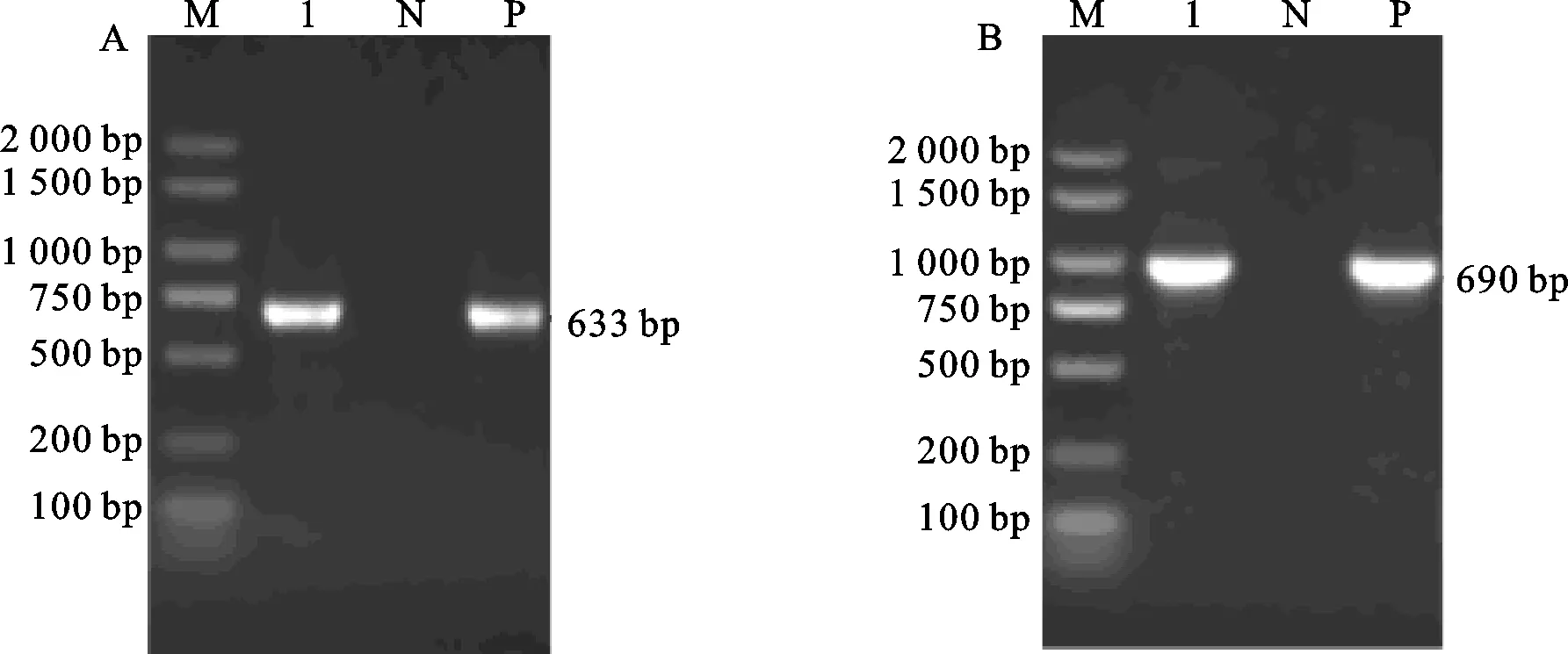
A. ZmMRP-1基因的PCR检测;B.egfp-iptII基因的PCR检测;M.DL 2000 marker,分子量标准;1.质粒PCR;N.阴性对照;P.阳性对照
2.4 转基因植株的产量性状分析
2019年对转ZmMRP-1基因T2代株系OE-8、OE-19以及受体自交系A188进行产量相关性状考察,由图5和表 1可知转基因植株在粒长、粒宽、百粒质量、穗粗、穗质量方面都极显著增加,株高、穗位高、穂长、穂行数、穂粒数方面并未出现明显差异。测量籽粒大小,发现粒长由0.85 cm增至0.90~0.93 cm,增加5.88%~9.41%;粒宽由0.73 cm增至0.77~0.80 cm,增加5.48%~ 9.59%;百粒质量由17.26 g增至 18.67~19.02 g,增加了8.17%~10.20%。结果表明,在玉米中过表达ZmMRP-1基因,通过提高玉米籽粒粒宽、粒长、百粒质量的方式以达到改善玉米产量相关性状目的。

A.转 ZmMRP-1基因植株的PCR检测,M.DL2000 marker,1-4.转基因植株,N.阴性对照,P.阳性对照;B.转 ZmMRP-1基因的Southern blot检测,M.DNAmarker,P.阳性质粒对照,WT.非转基因植株基因组DNA,OE-18、OE-10、OE-19转基因植株基因组DNA,经KpnI单酶切后,使用基因特异性探针进行杂交;C.转 ZmMRP-1基因材料授粉后不同时间表达量,图中所示数据为3次生物学重复的平均值±标准差
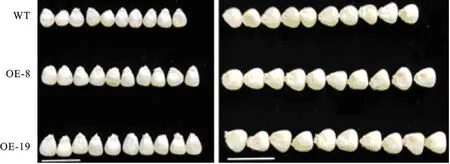
WT.未转基因A188自交系,OE-8、OE-19为过表达 ZmMRP-1玉米株系,Bar=2 cm
3 讨论与结论
玉米的产量主要受到源、库、流的影响,三者之间既相互促进,又相互制约[24],根据玉米高产理论指导,从这三个主要途径采取常规措施,提高玉米的产量的科学研究都有报道[25-27]。通过基因工程手段,在玉米中过量表达与源、库、流的相关基因,也可以为创制高产玉米新材料提供帮助。如在玉米中过量表达谷氨酰胺合成酶Gln1-3基因,转基因植株功能叶氮含量和光合效率明显高于对照,进而增加产量[28];在玉米中过表达细胞壁转化酶基因,显著增强了光合产物运输中卸载能力,增加玉米粒质量和粒数并提高淀粉含量[2];转海藻糖-6-磷酸酯酶基因,降低了糖合成代谢的抑制信号,解除了籽粒中的糖合成代谢的限制因素,进而提高玉米正常和干旱条件下的产量[29];增强KNR6基因的表达,能够促进玉米果穗的发育,增加了玉米穂长和行粒数,来提高玉米库容量[30]。“流”作为三个要素的中间环节,连接源和库。叶片运出同化物到贮存或活跃生长的“库”的运输是由若干个生理过程和结构所控制的,是一个高度完整的体系,包括韧皮部的装载、筛管中运输、韧皮部卸出和同化物的重新吸收[24]。在维管束组织与胚乳之间的营养物质传递中,玉米胚乳基部传递细胞层处于“流”中的关键环节,对胚乳吸收营养成分具有起着重要的作用。另外,ZmMRP-1是调节下游许多基因表达的转录因子,但是关于ZmMRP-1基因自身的调控目前的研究不多。玉米ZmMRP-1的启动子转录活性,受到细胞壁转化酶的活性调节,也即受到蔗糖浓度的调节[31]。在这里ZmMRP-1基因的调控通路与蔗糖在转移细胞层的卸载转运等发生了密切的联系,但具体的机制还不清楚。而本试验中,转化基因ZmMRP-1是用的自身启动子,同样会受到上游转化酶活性和蔗糖的调节。同时,增强表达的ZmMRP-1基因又会调节下游的基因加强转录。目前对本实验中得到的转基因材料还暂时没有开展上游和下游方面的研究。如果能进一步的深入探索阐明相关调控网络系统的具体细节,再通过遗传操作技术,解除抑制环节,增强促进环节,应该有更好的效果。

表1 转 ZmMRP-1基因植株农艺性状Table 1 Agronomic characters of ZmMRP-1 transgenic plant
在基因转录水平的调节中,基因的启动子是影响转录水平进而决定性状表现的重要因素之一,利用具有特异性调控作用的启动子和增强子是受体植物外源基因表达效率的关键[32]。目前启动子大致有三类,组成型启动子、诱导型启动子和组织特异性启动子。组成型表达启动子如水稻Actin1、玉米Ubi、35S等较早应用于植物转基因工程中,但其往往在所有植物组织中转录,时空特异性差,使植物能耗增加,还容易导致基因沉默[33]。一些研究表明,选择合适的某个组织特异性启动子可以避免非预期表型的产生,以及降低植物能耗,以保证目的基因在所预期的位置准确高量的表达[34]。在本研究中,目的基因由自身启动子启动,在启动子前方有四个串联而成的35S增强子序列,35S增强子只增强邻近基因的表达,而不改变相邻基因的特异表达时空性[35-37],以保证ZmMRP-1基因能够在粒质量形成的关键时期和关键的部位高效的表达。对转基因ZmMRP-1的阳性玉米材料的转录检测,说明它只在授粉后的胚乳过量表达,在授粉后12 d达到峰值。同时,阳性玉米材料的农艺性状与阴性对照没有显著差别,也间接说明转ZmMRP-1基因没有干扰其他部位的发育。
本研究利用转基因的方法,成功获得了过表达ZmMRP-1基因单拷贝株系,通过提高粒长、粒宽、百粒质量等方式,进而改良了玉米产量相关性状,但由于转基因受体为A188自交系,其植株矮小,产量较低,不能直接用于玉米高产杂交育种亲本。需要将该转基因材料回交导入骨干自交系中,进一步鉴定过表达ZmMRP-1基因的增产效应,然后作为玉米高产育种的基础材料。
