血清肿瘤标志物联合检测在乳腺癌诊断中的临床价值分析
2020-12-04叶晓芳林小菊黄妹李木珍
叶晓芳,林小菊,黄妹,李木珍
(1.广东医科大学附属第二医院检验科,广东湛江 524000;2.产休三区)
乳腺癌作为女性常见恶性肿瘤,对患者身心健康威胁较大,早期发现并及时诊治对改善患者预后具有重要影响[1]。乳腺癌发病早期无典型症状,采用免疫组化、乳腺钼靶X 线及超声检查误诊、漏诊率较高[2]。近年来,血清肿瘤标志物在乳腺癌诊断中逐渐应用,但单项肿瘤标志物诊断往往存在假阳性或假阴性现象,易影响临床诊断结果[3]。鉴于此,本研究将分析糖类抗原153(carbohydrate antigen 153,CA153)、糖类抗原125(carbohydrate antigen 125,CA125)、癌胚抗原(carcinoembryonic antigen,CEA)、人类表皮生长因子受体-2 (human epidermal growth factor receptor-2,HER-2) 联合检测在乳腺癌诊断中的临床价值。
1 资料与方法
1.1 一般资料 选取2017 年11 月至2019 年10月在我院治疗的78 例乳腺癌患者为乳腺癌组,选取同期我院治疗的乳腺良性疾病患者80 例作为乳腺良性疾病组,选取同期到我院体检健康者80 例作为对照组。其中乳腺癌组年龄51~75 岁,平均年龄(62.18±2.53) 岁;临床分期Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期分别为10 例、13 例、30 例、25 例。乳腺良性疾病组年龄51~76 岁,平均年龄(62.24±2.56) 岁,其中32 例为脂肪瘤,48 例为纤维瘤。对照组年龄48~79 岁,平均年龄(62.30±2.61) 岁。3 组年龄比较差异无统计学意义。本研究经医院伦理委员会批准。
1.2 纳入及排除标准 纳入标准:(1) 乳腺癌组和乳腺良性疾病组均经临床症状、超声及病理诊断确诊;(2) 精神状态良好,理解、交流能力正常;(3) 签署知情同意书。排除标准:(1) 既往接受过放、化疗治疗者;(2) 肿瘤全身广泛转移者;(3) 合并其他部位恶性肿瘤者。
1.3 方法 采集入选者空腹静脉血3~4 ml,3 000 r/min,离心半径16 cm,离心5 min,取血清,采用化学发光法测定血清CA153、CA125、CEA、HER-2 水平,仪器为全自动化学发光免疫分析仪(E411 型,罗氏公司提供),均采用配套试剂检查。CA153、CA125、CEA、HER-2 正常参考值分别为0~25 U/ml、0~35 U/ml、0~3.5 μg/ml、0~15 ng/ml,检测结果超过正常参考值上限即判定为阳性。
1.4 评价指标 (1) 比较3 组血清CA153、CA125、CEA、HER-2 水平。(2) 计算乳腺疾病患者CA153、CA125、CEA、HER-2 阳性检出率,联合检测任意一项为阳性即判定为阳性结果。以病理诊断结果作为金标准,计算CA153、CA125、CEA、HER-2 单项及联合诊断敏感度、特异度及准确率,敏感度=真阳性/(真阳性+假阴性) ×100%;特异度=真阴性/(真阴性+假阳性) ×100%;准确率= (真阳性+真阴性) /(真阳性+假阴性+假阳性+真阴性) ×100%。
1.5 统计学方法 采用SPSS 22.0 软件进行统计学分析,计数资料用[n(%)]表示,采用χ2检验;计量资料采用均数±标准差表示,3 组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 血清CA153、CA125、CEA、HER-2 水平比较 乳腺癌组血清CA153、CA125、CEA、HER-2水平均高于乳腺良性疾病组和对照组(P<0.05),见表1。
表1 3 组血清CA153、CA125、CEA、HER-2 水平比较()
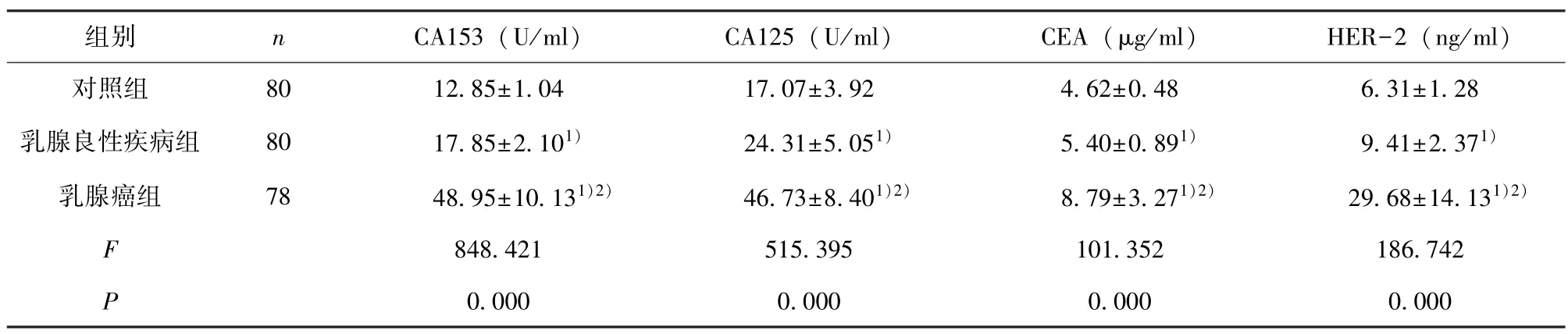
表1 3 组血清CA153、CA125、CEA、HER-2 水平比较()
注:与对照组比较,1)P<0.05;与乳腺良性疾病组比较,2)P<0.05
2.2 乳腺疾病患者CA153、CA125、CEA、HER-2阳性检出率比较 乳腺癌组CA153、CA125、CEA、HER-2 阳性检出率高于乳腺良性疾病组(P<0.05),见表2。
2.3 CA153、CA125、CEA、HER-2 单项及联合诊断结果 CA153+CA125+CEA+HER-2 联合诊断敏感度、准确率高于各单项指标检查结果,差异有统计学意义 (χ2=13.766、19.975、10.372、7.252,P=0.000、0.000、0.001、0.007;χ2=11.965、18.890、9.286、6.045,P= 0.001、0.000、0.002、0.014);CA153 +CA125 +CEA +HER-2 联合诊断特异度与各单项指标检查结果相比,差异无统计学意义 (χ2=0.754、1.839、0.754、0.360,P= 0.385、0.0175、0.385、0.548)。见表3、4。
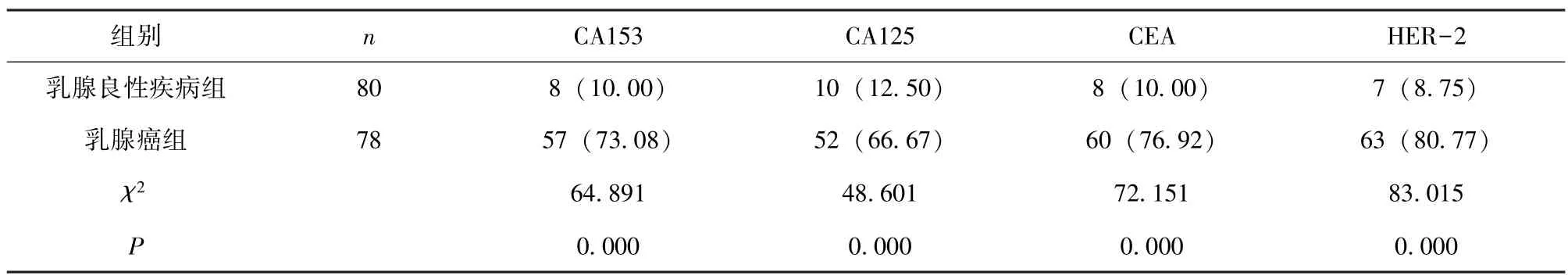
表2 乳腺疾病患者CA153、CA125、CEA、HER-2 阳性检出率比较[n (%)]
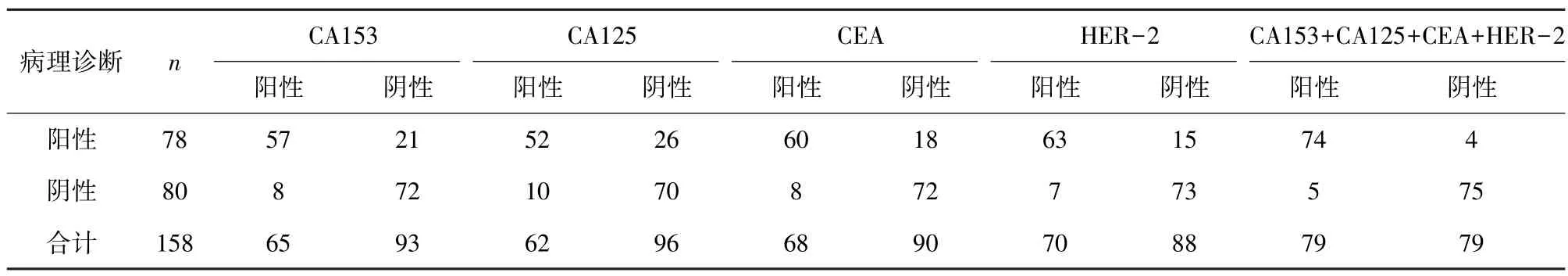
表3 各指标单项及联合诊断结果与病理诊断情况
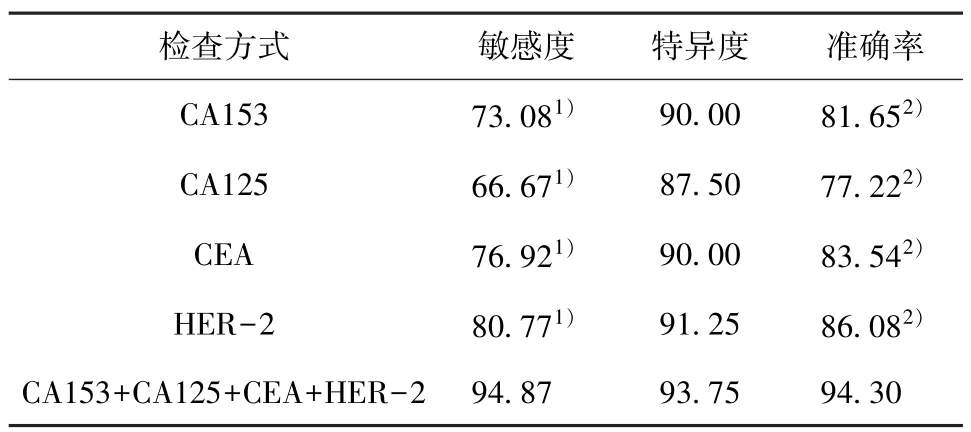
表4 5 种检查方式诊断情况比较(%)
3 讨论
流行病学调查显示,乳腺癌发生率已居女性恶性肿瘤第三位,发病年龄较轻且死亡率较高,多数患者早期无明显症状,待就诊时已处于中晚期或出现转移,预后较差[4]。肿瘤细胞癌变过程中,癌基因表达生成的抗原或其他活性物质即为肿瘤标志物,可于患者体液中检出,但在良性疾病及正常组织中产生较少或不产生[5]。由于肿瘤基因复杂性,同一肿瘤含有一种或多种肿瘤标志物,存在不同特性细胞,且不同肿瘤中会出现共同肿瘤标志物,故选取敏感度、特异度较高的肿瘤标志物联合检测有助于对肿瘤作出鉴别及诊断。
CA153 为乳腺癌诊断中特异性较高肿瘤标志物,乳腺癌患者血清中CA153 水平较高,但在其他种类肿瘤患者血清中水平也较高,故单独使用CA153 诊断乳腺癌局限性较大[6]。CA125 水平在卵巢癌、输卵管癌、子宫内膜癌患者血清中明显上升,但有研究指出,CA125 亦存在于乳腺癌细胞中,并可向外周血中释放[7]。CEA 属于非器官特异性肿瘤标志物,结直肠癌、胰腺癌及肺癌患者中CEA 水平较高,同时乳腺导管原位癌中CEA呈高表达,为乳腺组织癌变中早期标志物[8]。HER-2 作为原癌基因,可通过对乳腺癌原发灶、转移灶中HER-2 水平进行测定,评估后期治疗效果[9]。万军[10]研究中指出,CA153、CA125、CEA、HER-2 联合检测能够提升乳腺癌诊断敏感度,弥补单项指标检查中的不足,提升乳腺癌诊断效能。本研究结果显示,乳腺癌组血清CA153、CA125、CEA、HER-2 水平高于乳腺良性疾病组和对照组,乳腺癌组CA153、CA125、CEA、HER-2 阳性检出率高于乳腺良性疾病组,CA153 +CA125+CEA+HER-2 联合诊断敏感度、准确率高于各单项指标检查结果,与上述研究结果较为相似。由此可见,乳腺癌患者血清中 CA153、CA125、CEA、HER- 2 呈高表达,联合检测CA153、CA125、CEA、HER-2 将提升乳腺癌诊断准确率,降低漏诊、误诊率,进而可为乳腺癌诊断、治疗方案的制定提供参考。
综上所述,乳腺癌患者血清中 CA153、CA125、CEA、HER-2 水平较高,且上述指标联合检测有助于提升乳腺癌诊断敏感度及准确率。
