miR-127靶向驱动蛋白KIF3B调控肺鳞癌紫杉醇药物敏感性的研究
2020-12-04丁旭萍张丹红
丁旭萍,张丹红,陈 影*
0 引言
近年来,随着肿瘤精准医疗的深入发展,对于肿瘤生物学特性和基因的深入理解越来越受到众多学者的高度重视,成为分子靶向药物和放化疗增敏剂开发的“敲门砖”。其中miRNAs在肿瘤细胞增殖、凋亡、迁移、化疗耐药等过程中发挥重要作用[1]。肺鳞癌(Squamous cell lung cancer,SQCLC)是非小细胞肺癌中的常见类型,由于早期症状不典型,很多患者确诊时已进展至中晚期,因此化疗选择必不可少[2],但是80%以上的患者会出现继发性耐药,从而导致治疗失败或预后不良[3]。紫杉醇是肺鳞癌患者最重要的化疗药物之一,通过促进细胞内微管蛋白聚合并抑制其解聚,从而诱导细胞周期阻滞,抑制有丝分裂,达到促使肿瘤细胞凋亡的目的[4]。驱动蛋白Kinesin家族成员3B(kinesin family member 3B,KIF3B)是定位于肿瘤细胞中心纺锤体、调控后期纺锤体运动和胞质分裂的关键分子之一[5]。生物信息学分析结果显示,KIF3B可能是miR-127的靶基因,因此本研究旨在证实miR-127和KIF3B在肺鳞癌细胞中的表达变化和相关性,并分析上调miR-127表达对肺鳞癌细胞紫杉醇敏感性的影响及可能的作用机制,从而为提高肺鳞癌患者对紫杉醇的临床获益提供新的思路。
1 材料与方法
1.1 材料 人肺鳞癌细胞系NCI-H520、NCI-H226以及正常永生化肺上皮细胞BEAS-2B购自美国菌种保藏中心。人肺鳞癌细胞系SK-MES-1购自中国科学院上海细胞库。所有细胞冻存在本实验室的液氮中,复苏后接种于DMEM完全培养基(90%DMEM培养液+10%胎牛血清+100U/mL青-链双抗)中,置于37 ℃、5%CO2、饱和湿度的细胞培养箱中常规培养。紫杉醇(Paclitaxel,PTX)购自美国Cell Signaling Technology公司,货号:#9807,纯度>99.5%(HPLC),保存于-20 ℃。用前将1 mg PTX溶于1.15 ml二甲基亚砜(Dimethyl sulfoxide,DMSO)中,配制成1 mmol/L PTX储备液,置于-20 ℃条件下保存。
杜氏改良Eagle培养基(Dulbecco′s modified eagle medium,DMEM)和Opti-MEM培养基购自美国Hyclone公司;胎牛血清、Trizol试剂购自美国ThermoFisher公司;逆转录试剂盒、TaqMan®MicroRNA Assays、SYBR Green PCR Master Mix试剂盒购自日本TaKaRa公司;LipofectamineTM2000转染试剂和噻唑蓝(MTT)试剂购自美国Invitrogen公司;Annexin V-FITC/PI_双染细胞凋亡检测试剂盒购自北京Solarbio公司;miR-127模拟物(mimics)及其阴性对照(miR-NC)购自上海生工生物工程有限公司;pcDNA3.1购自上海慕远公司;KIF3B兔源多克隆抗体和HRP标记的山羊抗兔IgG购自美国Abcam公司。
1.2 方法
1.2.1 实时荧光定量PCR检测各细胞中miR-127和KIF3B mRNA表达 采用Trizol法提取1×108个细胞总RNA,Trizol试剂提取细胞总RNA,将RNA样本溶解分装后,-80 ℃保存备用。采用逆转录试剂盒进行逆转录反应,合成cDNA。并将逆转录产物进行PCR扩增,以2-ΔΔCt表示目的基因mRNA相对表达量。引物序列见表1。

表1 引物序列汇总表
1.2.2 人肺鳞癌PTX耐药细胞株SK-MES-1/PTX的建立 收集对数期生长的SK-MES-1细胞,调整细胞浓度为1×105/ml,采用梯度浓度递增法建立SK-MES-1/PTX耐药细胞株。首先加入0.1 nmol/L诱导剂量PTX,培养2~3周后,依次递增PTX作用终浓度:0.2、0.5、1.0、2.0、5.0、10.0、20.0 nmol/L,每个梯度浓度培养2~3周。经过6个月的诱导期,获得可在20 nmol/L PTX浓度下稳定生长的耐药细胞株SK-MES-1/PTX。
1.2.3 细胞转染和分组 取生长状态良好的SK-MES-1/PTX细胞,调整细胞浓度1×105/ml,提前1 d在备行转染的6孔板上接种1 ml,常规培养,24 h后更换为Opti-MEM培养基。配制转染试剂-DNA质粒复合物(取3 μl稀释后的LipofectamineTM2 000试剂加入至已稀释好的100 μl DNA质粒中,混匀后,室温孵育20 min)。将转染试剂-DNA质粒复合物加入至细胞中,完全覆盖细胞,分别介导转染miR-127 mimics、pcDNA-KIF3B质粒或空质粒(miR-NC)。37 ℃转染48 h,取出观察细胞形态。并采用实时荧光定量PCR法检测细胞中miR-127和KIF3B表达量。根据转染情况,将SK-MES-1/PTX细胞分为空白(对照)组、阴性(对照)组、miR-127 mimics组和miR-127 mimics+pcDNA-KIF3B组。
1.2.4 双荧光素酶报告基因实验 通过YearthBio构建KIF3B-3′UTR野生型序列,并插入pGL3荧光素酶载体中构建KIF3B-3′UTR-WT质粒,另采用Easy Mutagenesis System 构建KIF3B-3′UTR突变序列,插入pGL3荧光素酶载体中构建KIF3B-3′UTR-MUT质粒。将表达载体pcDNA-EGFP-pre-miR-127或空质粒分别与KIF3B-3′UTR-WT质粒或KIF3B-3′UTR-MUT质粒共转染至SK-MES-1/PTX细胞中。转染48 h后,采用Promega GloMaxTM20/20 发光检测仪检测荧光素酶活性。
1.2.5 MTT法检测细胞增殖 取生长状态良好的SK-MES-1细胞或SK-MES-1/PTX细胞,调整细胞浓度1×104/ml,按100 μl/孔单层接种至96孔板中,24 h贴壁后更换为含药培养基。SK-MES-1细胞培养板中PTX终浓度分别为0.1、0.5、1.0、5.0、10.0、20.0、50.0、100.0、200.0 nmol/L;SK-MES-1/PTX细胞培养板中PTX终浓度分别为10.0、20.0、50.0、100.0、200.0、500.0、1 000.0、2 000.0 nmol/L,每组设置8个复孔。作用48 h后,采用MTT法检测吸收波长为490 nm处的吸光光度值(A值),根据公式A计算细胞增殖抑制率(%)并绘制剂量-效应曲线。计算细胞对PTX的半数抑制浓度(50% inhibition concentration,IC50)。根据公式B计算耐药指数。
公式A:细胞增殖抑制率(%)=[1-(A实验组-A空白组)]/A空白组×100%
公式B:细胞耐药指数(RI)=SK-MES-1/PTX细胞IC50/SK-MES-1细胞IC50
1.2.6 Annexin V-FITC/PI双染法检测细胞凋亡 将各组SK-MES-1/PTX细胞经100 nmol/L PTX处理48 h后,收集各组细胞约1×107/ml,采用Annexin V-FITC/PI双染细胞凋亡检测试剂盒进行染色,采用流式细胞仪检测。
1.2.7 蛋白免疫印迹法(Western blot)检测KIF3B蛋白表达量 收集生长状态良好的SK-MES-1细胞或SK-MES-1/PTX细胞,约1×107个,加入RIPA细胞裂解液冰浴裂解,提取细胞总蛋白;Baradford法检测蛋白浓度。取2 μg蛋白样品变性后进行10%SDS-PAGE凝胶电泳;聚偏二氟乙烯转膜;5%脱脂奶粉封闭1 h;一抗(KIF3B抗体1∶500稀释,一抗孵育完后需回收)孵育过夜;即用型二抗孵育1 h;ECL显影;用成像系统扫描靶条带的灰度值,并用内参GAPDH校正误差。
2 结果
2.1 人肺鳞癌细胞系NCI-H520、NCI-H226、SK-MES-1和人正常永生化肺上皮细胞BEAS-2B中miR-127和KIF3B蛋白的表达差异 如图1所示,经实时荧光定量PCR法和Western blot法检测,与BEAS-2B细胞相比,NCI-H520、NCI-H226、SK-MES-1细胞中miR-127表达量降低(图1A),KIF3B蛋白表达量升高(图1B、图1C),差异有统计学意义(P<0.05)。
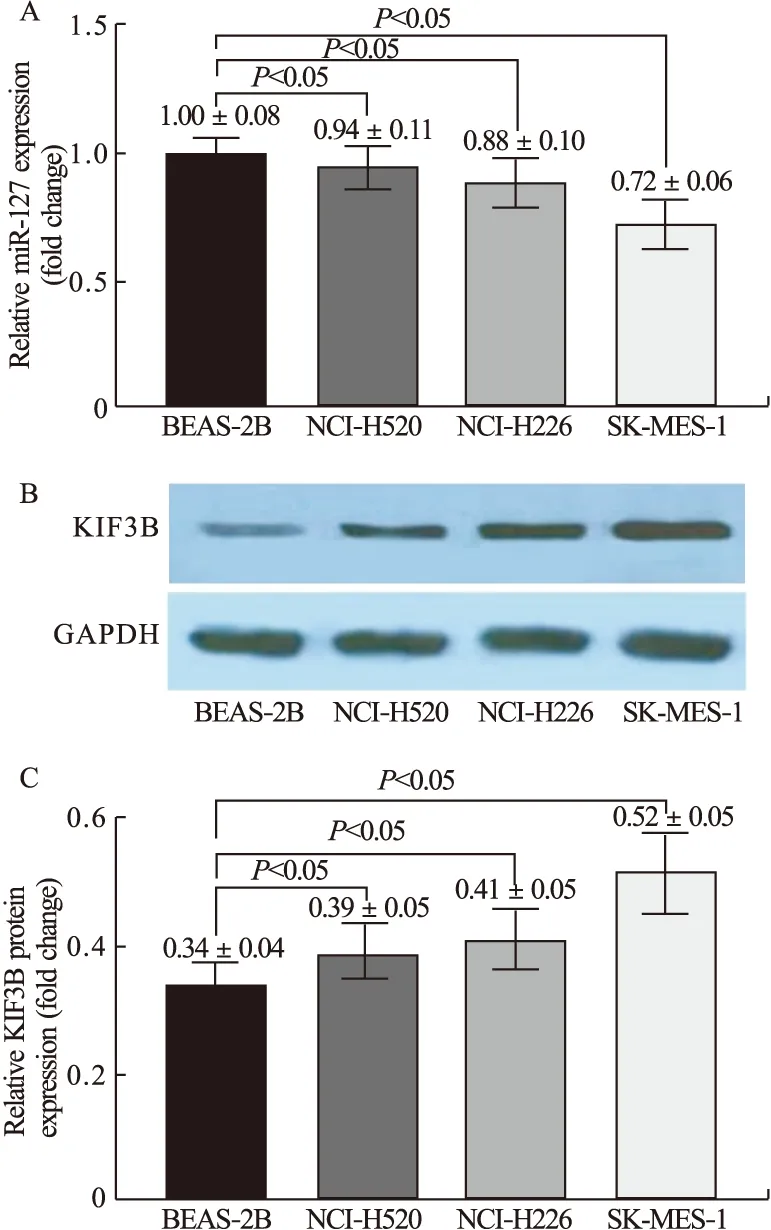
图1 人肺鳞癌细胞系NCI-H520、NCI-H226、SK-MES-1和人正常永生化肺上皮细胞BEAS-2B中miR-127(A)和KIF3B蛋白(B&C)的表达差异
2.2 SK-MES-1/PTX耐药细胞株的建立及验证 经过6个月的诱导期,成功建立可在20 nmol/L PTX浓度下稳定生长的耐药细胞株SK-MES-1/PTX。如图2所示,经MTT法检测,随着PTX作用浓度增加,对SK-MES-1细胞和SK-MES-1/PTX细胞增殖的抑制率逐渐增加。相同PTX浓度条件下,PTX对SK-MES-1/PTX细胞增殖的抑制率低于SK-MES-1细胞,差异有统计学意义(P<0.05)。PTX抑制SK-MES-1细胞和SK-MES-1/PTX细胞增殖的IC50分别为(19.02±1.13)nmol/L和(180.65±4.85)nmol/L。SK-MES-1/PTX细胞对PTX的耐药指数为(9.50±0.64)。
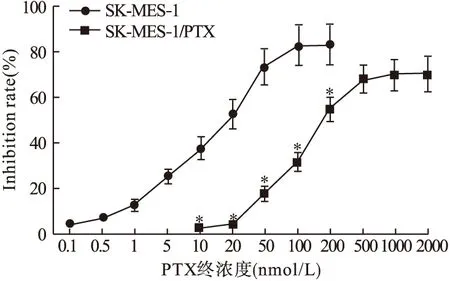
图2 不同剂量对SK-MES-1细胞和SK-MES-1/PTX细胞增殖的抑制率(n=8)注:与相同浓度条件下SK-MES-1细胞增殖抑制率比较,*P<0.05
2.3 SK-MES-1/PTX耐药细胞中miR-127和KIF3B蛋白表达 如图3所示,经实时荧光定量PCR法和Western blot法检测,与SK-MES-1细胞相比,SK-MES-1/PTX细胞中miR-127表达量降低(图3A),KIF3B蛋白表达量升高(图3B、图3C),差异有统计学意义(P<0.05)。
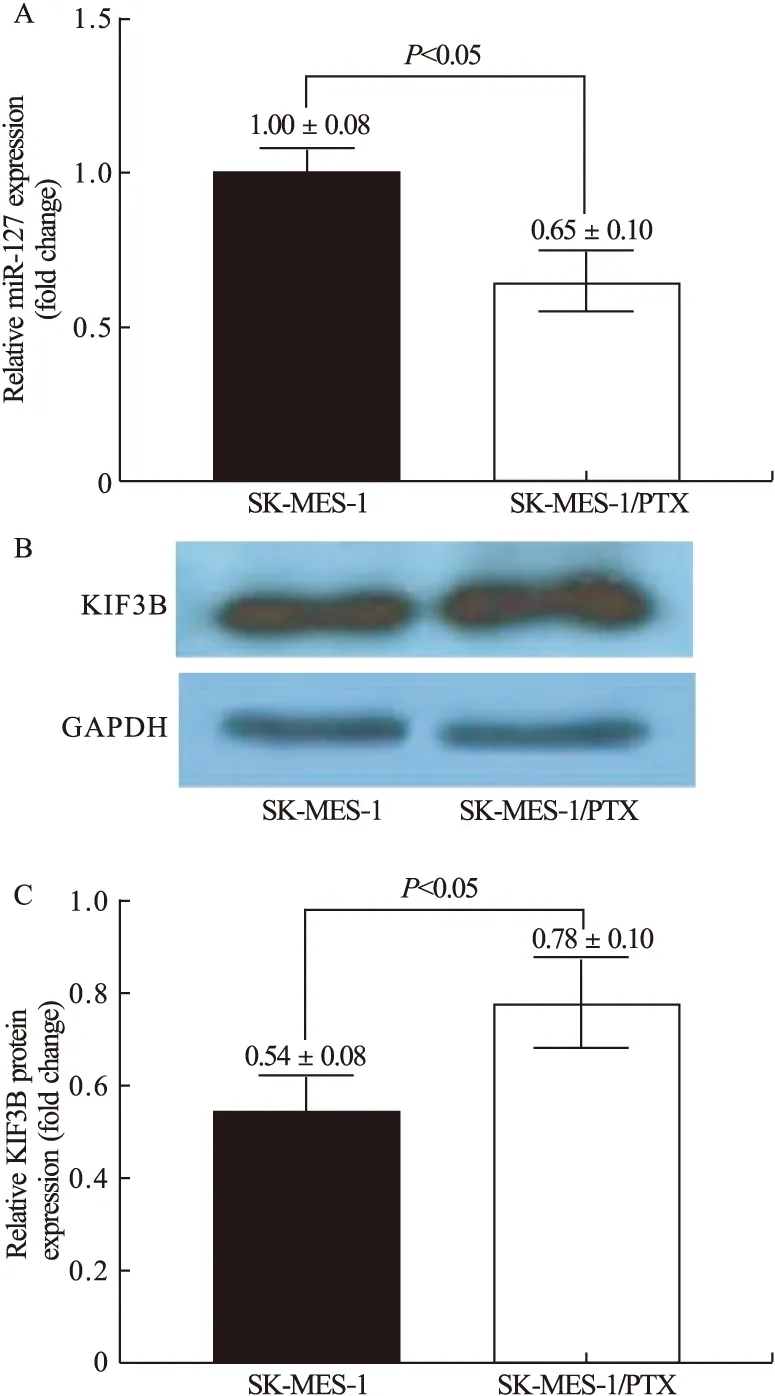
图3 SK-MES-1/PTX耐药细胞和亲本细胞SK-MES-1中miR-127(A)和KIF3B蛋白(B&C)的表达差异
2.4 双荧光素酶基因报告分析 根据TargetScan在线数据库预测,KIF3B可能是miR-127的下游靶基因。如图4所示,将KIF3B-3′-UTR-WT质粒和miR-127 mimics共转染之后,荧光酶活性减弱,与KIF3B-3′-UTR-WT质粒和NC-mimics共转染组相比,差异有统计学意义(P<0.05),而将KIF3B-3′-UTR-MUT质粒和miR-127 mimics共转染之后,荧光酶活性几乎无变化。
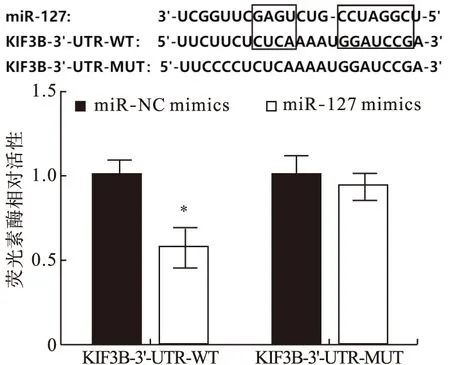
图4 双荧光素酶报告基因实验检测miR-127和KIF3B基因的靶向调控关系注:与miR-NC组相比,*P<0.05
2.5 SK-MES-1/PTX耐药细胞转染效果验证 如图5所示,经实时荧光定量PCR法检测,与空白组和阴性组相比,miR-127 mimics组SK-MES-1/PTX细胞中miR-127表达量升高(图5A),而miR-127 mimics+pcDNA-KIF3B组KIF3B mRNA表达量亦升高(图5B),差异有统计学意义(P<0.05)。

图5 各组SK-MES-1/PTX细胞miR-127(A)和KIF3B mRNA(B)相对表达量
2.6 各组SK-MES-1/PTX耐药细胞对PTX的敏感性
2.6.1 MTT法检测PTX对各组细胞增殖抑制情况 如图6所示,经MTT法检测,随着PTX作用浓度增加,对各组SK-MES-1/PTX细胞增殖的抑制率逐渐增加。相同PTX浓度条件下,PTX对miR-127 mimics组SK-MES-1/PTX细胞增殖的抑制率最高,而对miR-127 mimics+pcDNA-KIF3B组细胞增殖的抑制率最低,差异有统计学意义(P<0.05)。PTX抑制miR-127 mimics组和miR-127 mimics+pcDNA-KIF3B组SK-MES-1/PTX细胞增殖的IC50分别为(115.35±10.94)nmol/L和(220.47±15.86)nmol/L,对PTX的耐药指数分别为(6.06±0.58)和(11.59±1.28)。

图6 不同剂量对各组SK-MES-1/PTX细胞增殖的抑制率(n=8)
2.6.2 流式细胞术检测PTX对各组细胞凋亡的影响 如图7所示,100 nmol/L PTX作用于空白组、阴性组、miR-127 mimics组和miR-127 mimics+pcDNA-KIF3B组SK-MES-1/PTX细胞48 h后,细胞凋亡率分别为(14.50%±2.33%)、(16.12%±3.24%)、(33.69%±5.48%)、(15.72%±2.67%),经单因素方差分析,差异有统计学意义(P<0.05),miR-127 mimics组SK-MES-1/PTX细胞凋亡率较空白组增加,而miR-127 mimics+pcDNA-KIF3B组SK-MES-1/PTX细胞凋亡率较miR-127 mimics组降低。
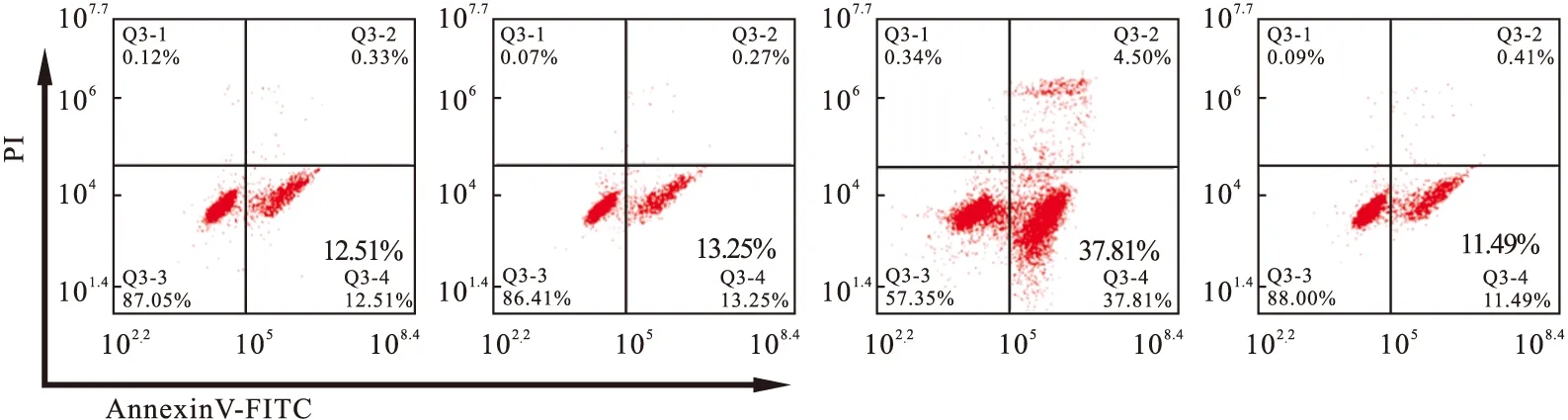
图7 经流式细胞术检测PTX对各组SK-MES-1/PTX细胞凋亡的影响
3 讨论
肺鳞癌耐药表型的形成是一个涉及多因素、多步骤、多阶段的复杂过程,包括关键基因发生遗传学或表观遗传学改变、相关信号通路的激活、肿瘤细胞损伤后自我修复能力增强等[6],miRNAs在各个环节的上游都发挥着关键作用。因此,众多miRNAs不仅是预测肺癌化疗药物敏感性的潜力指标,而且miRNAs类似物或抑制剂还有望成为临床提高化疗药物敏感性的精准医疗手段之一。
人类miR-127位于染色体14q32.31,该区域属于DLK/GTL2的印迹区域,在多种肿瘤细胞中表达量下调,包括非小细胞肺癌[7]、胃癌[8]、乳腺癌[9]等。因此,我们推测miR-127在部分组织癌变过程中可能发挥着抑癌基因的活性。在本研究中,通过实时荧光定量PCR法检测也证实,人肺鳞癌细胞系NCI-H520、NCI-H226、SK-MES-1中miR-127的表达量低于人正常永生化肺上皮细胞BEAS-2B,尤其以SK-MES-1细胞中miR-127表达量最低。说明miR-127在肺鳞癌细胞癌变过程中可能也属于功能性基因。这与李建波等[10]的研究结论基本一致。李建波等[10]发现,miR-127在肺癌组织中的表达量较癌旁正常组织降低,并且随着病理分期恶性程度的增高,降低更明显;从而推断miR-127对肺癌的增殖、转移均有重要影响,有望成为肺癌早期诊疗的重要靶点。此外,阮鹏等[11]发现,化疗抵抗的食管癌患者血清中miR-127水平显著高于化疗敏感患者,并通过多因素Logistic回归分析,证实血清miR-127水平的升高可能是预测鼻咽癌患者化疗抵抗的重要危险因素。基于上述研究事实,推测miR-127在肿瘤细胞化疗耐药过程中可能也发挥重要作用。
为了进一步证实该推断的可靠性,我们选择SK-MES-1细胞通过浓度梯度递增法构建PTX耐药细胞株。6个月后,最终获得可在20 nmol/L PTX浓度下稳定生长的耐药细胞株SK-MES-1/PTX,并置于本院细胞实验室的液氮罐中长期保存。通过实时荧光定量PCR法检测,SK-MES-1/PTX耐药细胞株中miR-127表达量较SK-MES-1细胞进一步降低,提示miR-127可能与肺鳞癌细胞化疗耐药的发生有一定关联。因此,我们通过质粒转染技术将miR-127 mimics转染至SK-MES-1/PTX细胞中,上调miR-127表达,结果显示,PTX对miR-127 mimics组SK-MES-1/PTX细胞增殖的抑制率和凋亡率均显著升高,说明miR-127表达量下调可能是肺鳞癌细胞SK-MES-1对紫杉醇作用产生抗性的重要原因之一。
除此以外,我们通过TargetScan在线生物信息学软件检索发现,miR-127和KIF3B基因存在靶向互补序列,并通过双荧光素酶报告基因分析,miR-127对KIF3B有一定的靶向调控作用。而且通过Western blot法检测也证实,与SK-MES-1细胞相比,SK-MES-1/PTX细胞中miR-127表达量降低,KIF3B蛋白表达量上调。通过质粒转染技术,上调miR-127 mimics组SK-MES-1/PTX细胞中KIF3B基因表达后,其对PTX的敏感性受到一定程度的抑制,说明miR-127可能通过抑制KIF3B基因转录过程,发挥抑癌基因的活性。
KIF3B驱动蛋白是一类能够利用本身的自由能和ATP水解释放的化学能等向微管发生定向运动的具有保守马达结构的蛋白分子,一方面参与细胞组分的运输,另一方面与染色体结构和有丝分裂过程中纺锤体的运动密切相关。早在本世纪初,赵健等[12]发现,驱动蛋白Rbkinesin-6在人肺腺癌细胞系A549的有丝分裂末期/胞质分裂最后阶段发挥着关键作用,沉默Rbkinesin-6基因可以抑制A549细胞的增殖活性。Gan等[13]也证实,驱动蛋白KIF2C在非小细胞肺癌组织中呈高表达,且与患者高T分期、低-未分化、淋巴结转移以及预后不良密切相关,而敲除KIF2C基因表达后,肿瘤细胞的增殖和迁移能力则显著降低,而且通过双荧光素酶报告基因显示,miR-325对KIF2C可能具有一定的靶向调控作用。因此,驱动蛋白作为肿瘤治疗靶点早已成为公认的事实,近几年,以驱动蛋白为靶点的抗癌药物研究也取得了长足进展[14]。但是多数研究只是针对驱动蛋白在肺癌细胞增殖、凋亡、异常有丝分裂、侵袭转移等过程中的作用[15],往往忽视其对肿瘤细胞化疗耐药的影响。本研究发现,KIF3B驱动蛋白分子在肺鳞癌细胞SK-MES-1对PTX耐药中也属于功能性因子,从而为重新认识驱动蛋白家族的作用提供了新的思路。
综上所述,对PTX耐药的肺鳞癌细胞中miR-127表达量降低,KIF3B蛋白表达量升高,并且两者之间存在一定的靶向调控关系。上调miR-127表达可增加SK-MES-1/PTX耐药细胞对PTX的敏感性,其作用机制可能与抑制驱动蛋白KIF3B分子表达有关。
