食用槟榔加工过程中真菌群落组成及变化研究
2020-12-04张祺玲陈雪梅徐远芳周毅吉冯彦勇李文革
张祺玲 彭 玲 陈雪梅 徐远芳 周毅吉 冯彦勇 李文革,*
(1湖南省核农学与航天育种研究所/湖南省农业生物辐照工程技术研究中心/生物辐照技术湖南省工程研究中心, 湖南 长沙 410125;2湖南口味王集团有限责任公司,湖南 益阳 413001)
槟榔(ArecacatechuL.)为四大南药(槟榔、砂仁、益智、巴戟天)之首,由于槟榔咀嚼食用后带来的欣快感和轻微兴奋性致使许多人痴迷,因此全球约有6~7亿人咀嚼槟榔,广泛流行于亚洲地区,目前已成为世界上继烟草、酒精和咖啡之后的第四大广泛使用的嗜好品[1]。我国槟榔消费人口超5 000万,消费地域覆盖全国,主要集中在湖南地区[2]。同时湖南作为我国槟榔深加工中心,加工全国95%以上的槟榔,行业总产值超200亿元,且每年以10%~20%的速度增长[3]。
随着槟榔加工行业的日益发展,食用槟榔消费人群日益庞大,食用槟榔所存在的微生物超标和食品添加剂滥用等食品安全问题日益凸显,虽然近年来国家法律法规不断完善,监管部门执法力度不断增强,槟榔企业安全意识不断提高,食用槟榔的化学污染得到了有效控制,但由于食用槟榔加工流程复杂、加工工艺局限等原因,微生物污染尤其是霉变问题虽有所改善但依然是槟榔加工过程中亟待解决的主要质量安全风险[4-5]。因此,对食用槟榔加工过程中的真菌多样性进行评价极为必要。
以Illumina MiSeq测序平台为代表的第2代测序技术具有通量高、检测速度快、能实现多样本分析及关联分析等特点[6-8],已广泛运用于肠道[9-11]、土壤[12-14]和发酵食品[15-17]等相关微生物的多样性研究,其在食品微生物分子生态学研究领域的应用已逐步发展为评价食品微生物群落结构变化、监测食源性病原菌动态特征以及控制食品质量等的首选方法[18]。本研究采集了食用槟榔加工过程中不同阶段的槟榔籽样品,基于高通量测序技术对不同加工阶段的食用槟榔籽的真菌多样性进行解析评价,以期为后续食用槟榔的安全性及品质提升提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集 食用槟榔加工过程不同阶段样品采集自湖南某槟榔加工企业生产车间。食用槟榔加工过程主要包括发制(将槟榔加工配料溶解后加入槟榔中使槟榔入味的过程,在此过程中会加入苏打释放槟榔功效成分槟榔碱和槟榔次碱)、清洗、干燥、上胶(槟榔表面包裹明胶膜增加槟榔亮度的过程)、去芯、点卤及包装,跟踪同一批次槟榔分别在加工过程中各阶段完成后取样(表1),样品均无菌随机采集至透明PE袋中,每个样品设置3个重复,置于含有冰袋的采样箱中低温运回实验室,编号后置于-80℃保存备用。

表1 槟榔样品信息表Table 1 Sample information
1.1.2 主要试剂 E.Z.N.A.Soil DNA Kit,美国Omega生物试剂公司;Q5®High-Fidelity DNA Polymerase,美国NEB公司;AP-GX-50 DNA凝胶回收试剂盒,美国Axygen公司;Quant-iT PicoGreen dsDNA Assay Kit,美国Invitrogen公司;真菌通用引物ITS1-1737F(5′-G G A A G T A A A A G T C G T A A C A A GG-3′和ITS2-2043R(5′-G C T G C G T T C T T C A T C G A T GC-3′),其中在前引物中加入7 个核苷酸标签(barcode),武汉菲沙基因有限公司。
1.2 主要仪器与设备
Nanodrop 2000型超微量紫外分光光度计,美国Thermo Scientific公司;2720型PCR扩增仪,美国ABI公司;DYY-6C型电泳仪,北京六一仪器厂;BG-gdsAUTO(130)型凝胶成像系统,北京百晶生物技术有限公司;MiSeq PE250高通量测序平台,美国Illumina公司。
1.3 试验方法
1.3.1 DNA提取 参照E.Z.N.A.Soil DNA Kit 试剂盒说明书提取样品中微生物总DNA,用超微量紫外分光光度计和1%琼脂糖凝胶电泳检测所提的DNA质量。
1.3.2 PCR扩增 利用引物ITS1-1737F和ITS2-2043R对真菌rRNA基因ITS1区进行PCR扩增。PCR扩增体系25 μL:5×reaction buffer 5 μL,5×GC buffer 5 μL,dNTP(2.5 mmol·L-1)2 μL,引物ITS1-17137F(10 μmol·L-1)1 μL,引物ITS2-2043R(10 μmol·L-1)1 μL,DNA Template 2 μL,ddH2O 8.75 μL,Q5 DNA Polymerase 0.25 μL。PCR扩增程序:98℃预变性2 min;98℃变性15 s,55℃退火30 s,72℃延伸30 s,27个循环;72℃延伸5 min,10℃保存。
1.3.3 PCR产物回收纯化及高通量测序 PCR产物通过2%琼脂糖凝胶电泳后对目标片段进行切胶回收,按照凝胶回收试剂盒说明书纯化PCR产物。纯化产物由武汉菲沙基因有限公司使用Miseq高通量测序平台进行双端测序分析。
1.3.4 原始数据处理 对双端序列作质量筛查去除低质量 Reads后进行拼接,从而获得样本有效序列[19],剔除疑问序列及嵌合体序列[20],最后获得优质序列。
1.3.5 生物信息分析 以97%相似度划分操作分类单元(operational taxonomic unit, OTU),采用真菌ITS数据库UNITE[21]比对分析获取每个OTU所对应的分类学信息,进行Alpha多样性分析、Beta多样性分析及分类学组成分析。
1.4 数据分析
采用 SPSS 21.0软件进行统计分析,两组间数据比较采用独立样本 T 检验,P<0.05 表示显著差异;采用R软件制图。
2 结果与分析
2.1 食用槟榔加工过程中真菌测序序列数据统计和OTU分类
对各样本测序序列进行分析整合,经剔除疑问序列等质控后,食用槟榔加工过程中的24个样品共得到优质序列1 079 104条,序列长度主要分布于200~250 bp,按照97%相似度聚类分析共分类出820个OTU。由表2可知,加工过程中槟榔籽中去芯籽和成品籽OTU数最多,未入苏发籽和洗籽OTU数最少。
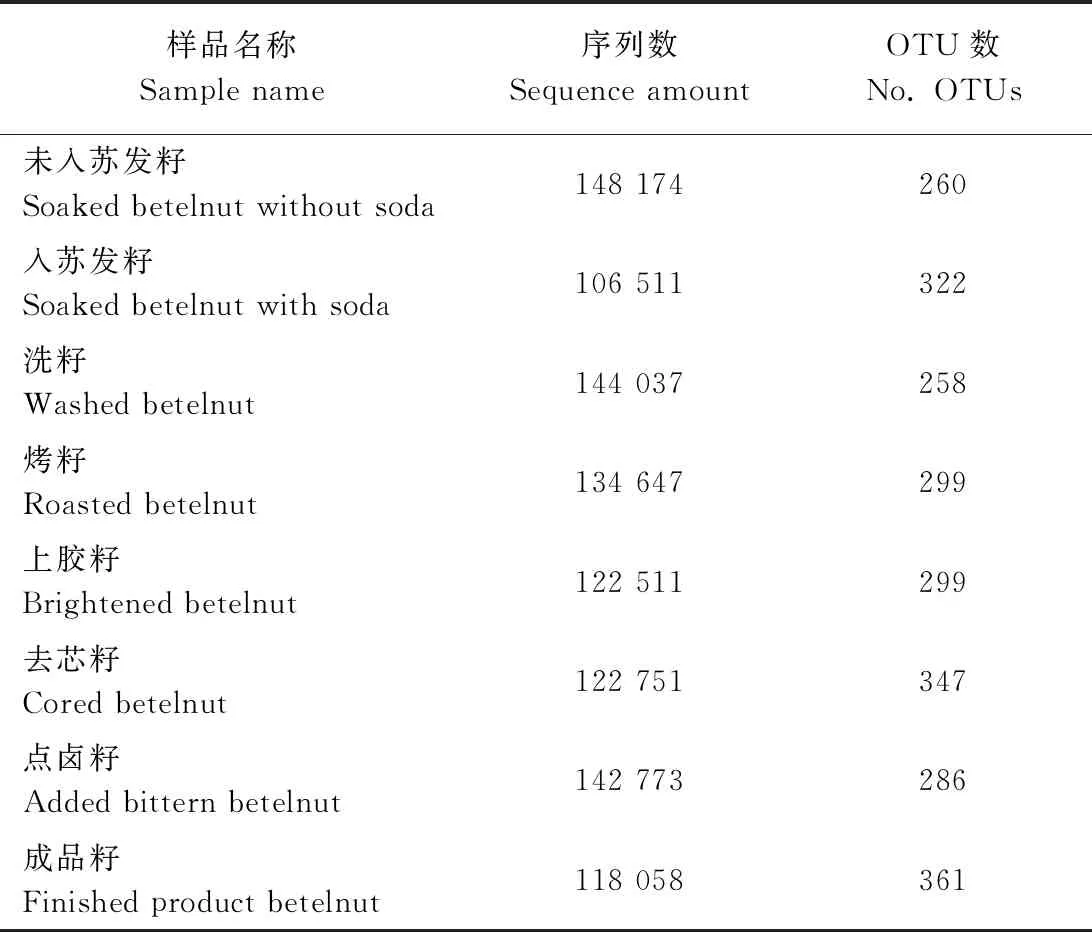
表2 食用槟榔加工过程中真菌测序序列数及OTU数Table 2 Fungi read counts and number of OTUs in processing of edible betelnut
2.2 食用槟榔加工过程中真菌群落Alpha多样性分析
稀释曲线反映不同测序深度下各样品中物种的相对丰度,能在一定程度上衡量每个样本的多样性情况[22-23]。由图1可知,本试验所有样本曲线均随横坐标测序数量的增大趋于平坦,说明测序数据量足够,能够充分反映样品的微生物信息且满足后续生物信息学分析。
样本在90%的最低测序深度水平进行拉平处理后计算Alpha多样性指数,其中Chao1指数和ACE指数为群落丰富度指数,Shannon指数和Simpson指数为群落多样性指数,4个指数计算结果如表3所示。在物种丰度上,各组间ACE指数差异不显著,说明槟榔加工过程中不同阶段的真菌丰富度差异不大;在物种多样性上,成品籽真菌群落Shannon指数和Simpson指数均最大,且显著高于其他加工阶段槟榔籽的真菌群落多样性指数,说明成品籽真菌多样性最高。
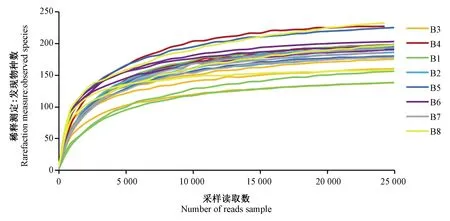
图1 食用槟榔加工过程中真菌发现物种数的稀释曲线Fig.1 Rarefaction curve of observed species in fungi community during processing of edible betelnut
2.3 食用槟榔加工过程中真菌群落Beta多样性分析
主成分分析(principal component analysis,PCA)可以从原始数据中提取出样本之间最重要的差异。由图2可知,第1主成分的贡献率为 72.40%,第2主成分的贡献率为 22.03%,其综合差异能够解释全面结果的94%,可以用来解释组间差异。洗籽、烤籽、未入苏发籽和点卤籽的3个样本不论在组内还是组间都较为聚集,说明洗籽、烤籽、未入苏发籽和点卤籽真菌组成结构较为相似,而入苏发籽、上胶籽、去芯籽和成品籽的组内样本均有一定分散,且与洗籽、烤籽、未入苏发籽和点卤籽组间距离较远,说明入苏发籽、上胶籽、去芯籽和成品籽真菌组成结构与洗籽、烤籽、未入苏发籽和点卤籽真菌组成结构存在一定差异。
基于非加权组平均法(unweighted pair-group method with arithmetic means, UPGMA)的聚类树分析可以观察不同样品间的进化距离来呈现不同样品间真菌群落的相似性及差异性。由图3可知,成品籽3个重复样本单独聚为一类,说明成品籽真菌群落组成与其他加工阶段的槟榔样品真菌群落组成存在较大差异。未入苏发籽与烤籽、洗籽与点卤籽、入苏发籽与上胶籽真菌群落组成在聚类关系上趋同性较强,表明其真菌群落组成的亲缘关系较近。

表3 食用槟榔加工过程中真菌群落 Alpha 多样性指数Table 3 Alpha diversity index of fungi community during processing of edible betelnut

图2 食用槟榔加工过程中真菌群落PCA分析Fig.2 Principal coordinate analysis of fungi community during processing of edible betelnut

图3 食用槟榔加工过程中真菌群落UPGMA聚类分析Fig.3 UPGMA cluster analysis of fungi community during processing of edible betelnut
2.4 基于各分类学地位的食用槟榔加工过程中真菌组成分析
在多样性分析的基础上,进一步对序列进行同源性比对,由表4可知,24个样品共鉴定出9个门,31个纲,84个目,164个科,226个属共317种真菌,此外还有一些无法鉴定的真菌。未入苏发籽真菌归类为6个门,19个纲,37个目,56个科,65个属共79种;入苏发籽真菌归类为7个门,24个纲,52个目,76个科,89个属共123种;洗籽真菌归类为6个门,20个纲,35个目,54个科,66个属共81种;烤籽真菌归类为7个门,22个纲,49个目,76个科,90个属共114种;上胶籽真菌归类为6个门,18个纲,42个目,63个科,73个属共97种;去芯籽真菌归类为7个门,20个纲,47个目,78个科,89个属共117种;点卤籽真菌归类为7个门,19个纲,43个目,67个科,75个属共97种;成品籽真菌归类为8个门,22个纲,51个目,81个科,95个属共141种。
在门水平上,槟榔加工过程中不同阶段槟榔籽的真菌隶属于9个门,其中绝对优势菌门为Ascomycota(子囊菌门),其平均相对丰度达93.76%,其次除洗籽外其他加工阶段槟榔籽的真菌优势菌门还有Basidiomycota(担子菌门),平均相对丰度为2.9%。在属水平上,不同组别真菌群落组成相对丰度如图4所示,样品真菌隶属于226个属,其中优势菌属包括Ascomycota(子囊菌门)的Aspergillus(曲霉属)、Cladosporium(枝孢属)、Candida(假丝酵母属)、Lecanicillium(蜡蚧属)、Simplicillium(拟青霉属)、Penicillium(青霉属)、Tuber(块菌属)、Cyberlindnera、unidentified Saccharomycetales_fam_Incertae_sedis(未鉴定出的发菌)和unidentified Saccharomycetales(未鉴定出的酵母),以及Basidiomycota(担子菌门)的Rhodotorula(红酵母属)、Cutaneotrichosporon和unidentified Malasseziales(未鉴定出的马拉色菌)。Ascomycota(子囊菌门)的Aspergillus(曲霉属)为所有样品中的优势属,平均相对丰度为80.98%。未入苏发籽真菌属65个,优势菌属为Aspergillus(曲霉属)、Rhodotorula(红酵母属)、Lecanicillium(蜡蚧属)和Tuber(块菌属),相对丰度分别为82.99%、3.01%、1.20%和1.19%;入苏发籽真菌属89个,优势菌属为Aspergillus(曲霉属)和Cladosporium(枝孢属),相对丰度分别为74.87%和19.64%;洗籽真菌属66个和烤籽真菌属90个,优势菌属均为Aspergillus(曲霉属),相对丰度分别为97.67%和91.88%;上胶籽真菌属73个,优势菌属为Aspergillus(曲霉属)、Cladosporium(枝孢属)和Candida(假丝酵母属),相对丰度分别为73.19%、15.05%和1.83%;去芯籽真菌属89个,优势菌属为Aspergillus(曲霉属)、Candida(假丝酵母属)、Lecanicillium(蜡蚧属)、Simplicillium(拟青霉属)和Cutaneotrichosporon,相对丰度分别为68.62%、1.07%、2.50%、2.45%和1.74%;点卤籽真菌属75个,优势菌属为Aspergillus(曲霉属)、Candida(假丝酵母属)和Rhodotorula(红酵母属),相对丰度分别为91.93%、1.78%和1.06%;成品籽真菌属95个,优势菌属为Aspergillus(曲霉属)、Cladosporium(枝孢属)、Candida(假丝酵母属)、Penicillium(青霉属)、unidentified Saccharomycetales_fam_Incertae_sedis(未鉴定出的发菌)、unidentified Saccharomycetales(未鉴定出的酵母)、unidentified Malasseziales(未鉴定出的马拉色菌)和Cyberlindnera,相对丰度分别为66.70%、2.52%、3.24%、1.93%、2.02%、1.15%、1.40%和1.37%。

表4 食用槟榔加工过程中真菌组成各分类地位数量Table 4 The number of identifiable units at different taxonomical levels

图4 食用槟榔加工过程中真菌属水平上的相对丰度Fig.4 The relative abundance of different samples at genus level

图5 LEfSe分析Fig.5 LEfSe analysis
通过LEfSe分析(图5)发现,槟榔加工8个过程中有显著差异的真菌类群为27个(P<0.05)。未入苏发籽真菌群落差异关键菌群有4个,均隶属于Basidiomycota(担子菌门)的Microbotryomycetes(微球黑粉菌纲);入苏发籽真菌群落差异关键菌群有4个,均隶属于Ascomycota(子囊菌门)的Dothideomycetes(座囊菌纲);洗籽真菌群落差异关键菌群有6个,均隶属于Ascomycota(子囊菌门)的Eurotiomycetes(散囊菌纲);去芯籽真菌群落差异关键菌群有7个,包括隶属于Ascomycota(子囊菌门)的Sordariomycetes(子囊菌纲)和隶属于Basidiomycota(担子菌门)的Agaricomycetes(伞菌纲);成品籽菌群落差异关键菌群有6个,包括隶属于Ascomycota(子囊菌门)的Sordariomycetes(子囊菌纲)、Eurotiomycetes(散囊菌纲)和Saccharomycetes(酵母菌纲);烤籽、上胶籽和点卤籽真菌群落则未发现差异关键菌群。
3 讨论
随着人们生活水平不断提高,食品安全问题逐渐成为人们关注的重点。食用槟榔作为广泛流行的休闲食品,其易霉变的质量安全问题亟需解决。因此为了设计有效的防控方案并提供一定的理论支持,本研究比较了食用槟榔不同加工过程中的真菌群落组成。PCA分析及UPGMA聚类分析表明,未入苏发籽、洗籽、烤籽和点卤籽较为聚集,真菌组成分析可知其真菌组成以槟榔内生真菌为主,说明槟榔发制过程的前期阶段,加工过程中微生物污染情况不严重,而在清洗阶段和烤籽阶段能一定程度减少微生物数量,卤水中的防腐剂也能在一定程度上抑制微生物生长,但对槟榔内生真菌影响均不大。加入苏打释放槟榔功效成分槟榔碱和槟榔次碱的发制后期由于发制周期过长容易引起微生物增殖和污染,从而增加真菌多样性,上胶、去芯和包装阶段因为工艺复杂冗长,还有大量人工操作的生产形式从而增加了微生物污染的概率,此外切籽去芯阶段槟榔内生真菌释放且随着加工进程繁殖增加,因此入苏发籽、上胶籽和去芯籽的真菌组成结构差异较大,最终成品籽的真菌组成结构最丰富、多样性最高。
Aspergillus(曲霉属)作为槟榔果内生真菌[24],在槟榔鲜果干制成原籽后依然存在[25-26],且随着贮藏时间的延长急剧增加[27],在槟榔发制籽和成品籽中也曾培养分离到Aspergillus(曲霉属)[28-29]。本研究也表明,槟榔整个加工过程中的绝对优势污染真菌是Aspergillus(曲霉属),说明在整个槟榔加工过程中槟榔内生真菌Aspergillus(曲霉属)的存活率始终较高,极易造成槟榔籽的霉变,且由Aspergillus(曲霉属)真菌产生的黄曲霉毒素作为致癌剧毒物质[30],也极大地影响着食用槟榔的安全性。
因此,为解决食用槟榔质量安全最主要的真菌污染问题,一是需要从工艺及机械化方面考量,减少生产过程中微生物污染问题;二是需要加大微生物防控技术研究,解决微生物尤其是槟榔内生真菌的污染问题。
4 结论
本研究采用Illumina Miseq高通量测序技术对食用槟榔加工过程中槟榔籽真菌结构和多样性进行分析,Alpha 多样性分析表明,槟榔不同加工过程中真菌丰富度差异不大,但多样性存在一定差异,其中成品籽多样性最高;Beta多样性分析表明,未入苏发籽、洗籽、烤籽和点卤籽真菌组成结构较为相似,入苏发籽、上胶籽和去芯籽真菌组成结构差异较大,成品籽的真菌组成结构与其他加工阶段槟榔籽差异最大;经分类学分析,用槟榔加工过程中槟榔籽共发现9个门,31个纲,84个目,164个科,226个属,520个OTU,其中槟榔内生菌Aspergillus(曲霉属)为整个加工过程中的绝对优势真菌。本研究全面揭示了食用槟榔加工过程中真菌群落结构及其动态变化,可为后续食用槟榔加工防霉技术的研发提供一定的理论支持。
