运动对抑郁症的干预作用及机制研究进展
2020-12-04刘金美付翠元贾绍辉
马 坤,刘金美,付翠元,张 虎,贾绍辉
抑郁症(depression)属于一种典型的抑郁障碍疾病,以显著而持久的心境低落为主要临床特征,是心境障碍的主要类型。临床可见心境低落与其处境不相称,情绪的消沉可从闷闷不乐到悲痛欲绝、自卑抑郁,甚至悲观厌世,有自杀企图或行为,严重者出现幻觉、妄想等精神病性症状。
2017年世界卫生组织(WHO)的统计结果显示,全球抑郁症总患病人数约为3.22亿,占比估计为4.4%,其中,女性患者多于男性(分别为5.1%和3.6%)。值得注意的是,在这些患者中,近一半生活在东南亚和西太平洋地区,包括印度和中国。抑郁障碍的伤残调整生命年(disability adjusted life year,DALY),即从发病到死亡损失的全部健康生命年,已经上升至第11位,成为导致伤残损失健康生命年(years lived with disability,YLD)即疾病导致损失的健康生命年的第三大病因。预计到2020年,抑郁症会成为仅次于心血管疾病的全球第二大疾病负担源(WHO,2017)。2019年,中国精神卫生调查研究显示,我国抑郁障碍的终身患病率为6.8%,12个月患病率为3.6%;其中,抑郁症的终身患病率为3.4%,12个月患病率为2.1%(Huang et al.,2019)。
目前,抑郁症主要依赖于药物治疗、心理干预以及物理治疗,但大部分轻、中度抑郁症患者常因病耻感拒绝任何治疗方式,也常因药物副作用、花费高等中途放弃治疗(陈福新等,2004;李睿楠等,2019)。相比其他精神疾病患者,抑郁症患者服药依从性较差,50%~60%的患者在10~16周停药,仅22%的患者进行规律的药物治疗。由于依从性较低,患者拒绝治疗后可能抑郁情绪加重,疾病反复发作,甚至出现自杀、自伤等行为(贾福军等,2013)。因此,虽然传统治疗方法在一定程度上降低了抑郁症的风险,但治疗效果不太理想,也给国家和社会带来沉重的经济负担。近年来,运动疗法由于具有依从性高、操作性强、副作用少的优势,已经作为一种经济、绿色环保的抑郁症干预手段获得广大科研工作者以及医疗界的一致认可,得到多个治疗指南的推荐。本文主要对抑郁症运动干预方案以及机制进行综述。
1 运动干预抑郁症效果评价
1.1 不同类型运动对抑郁症的干预效果
运动疗法对抑郁症的干预效果已经得到国内外的广泛认可,有氧运动和抗阻运动的干预效果已有相关报道。
1.1.1 有氧运动
Dilorenzo等(1999)发现,有氧运动能够有效降低抑郁症患者的抑郁评分量表平均分,干预后12个月,仍能维持较好效果。Oertel-Knochel等(2014)对抑郁症患者进行每周3次、每次45 min、为期4周有氧运动和精神放松训练相结合的认知训练干预后,干预前后焦虑程度有所降低,主观生活质量有所提高。抑郁症患者进行为期8周中等强度有氧运动干预后,能显著改善认知控制、抑郁症状和反刍思维模式(Olson et al.,2017)。大学生抑郁症患者接受健身气功八段锦干预治疗后,抑郁评分显著性降低,身体机能得到显著改善(谭志刚等,2020)。对产后抑郁症患者有氧运动干预效果进行Meta分析,发现团体有氧运动、个体有氧运动以及联合运动均能有效降低产后抑郁症(Makizako et al.,2019)。
瑜伽是一种深受广大女性喜爱的有氧运动,源于古代东方的心身练习。Meta分析系统评价报告表明,瑜伽运动有望减少抑郁症状(Cramer et al.,2017)。研究表明,治疗重度抑郁障碍(major depressive disorder,MDD)方面,瑜伽锻炼与抗抑郁药物同样有效,与抑郁症状严重程度的降低和治疗缓解率的提高有关(Bridges et al.,2017;Cramer et al.,2017)。为考察瑜伽对青少年焦虑和抑郁综合征的干预效果,James-Palmer等(2020)回顾了27项涉及不同健康状况青年的研究,发现总体上70%的研究显示了明显的改善效果;评估焦虑和抑郁的研究中,58%的研究显示两种症状有所减轻,25%的研究只显示焦虑有所减轻。此外,70%单独评估焦虑的研究显示运动对焦虑具有改善作用,40%仅评估抑郁的研究显示其对抑郁症具有积极的干预效果。Kwok等(2019)证实,在轻度至中度帕金森病患者中,正念瑜伽项目在改善运动功能障碍和行动能力、减少焦虑和抑郁症状、提高精神健康和生活质量方面,干预效果优于伸展和抗阻训练项目。也有学者认为,许多关于瑜伽运动干预抑郁症的研究在方法上存在重大限制,包括研究设计、数据报告和干预措施描述等。这些研究缺陷是瑜伽练习作为抑郁症公认治疗方法和纳入临床护理的重大障碍(Maya et al.,2019)。除瑜伽以外,多种有氧运动项目,如太极、八段锦以及团体有氧操等,被证实能显著性改善抑郁症患者的抑郁表现。
1.1.2 抗阻运动
Gordon等(2018)对抗阻训练效率与抑郁症相关性进行Meta分析,发现抗阻运动训练显著降低了成人的抑郁症状,抗阻训练的处方总量、参与者健康状况和力量改善与抗抑郁效果没有显著相关性。对缺血性脑卒中幸存抑郁患者进行12周抗阻训练后,发现与对照组相比,抗阻训练显著性降低了患者抑郁评分,并且各项身体功能均得到有效改善。另外,1 RM试验测试所得力量增加与抑郁水平呈负相关,尤其是下肢运动。研究表明,力量提高与抑郁水平呈负相关。因此,人为力量训练有益于降低抑郁程度(Aidar et al.,2014)。Kekalainen等(2018)发现,9个月的抗阻训练有利于提高老年抑郁患者生活质量,降低抑郁水平,每周2次抗阻训练对老年抑郁患者心理调节作用更显著。对肾透析患者进行有规律的体育锻炼后,有助于降低他们的焦虑和抑郁水平。研究证实,抗阻训练和耐力训练都能改善情绪,但只有耐力训练能额外降低焦虑(Dziubek et al.,2016)。Moraes等(2020)对临床确诊且正在接受常规治疗的老年抑郁患者进行运动干预后,利用汉密尔顿抑郁量表和贝克抑郁量表对干预效果进行评估,表明抗阻运动显著性降低受试者抑郁水平。进行24周力量训练后,与对照组相比,老年女性抑郁症患者神经递质5-羟色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)、肾上腺素(adrenaline)和去甲肾上腺素(noradrenaline,NA or NE)显著降低,抑郁因子并未显著性改变。值得注意的是,有的受试者在运动干预后,神经递质甚至低于干预前的正常范围,因此Kim等(2019b)认为,力量训练对抑郁症患者神经递质和抑郁评分的影响仍不确定。
Kang等(2020)发现,8周的有氧运动和抗阻运动均能有效改善慢性轻度不可预见性的应激(chronic unpredictable mild stress,CUMS)诱导的抑郁行为、神经元损伤和突触可塑性降低,但机制却截然不同:有氧运动是通过PGC-1α/ERRα/FDNC5干预抑郁症,抗阻运动是通过活化IGF-1/IGF-1R/Akt/mTOR来干预。
综上所述,抑郁症运动疗法中,有氧运动可能是更有效的干预方式(表1)。抗阻运动虽然在某些研究也显示了对抑郁症患者的积极预防和治疗作用,但仍存在一定的争论,有待进一步研究确认。
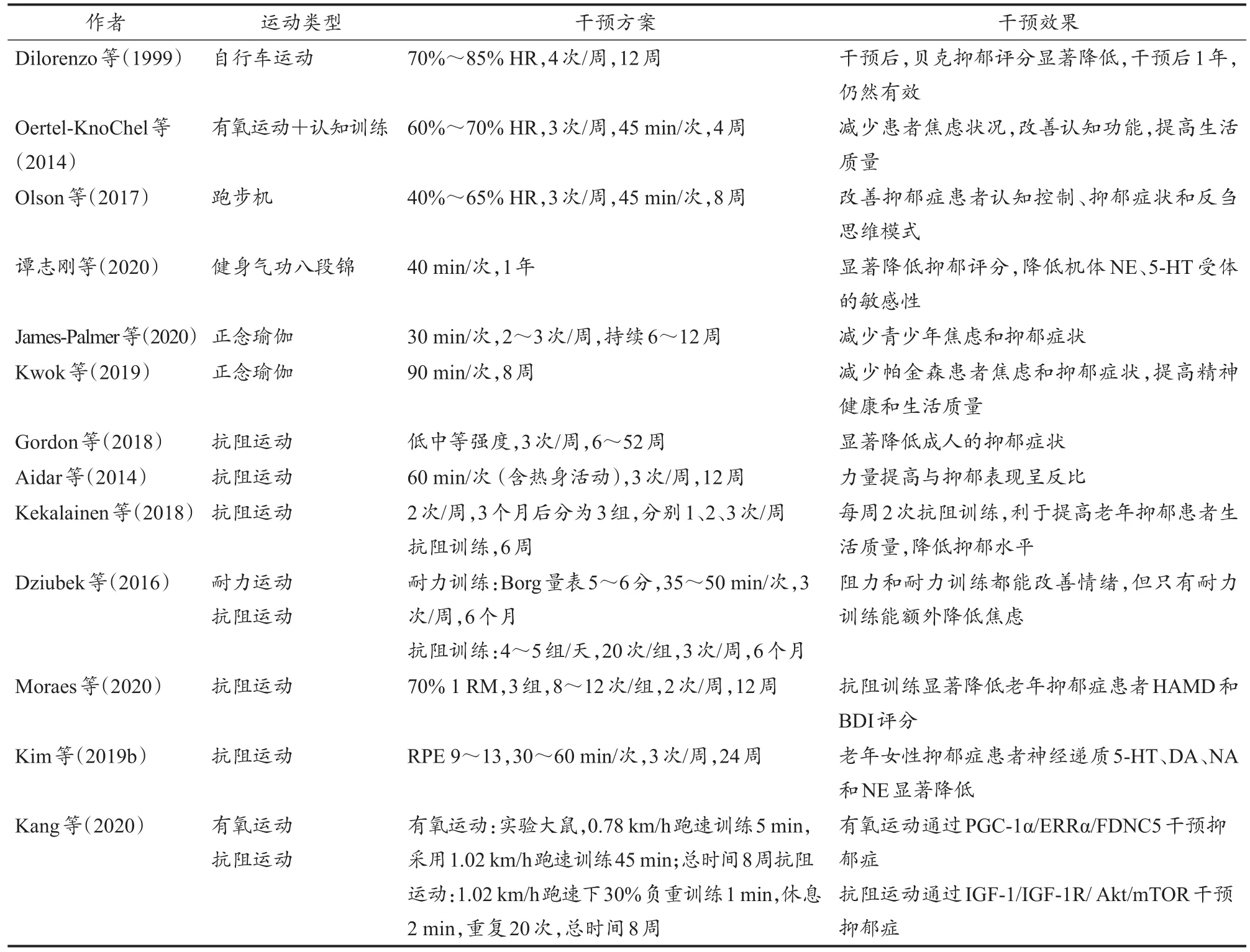
表1 不同类型运动的抑郁症干预效果汇总Table 1 Summary of the Effect of Exercise Type on Depression
1.2 强度、频率以及运动量对抑郁症运动干预效果的影响
1.2.1 运动强度对抑郁症干预的影响
杜芳等(2013)对住院抑郁症患者分别进行低强度和高强度运动干预,发现高强度有氧训练对抑郁症患者具有较为显著的干预效果,低强度有氧运动对抑郁症患者的干预效果并不明显。从运动频率来看,维持每周5次高强度有氧运动干预后,第4周即可显著降低抑郁评分,维持每周3次高强度有氧运动干预后,需第6周方可见明显的改善效果。对61名大学生抑郁症患者分别实施6周高强度间歇训练和中等强度连续训练后,Paolucci等(2018)对比了6周中等强度连续训练和高强度间歇训练对抑郁症患者炎症反应的影响,发现中等强度连续训练能够有效降低受试者的抑郁程度和肿瘤坏死因子(tumor necrosis factor-α,TNF-α)水平,高强度间歇训练虽能降低抑郁症状,但增加了患者的感知压力以及炎症因子水平,如TNF-α和白介素-6(interleukin-6,IL-6),因此,运动强度对抑郁症运动干预至关重要。Balchin等(2016)将中度抑郁男性患者随机分为3组,分别实施6周不同强度的运动干预,发现中等强度和高强度运动均可显著性改善抑郁水平,极低强度运动虽能降低抑郁症状,但效果并不明显。Gultyaeva等(2019)对10年来不同运动类型、运动强度和治疗抑郁症方式的临床研究结果进行综述,发现相关研究存在相互矛盾的情况,不可能对运动参数做出最终结论。抑郁症治疗中,中等强度和高强度的有氧运动加上力量锻炼与各种协调锻炼,往往比低强度的单一运动产生更积极的效果,可能患者定期坚持规定的运动方案比特定的运动类型更重要。
1.2.2 运动频率对抑郁症干预的影响
一项针对澳大利亚妊娠围产期妇女运动频率与抑郁症相关性的研究发现,围产期女性运动频率急剧下降,抑郁和焦虑症状快速增加,二者存在显著相关性(Watson et al.,2018)。对老年抑郁症患者进行为期3个月的抗阻训练后,将其随机分为4组:训练组RT 1、RT 2和RT 3以及非训练对照组,对训练组实施6个月抗阻训练,运动频率分别为每周1、2和3次,训练结束后评估其生活质量和抑郁症状,显示在3~9个月,RT 1组受试者的生活质量较RT 2和RT 3组下降,RT 2组受试者的生活质量高于其他两组(Kekalainen et al.,2018)。一项小样本量随机对照试验(n=23)显示,与每周只锻炼一次的患者相比,每周锻炼3~5次、每次30 min、最大心率为60%~80%的患者,贝克抑郁量表得分下降幅度更大(Legrand et al.,2007)。有学者发现,每周至少进行2次锻炼,有助于预防老年抑郁症(Cramer et al.,2017)。对1 142名参与者进行为期2年的跟踪调查发现,与不运动的人相比,2年后每周至少运动2次的人患抑郁症的风险显著降低(Kanamori et al.,2018)。综合分析导致抑郁症降低的变量因素包括定期运动、豆类食物摄取、奶类食物摄取、蔬果摄取、肉类摄取,发现只有运动与抑郁症降低呈现显著性的正相关,每周3~4次运动对抑郁症的干预效果优于每周1~2次和每周5次以上(Wang et al.,2018)。
总的来看,关于单因素运动频率对抑郁症影响的研究尚显不足,但结果比较一致,均认为高频次运动更有利于预防和改善抑郁症。
1.2.3 运动量对抑郁症干预的影响
为考察体力活动对抑郁症的干预是否存在剂量依赖关系,研究者对多个数据库的相关研究进行搜索与分析,发现大量的职业或者休闲时间的体育活动通常与抑郁症状的减轻有关。虽然结果表明,还缺乏足够的研究证实体力活动与抑郁症干预效果存在剂量依赖特性,但作者依然认为这种量效关系是合理的(Dunn et al.,2001)。两项随机对照试验表明,高能量(每周至少消耗17.5 kcal/kg)有氧运动或阻力训练比低能量(每周消耗7 kcal/kg或更少)运动更能减少受试者的抑郁症状(Dunn et al.,2005;Legrand et al.,2007)。有学者发现,当运动量维持在1 200~3 000 METs-min/周水平时,可以显著性降低抑郁症发生风险;运动量达到1 200~1 800 METs-min/周的个体中,发生抑郁症状的风险降低10%;运动量达到1 800~3 000 METs-min/周的个体中,发生抑郁症状的风险降低14%;当运动量大于3 000 METs-min/周时,并无明显的抑郁症降低效应(Kim et al.,2019a)。为考察运动量对抑郁症干预效果的影响,研究者以社区老年抑郁症患者为研究对象,设定了4种不同剂量的有氧运动,每种运动至少保证中等运动强度:1)3次/周,15 min/次;2)3次/周,30 min/次;3)6次/周,15 min/次;4)6次/周,30 min/次。结果发现,即使最小运动量(也就是每周3次,每次15 min)的有氧运动都能显著性降低受试对象的抑郁表现,且与其他运动量干预效果相当(Chang et al.,2017)。研究发现,如果所有参与者每周至少进行1 h的体育锻炼,未来抑郁症发生率可以降低12%(Harvey et al.,2018)。研究表明,每周进行150~299 min中等强度的体力活动与女性患抑郁症概率较低相关,每周进行300 min或更长时间剧烈体力活动,或2 250代谢当量的中等强度体力活动与男性抑郁风险较高相关,提示抑郁与体力活动的关系在很大程度上取决于运动强度和性别:适量体力活动有利于降低女性患抑郁症的风险,大运动量会增加男性发生抑郁症的风险(Wang et al.,2019)。与之相似,有学者发现性别和家族史也是影响抑郁症运动干预剂量选择的因素,无MDD家族史的男性和女性在大剂量运动时有较高的缓解率,有MDD家族史的女性在小剂量运动时有较高的缓解率(Rethorst et al.,2013b)。
运动量与抑郁症干预效果的关系还存在一定争论,从已有研究来看(表2),小剂量运动即可产生良好的抗抑郁效果,高剂量运动可能带来更大的益处。
1.3 抑郁症运动干预方案
根据上述研究结果,综合运动方案推荐指南(Pilling et al.,2009;Rethorst et al.,2013b;Stanton et al.,2014),本文总结出一些可能干预抑郁症的运动治疗方案。
1.3.1 有氧运动
研究结果支持有氧运动作为减少抑郁症状的首选运动方式。1)运动方式:户外或跑步机上行走/跑步、瑜伽、健身操、骑自行车或使用椭圆机。2)运动强度:采用50%~80%最大心率值。3)运动频率和持续时间:每周3~5次,每次45~60 min。4)运动监督:实施社会心理学对策,促进遵守锻炼计划。
1.3.2 抗阻运动
1)运动方式:建议采用包含上、下肢及躯体所有大肌群的运动项目,如坐姿推胸、划船、肩推、坐姿蹬腿、腿部屈伸练习等。2)运动强度:每种运动完成3组,每组重复8次,每次80%1 RM。3)运动频率和持续时间:每周3~5次,持续45~60 min。
患者4周内可能改善抑郁症状,但为了达到最大的抗抑郁效果,至少10~12周的持续运动是必要的。
另外,该方案根据已有研究证明抗阻运动能有效减轻抑郁症状,但鉴于抗阻运动干预效果还存在一定的争论,尚需更多实验性研究佐证。
2 运动作为联合治疗一部分对抑郁症的干预效果
王飞飞等(2018)对抑郁症模型大鼠分别实施电针治疗以及电针治疗联合运动干预。运动干预采取滚筒式网状训练,时间为21天,分别于干预后第7天和第21天取样检测,发现干预组模型鼠海马组织中的组脑源性神经营养因子(brain-derived neurothrophic factor,BDNF)mRNA和蛋白表达水平较模型组显著升高,胰岛素生长因子1(IGF-1 mRNA)和蛋白表达水平明显上升。而且,电针与运动联合干预后,实验大鼠海马组织中BDNF以及IGF-1的基因和蛋白表达水平比单纯电针干预组更高。与之相似,朱蓓英等(2019)采用重复经颅刺激、重复经颅刺激联合运动疗法对300多名抑郁症患者进行为期4周的干预,显示两种治疗方案均能显著性降低抑郁症状,联合治疗组患者的汉密顿抑郁量表评分明显低于单纯重复经颅刺激治疗组患者。Kim等(2019b)将老年抑郁症患者分为对照组、常规康复治疗组以及康复治疗手段联合有氧运动组。其中,有氧运动强度为70%~85%最大心率,运动时间为45 min,包括10 min热身活动和5 min赛后恢复练习,运动频率为每周3次。经过16周干预,发现常规康复治疗手段与中等强度有氧运动训练相结合,能够显著性降低老年重度抑郁症患者的抑郁症状。据报道,对抑郁症患者进行选择性5-HT再摄取抑制剂(selective serotonin re-uptake inhibitor,SSRI)与有氧运动联合治疗后,患者的抑郁症状明显减少,但与单独接受SSRI或有氧运动治疗的患者没有显著差异。6个月的随访发现,花更多时间从事体育活动是汉密尔顿抑郁量表得分较低的显著预测因素(Blumenthal et al.,1999)。张宇等(2018)探讨了有氧游泳运动与黑枸黄酮联合对抑郁症模型小鼠的抗抑郁作用,发现每周6次、每次60 min、为期6周的游泳运动训练联合黑果枸杞黄酮,能明显缓解或治疗小鼠抑郁症导致的脑损伤,增强免疫,修复神经元。

表2 运动强度、运动频率对抑郁症干预影响汇总Table 2 Summary of the Effect of Exercise Intensity and Exercise Frequency on Depression
3 运动干预抑郁症的机制
随着大量相关研究的开展,抑郁症发病机制逐步被揭示,主要存在以下说法:1)细胞因子失衡主要体现为神经营养因子水平降低(Bus et al.,2016)以及炎症因子表达量增加(Zhuang et al.,2016)。2)单胺类神经递质产生与分泌减少主要包括NA、5-HT以及DA(姚媛等,2018)。3)神经系统损伤,主要是海马神经细胞的凋亡增加(Bremner et al.,2000),神经发生减少(Hill et al.,2015)。4)海马线粒体能量代谢障碍(刘少博等,2020)。研究表明,microRNA也参与了抑郁症的发生发展进程(Hu et al.,2017)。这些致病因素往往互相关联,协同影响患者抑郁表现。
近年来,运动预防与治疗抑郁症的作用已经获得充分认可,关于运动干预抑郁症机制的研究也成为研究热点。在此进行详细综述,以期为抑郁症的诊断、预防与治疗提供更多的理论依据。
3.1 运动调节细胞因子干预抑郁症
3.1.1 运动调节脂肪因子表达降低抑郁症状
脂肪因子是由脂肪细胞分泌的细胞因子,可架起脑组织、外周组织与中枢神经系统的沟通桥梁,在抑郁症发病进程中发挥着重要作用(图1)。
瘦素(leptin)是一种脂源性激素,从脂肪细胞分泌后进入血液循环,透过血脑屏障,进入脑内发挥作用,主要通过受体介导。中枢神经系统存在大量的瘦素及其受体,这是瘦素信号调节大脑生理功能的物质基础(Scott et al.,2009)。研究表明,运动调节瘦素介导的抗抑郁作用机制为,调节下丘脑-垂体-肾上腺轴(hypothalamicpituitary-adrenal axis,HPA)功能,促进海马神经发生和平衡线粒体代谢保护神经(薛香莉等,2016)。Liu等(2017)发现瘦素受体敲除小鼠表现抑郁样行为,与STAT3/SOCS3信号通路有关,对瘦素敲除小鼠进行游泳运动干预后,抗抑郁作用减弱。

图1 细胞因子参与运动调控抑郁症的机制Figure 1.The Mechanism of Cytokines Participating in Exercise on the Regulation of Depression
脂联素(adiponectin,ADN)是脂肪细胞分泌的另一种激素蛋白,对脑内葡萄糖和能量稳态有深远影响。ADN受体在大脑多个区域均有表达,如海马、大脑皮层、下丘脑室旁核等。研究发现,MDD患者血清中ADN浓度低于健康个体,而ADN水平与抑郁症的严重程度密切相关(Lehto et al.,2009)。Yau等(2014)研究指出,ADN缺乏没有降低海马基底神经发生和神经元分化,但降低了运动对海马神经发生的促进作用。运动诱发的抑郁样行为的减少在ADN缺陷小鼠中被消除,这种损伤还伴随海马组织中AMP激活蛋白激酶(AMP-activated protein kinase,AMPK)的磷酸化障碍。因此,脂联素可能通过激活ADNR1/AMPK信号通路,在介导运动对海马神经发生和抑郁的影响中发挥重要作用,提高运动对海马神经发生和抑郁的影响。对慢性疲劳综合征样疾病妇女实施八段锦气功运动训练后发现,与对照组相比,气功锻炼显著降低焦虑和抑郁症状,提高血浆脂联素水平,而且,气功锻炼后脂联素水平的升高与气功锻炼组抑郁评分的降低相关(Chan et al.,2017)。
3.1.2 运动调节神经生长因子表达降低抑郁症状
BDNF是一种神经营养因子,负责刺激和控制神经发生,通过降低皮质醇的长期基础水平改变下丘脑-垂体轴的功能,是控制抑郁行为的关键因子。诸多证据表明,BDNF是运动干预抑郁症的关键神经生长因子。42例抑郁症住院患者在常规治疗基础上进行6周运动干预后,取血清检测BDNF含量,发现运动组外周血中BDNF水平有所升高;在以年龄和体重指数为协变量的重复方差分析中,运动组的血清BDNF与运动量大小有显著相关性(Kerling et al.,2017)。与上述结果不同,Meyer等(2016)对24名女性重度抑郁症患者在固定自行车上分别实施30 min低、中、高强度运动干预,结果提示运动导致抑郁情绪的急性改善以及血清BDNF浓度显著的急性上升,但这些改变是非强度依赖性的;运动后10或30 min时,血清BDNF的急性变化与情绪抑郁的变化无显著相关性;14名服用抗抑郁药物的受试者运动后血清BDNF低于未服用抗抑郁药物的受试者,尽管他们的情绪反应相似。
魏宏文等(2011)表明,运动可以上调慢性应激大鼠海马BDNF及相关神经营养通路重要信号分子p-ERK的表达,抑制应激状态下海马结构和功能的进一步破坏,促进神经营养和神经可塑性。研究发现,运动还能增强氟西汀的神经营养作用。然而,Krogh等(2014)研究运动对抑郁症患者海马体积和神经营养素的影响时发现,有氧运动能够提高抑郁症模型鼠的最大摄氧量,但对海马体积及BDNF无显著性影响。
神经生长因子(nerve growth factor,NGF)是一类促进神经生长的多肽,主要是维持神经元的生长和存活,介导突触形态的可塑性。临床数据表明,抑郁症患者的血清NGF水平明显低于正常健康人群(Rao et al.,2017)。动物实验也证实,抑郁症动物海马组织中,NGF mRNA表达水平显著性降低(Hashikawa et al.,2015)。另外,海马组织中NGF基因多态性也与抑郁症康复和治疗效果密切相关(Yeh et al.,2015)。规则的跑台运动不仅增加了群居小鼠NGF的表达水平,提高海马神经元细胞存活率,还能通过上调突触素I(synapsin I,SYN I)的表达增加中缝核5-HT能细胞数量,改善抑郁症状(Hong et al.,2015)。长期跑台运动可以调节HPA轴的功能,减少皮质醇分泌,上调抑郁大鼠海马NGF表达,对抗氧化应激引起的中枢神经元凋亡(于芳 等,2015)。Okudan等(2017)揭示,长期自由转轮运动可以提高隔离诱导的海马NGF水平下降,改善认知功能,降低大鼠的焦虑分数。
除上述两种主要神经因子外,与抑郁症相关的神经因子还包括神经营养素(neurotrophin,NT)、睫状神经营养因子(ciliary neurotrophic factor,CNTF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)以及胰岛素样生长因子-1(insulin growth factor-1,IGF-1)等(Kolshus et al.,2017;Pasquin et al.,2015;Tseng et al.,2016;Van Varsseveld et al.,2015;Young,2009)。也有研究表明,神经组织中成纤维细胞生长因子家族在抑郁症的康复治疗中发挥重要调节作用(Turner et al.,2008)。运动干预对上述细胞因子均有明显调节作用,对降低抑郁表现有积极作用(刘文彬等,2018)。3.1.3 运动调节肌肉细胞因子表达降低抑郁症状
irisin作为骨骼分泌的肌动蛋白,经运动诱导表达,是骨骼肌虹膜前体蛋白FNDC5的一种裂解形式。它在海马组织中呈现高表达,对中枢和外周神经系统均有保护作用,发挥与BDNF类似的抗抑郁作用(Jin et al.,2018)。体育锻炼具有抗抑郁作用,可能与irisin释放和BDNF信号转导有关(Siteneski et al.,2018)。耐力运动不仅诱导骨骼肌中的irisin表达,还诱导海马中的irisin表达。研究体育锻炼小鼠肌动蛋白和脂肪因子的代谢中,发现运动训练显著提高了血浆中irisin和抵抗素的水平(Shirvani et al.,2019)。运动通过irisin诱导海马脑源性神经营养因子,使血清和海马BDNF水平升高(Young et al.,2019)。irisin可能以时间依赖的方式调节海马和前额叶皮层PGC-1α、FNDC5和BDNF的基因表达,进一步加强这些基因在情绪调节中的关键作用(Siteneski et al.,2018)。运动诱导激素irisin通过激活AKT和ERK1/2信号通路保护神经元免受损伤,参与体育锻炼对脑缺血的神经保护活动(Li et al.,2017)。
3.2 运动调节神经递质表达干预抑郁症
神经递质由突触前膜释放后,与相应突触后膜受体结合,产生突触去极化电位或者超极化电位,导致突触后神经兴奋性升高或者降低。最早发现的一类神经递质主要包括DA、NE、5-HT。目前认为抑郁症的主要病因是5-HT和NE等神经递质功能失调,抑郁症患者脑脊液5-HT和NE浓度明显低于正常人群。
李雪等(2008)发现,慢性中等不可预知性应急刺激可导致实验大鼠全脑、海马及前额皮质内单胺类神经递质NE、DA、5-HT及其代谢产物5-羟吲哚异酸的含量下降,中等强度游泳运动能够扭转这种降低,促进抑郁症的恢复。让65位成年抑郁症患者在跑步机上接受每周3~5次、每次35 min左右、为期6周的慢跑有氧运动,然后采用汉密尔顿抑郁量表评估抑郁症状、酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)测量人体血浆中γ-氨基丁酸(γ-aminobutyric acid,GABA)含量,发现有氧运动干预可以改善抑郁症状和认知功能,提高体内GABA含量(杜远等,2019)。Kim等(2019b)对老年女性抑郁患者进行24周力量训练后发现,力量训练组的5-HT、DA和NE显著降低,抑郁症状有效改善,对照组则未见明显改变。He等(2012)采用慢性轻度应激(chronic mild stress,CMS)诱导大鼠抑郁模型,进行10周游泳运动干预,ELISA检测结果表明,海马中的5-HT、DA和NE水平显著升高,提示运动可以逆转和防止5-HT、NE的减少,恢复CMS模型鼠中的DA水平。考察运动对睡眠剥夺小鼠抑郁行为干预效果时发现,运动可以预防睡眠剥夺导致的抑郁行为,减少纹状体高NE水平和5-HT的转换(Daniele et al.,2017)。然而,Lee等(2013)研究表明,抑郁症样行为不是5-HT的慢性降低,而是慢性应激引起的;有规律的运动,无论是中等强度还是高强度,都能防止抑郁样行为发生,提高成年海马细胞的增殖和存活率;运动后,小鼠海马NE表达增加,5-HT水平并没有恢复。不过,有规律的运动虽然不能增加患者的5-HT水平,但可防止5-HT减少状态下长期记忆和短期记忆的损害。
3.3 运动调节炎症通路干预抑郁症
研究指出,IL-1β、TNF-α、IL-6、IL-8和IL-10等细胞因子的长期升高与多种慢性病和MDD有关。多项研究表明,运动干预抑郁症的主要机制在于阻碍炎症产生。朱蓓英等(2019)采用重复经颅刺激联合运动疗法干预抑郁症患者,发现联合治疗比单纯重复经颅刺激疗法能够更有效干预抑郁症,治疗后患者血清的IL-1β、IL-6及TNF-α水平低于单纯重复经颅刺激治疗组,认为联合疗法可能是通过抑制炎症反应来降低抑郁表现。另一针对大学生的研究发现,中等强度运动在减少压力和抑郁症状的同时,还能降低血液中TNF-α的水平(Paolucci et al.,2018)。值得注意的是,一些促炎症细胞因子的水平在治疗难治性抑郁症(treatment-resistant depression,TRD)患者中似乎更高,循环基础TNF-α水平的升高与12周有氧运动方案的抗抑郁作用呈正相关。此外,TRD患者抑郁症状的减轻与慢性运动方案后IL-1β水平的降低呈正相关(Rethorst et al.,2013a)。
张宇等(2018)进行有氧游泳运动与黑枸黄酮联合对抑郁症模型小鼠的抗抑郁作用机制研究时发现,联合干预可以抑制Toll样受体4(toll like receptor 4,TLR4)的活性,下调髓样分化因子88(myeloid differentiation factor 88,MyD88)的表达,继而激活NF-κB上调相关抗炎基因的表达,达到降低抑郁水平的目的。与之相似,Qu等(2020)发现,有氧运动可显著增加慢性不可预测轻度压力抑郁小鼠海马miR-223的表达,抑制下游TLR4/MyD88/NF-κB信号通路和海马反应,改善海马功能,减轻抑郁症状。
Wang等(2016)研究,运动干预能够改善去势后小鼠抑郁样行为,降低海马IL-1β和IL-18水平,以及去势后小鼠的 NLRP3、Caspase-1p10和 CD11b表达水平;IL-1β和IL-18水平以及NLRP3炎症小体的激活是卵巢去势后引起海马炎症诱导抑郁症的关键,因此,运动改善抑郁样行为与抑制该模型海马NLRP3炎症通路有关。
3.4 运动调节线粒体功能干预抑郁症
线粒体是细胞内的能量发生器,线粒体功能异常会导致各种信号通路失调,阻碍细胞发挥正常功能。神经影像学资料证实,抑郁症患者大多存在大脑能量代谢紊乱现象,这可能是线粒体功能失调引起的(Jou et al.,2009)。国内外学者就抑郁症与线粒体关系开展大量研究工作,认为线粒体mtDNA数目增多(Cai et al.,2015;Sabunciyan et al.,2007)、线粒体DNA遗传控制异常(Rollins et al.,2009;Torrell et al.,2013)、线粒体功能障碍(Karabatsiakis et al.,2014)以及线粒体的氧化损伤是导致抑郁症的重要因素(Sarandol et al.,2007)。
系列研究成果表明,线粒体是运动干预抑郁症的重要靶点。Seo等(2019)研究显示,运动可通过上调BDNF表达改善海马线粒体功能和神经可塑性修复创伤后应激障碍患者的精神障碍与认知功能障碍。Aguiar等(2014)发现,自由转轮运动能够刺激脑神经细胞线粒体活性,增强神经可塑性,改善实验小鼠的抑郁或者焦虑行为。另外,运动可通过增强中缝背侧的线粒体功能和神经可塑性减弱母体分离引起的情绪障碍样行为,如焦虑和抑郁(Park et al.,2019)。
运动激活氧化应激系统保护海马神经细胞线粒体得到广泛认可。Gultyaeva等(2019)发现,运动可以增强机体抗氧化能力,保护神经细胞线粒体,对抗抑郁症。运动改善抑郁症,是因为它能降低过氧化物水平(如脂质过氧化和蛋白质氧化),提高内源性抗氧化通路效率,逆转应激引起的抑郁样行为,改善线粒体功能障碍,减少脑部组织损伤(Brocardo et al.,2012)。运动激活抗氧化系统,抑制线粒体大鼠中缝核线粒体过度活化,降低由慢性不可预知压力导致的抑郁症水平(Wen et al.,2014)。
有意思的是,Fattahi等(2018)发现,青春期运动可减轻成年雄性大鼠早期生活压力诱导的抑郁样行为和海马线粒体功能障碍。
3.5 运动调控海马神经细胞凋亡与神经发生干预抑郁症
海马是与情感相关的大脑边缘组织之一,与学习、记忆、情绪和内脏分泌活动关系密切。大量研究证实,海马神经细胞凋亡是抑郁症发生的重要诱导机制,成年海马神经元发生有益于缓解抑郁症越来越受到关注。
运动作为抑郁症的有效干预手段,一直以来都是广大科研工作者的研究重点,但目前为止,关于运动抑制神经元细胞凋亡的报道并不多见。对产后母鼠离体幼鼠进行跑台运动训练,表明运动可通过抑制海马神经元细胞死亡和促进细胞增殖,减轻母系分离引起的抑郁(Baek et al.,2012)。Roh等(2016)研究运动对脑出血诱导抑郁症的干预效果时,发现运动可以显著性降低脑出血抑郁模型鼠海马组织中Bax以及Caspase-3的表达水平,改善抑郁症状。屈红林等(2018)发现,有氧运动可显著上调抑郁小鼠海马BDNF的表达水平,抑制miR-195在小鼠海马细胞中的促凋亡作用,下调Bax、Caspase-3的表达,减少海马神经细胞的凋亡率,降低抑郁水平。Li等(2020)报道运动可抑制PTEN升高介导的TLR4/NF-κB/NLRP3信号上调,保护海马神经细胞,减少其死亡,改善小鼠脑卒中后抑郁。
3.6 运动调节microRNA干预抑郁症
MicroRNA(miRNA)是一类小的非编码RNA,主要通过控制靶基因的表达发挥功能。有证据表明,miRNAs参与了应激反应、神经可塑性和神经发生,在抑郁症发病机制中发挥重要作用。诸多证据表明,miRNAs可能参与了抑郁症的康复和治疗(Baudry et al.,2010;Camkurt et al.,2015;Launay et al.,2011;Oconnor et al.,2013)。
屈红林研究小组对运动调节miRNAs干预抑郁症展开一系列研究。有氧运动可显著性上调CUMS诱导的抑郁模型小鼠海马组织中BDNF的表达,抑制miR-195在小鼠海马中的抗凋亡作用,下调Bax、Caspase-3的表达,实施抗凋亡作用,推测有氧运动干预抑郁症的机制可能与BDNF/miR-195/Bcl-2/信号通路的激活有关(屈红林等,2018)。随后,该研究小组再次证实miRNA在运动干预抑郁症中的作用:8周有氧运动可显著降低CUMS,抑郁小鼠海马TLR4表达,进而上调激活miR-223表达,调控miR-223靶向识别IKKα的能力和TLR4/NF-κB信号通路,阻碍下游靶基因NLRP3的活性,降低IL-1β和IL-10等炎症细胞因子的表达水平,改善抑郁小鼠海马功能,促进损伤的海马组织修复。这表明,有氧运动改善抑郁小鼠海马组织功能,发挥抗炎作用,可能与TLR4/miR-223/NLRP3信号通路轴的激活有关(屈红林,2019)。该小组发现有氧运动可通过激活海马miR-223/TLR4/MyD88/NF-κB通路抑制CUMS诱导的小鼠海马炎症反应(Qu et al.,2020)。
Liu等(2020)发现,24式太极拳可改善冠心病患者经皮冠状动脉介入治疗后的焦虑、抑郁症状,上调miR-17-92水平,但miR-17-92在太极拳抗抑郁过程中发挥哪些作用及其机制还有待进一步研究。
体育锻炼刺激成年海马神经发生,被认为是预防人类年龄相关认知能力下降的有益策略。Ponsespinal等(2019)发现,运动通过下调miR-135a-5p,激活下游IP3信号通路活化,调节细胞周期进程,促进小鼠齿状回神经前体细胞(neural precursor cells,NPCs)增殖。MiR-135a抑制可刺激静息小鼠的NPC增殖,导致神经发生增加。另一研究发现,miR-135a在抑郁症患者血清中的浓度显著性低于健康人群(Gheysarzadeh et al.,2018)。因此,miR-135a是否在运动干预抑郁症中发挥作用尚不确定。
近年来,microRNAs在运动抗抑郁中的作用受到广大科研工作者的关注,作用机制主要是抑制海马神经凋亡、促进海马发生、控制炎症产物、减少海马损伤等(图2),但总的来说关于运动调控microRNAs相关研究成果仍然非常缺乏。
4 结论与展望
综上所述,从抑郁症运动干预类型来说,有氧运动的干预效果已经获得广泛认可,虽有多项研究证实抗阻运动是抑郁症的有效干预手段,但干预效果仍然存在很大争论。现有研究认为,中等强度有氧运动是抑郁症运动干预的最佳选择,运动频率则需维持每周3~5次。运动干预抑郁症的机制主要体现在以下方面(图3):1)调节细胞因子的表达,包括脂肪因子、神经营养因子和肌肉细胞因子irisin;2)改变神经递质NE、DA、5-HT释放;3)抑制炎症通路;4)改善线粒体功能;5)抑制海马神经元细胞凋亡,促进神经元再生;6)调控神经细胞microRNA表达。
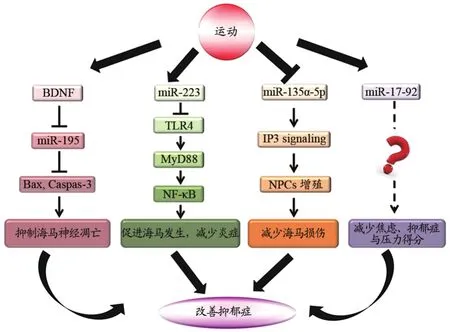
图2 microRNAs在抑郁症运动干预中的作用Figure 2.The Roles of MicroRNAs in the Exercise Intervention of Depression

图3 抑郁症运动干预研究展望Figure 3.The Prospects of Exercise Intervention in Depression
运动疗法将是未来抑郁症治疗中一种非常重要又有效的手段。当然,为在临床上广泛推荐运动疗法,仍有许多研究工作需要展开,如进一步验证抗阻运动的确切疗效;深入研究个体化运动方案与团体运动方案;深入探讨运动干预抑郁症的机制,特别是对神经元细胞凋亡与神经元发生的调控以及对microRNA表达的调节作用。另外,抑郁症的诊断主要依赖评分量表,存在很大的主观性。本综述中描述的细胞因子如irisin是一种可在海马中表达并分泌至外周循环的细胞因子,检测较为方便,具有开发为抑郁症检测诊断指标的潜力。随着microRNA在抑郁症中作用的逐步揭示,它有可能成为未来抑郁症精准预测或靶向干预效果评估,甚至无创伤性预测与疗效评估的基因检测指标。
