氢还原处理棒状纳米CeO2光催化特性研究
2020-12-03夏雪雯李军旗陈朝轶兰苑培毛锡嵩柏富生王咪艳
夏雪雯,李军旗*,陈朝轶,兰苑培,毛锡嵩,柏富生,王咪艳
(1.贵州大学 材料与冶金学院,贵州 贵阳 550025;2.贵州省冶金工程与过程节能重点实验室,贵州 贵阳 550025)
CeO2因其优异的氧化还原能力(Ce4+→ Ce3+)、化学稳定性和无毒性成为备受关注的光催化材料[1]。为进一步提升CeO2的光催化性能,研究人员主要采用的方法有掺杂金属/非金属离子[2]和复合其他半导体材料[3]等。
CeO2的形貌会影响其光催化性能[4]。CeO2晶体主要暴露(111)、(100)和(110)晶面,各晶面的催化活性不同,其中(111)<(100)<(110)[1-4]。棒状纳米CeO2因暴露(110)和(100)晶面而受到广泛关注[5]。此外,CeO2晶格中产生的Ce3+或形成的氧空位亦可提升其光催化性能[6]。可见,制备晶格中存在Ce3+或氧空位的棒状纳米CeO2有提升CeO2光催化性能的潜力。在CeO2晶格中引入Ce3+的途径主要包括高温退火[7]、X-射线照射[8]、Ar+轰击[9]和表面刻蚀[10]等。有报道[11-12]称采用中低温H2处理可使CeO2表面还原生成Ce3+,但目前鲜有H2还原对棒状纳米CeO2光催化性能影响的研究。
因此,本文采用水热法制备棒状纳米CeO2,通过热重曲线分析在不同气氛(空气/氢气)中棒状纳米CeO2的质量变化和Ce4+→Ce3+转化,并以此为依据在不同气氛下对棒状纳米CeO2进行焙烧处理。结合紫外-可见漫反射光谱和光催化降解亚甲基蓝溶液实验,研究空气及氢气气氛焙烧对棒状纳米CeO2能带结构及其光催化特性的影响。
1 实验
1.1 棒状纳米CeO2制备与焙烧处理
所用实验原料六水合硝酸铈(Ce(NO3)3·6H2O,99.95 %)和氢氧化钠(NaOH,99.9 %)均购置于阿拉丁公司(上海)。
水热法制备棒状纳米CeO2的方法[13]具体如下:将35 mL NaOH溶液(6 mol/L)缓慢滴入溶有0.868 g Ce(NO3)3·6H2O的5 mL水溶液后搅拌30 min;将形成的乳白色悬浊液转移至50 mL聚四氟乙烯内衬的不锈钢高压反应釜中,在100 ℃下反应24 h后取出并冷却至室温;对得到的淡紫色沉淀物用去离子水和无水乙醇交替洗涤、超声、过滤数次,后在60 ℃下干燥24 h,最终得到淡黄色CeO2粉末(R-CeO2)。
将铺于氧化铝瓷舟中的R-CeO2置于管式炉(合肥科晶gsl-1600x)内,以10 ℃/min升至一定温度,分别在空气和氢气气氛下焙烧2 h。其中,氢气(高纯氢,99.999 %)流量为400 mL/min,通入氢气前反复将炉管抽真空并以氩气排气。焙烧后待炉温降至150 ℃时,关闭氢气并通入氩气直至室温,得到R-CeO2-H2;将管式炉两端法兰打开与大气相通,空气气氛下焙烧得到R-CeO2-Air。
1.2 材料表征和光学性能分析
室温下,使用Rigaku D/Max-2200 V X射线衍射仪对样品进行物相分析,采用Cu靶Kα辐射(λ=0.154 06 nm),扫描角度范围为5~90°,扫描速度为0.02(°)/s,获得X射线衍射(X-ray diffraction,XRD)图谱。采用∑SIGA扫描电子显微镜(scanning electron microscope,SEM)拍摄SEM图像,采用Tennai G2 F20透射电子显微镜(transmission electron microscope,TEM)拍摄TEM图像和高分辨率透射电子显微镜(high resolution transmission electron microscope,HRTEM)图像,以观察微粒的形貌和尺寸。空气和氢气气氛下,采用Mettler TGA/SDTA 851e进行R-CeO2的热重分析测试,温度测试范围为室温至1 000 ℃,升温速率为10 ℃/min。采用紫外-可见分光光度计(PE lambda 750S)测试紫外-可见漫反射光谱,测试范围为200~800 nm,并以BaSO4作为参比。
以亚甲基蓝(methylene blue,MB)溶液的降解率评价催化剂的光催化性能;采用250 W氙灯(北京泊菲莱 PLS-SXE300)为测试光源,发射波谱范围为190~1 100 nm。催化性能测试步骤如下:将20 mg样品分散于80 mL MB溶液(10 mg/L)中;在光反应前,将其置于黑暗环境下搅拌30 min,使催化剂和MB溶液达到吸附-解吸平衡;随后,在氙灯光源下反应2 h,每30 min取5 mL悬浊液离心并收集上清液,用分光光度计(VIS-7220N)在664 nm下测定不同时刻其对应浓度。
2 结果与讨论
2.1 物相及形貌分析
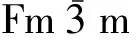
图2是R-CeO2的TEM和HRTEM图。由图2(a)可知,R-CeO2形貌均匀,与图1(b)中SEM结果一致。由图2(b)可知:R-CeO2的晶格间距为0.19 nm和0.28 nm,其分别对应CeO2晶面(110)和(100),与JIANG等[4]制备出的棒状纳米CeO2相似。
图1 R-CeO2的XRD和SEM图

图2 R-CeO2的TEM和HRTEM图
2.2 不同气氛热稳定性分析及焙烧温度确定
图3为空气和氢气气氛下R-CeO2的热重(thermogravimetry,TG)曲线,分别对各曲线进行微分处理,利用微分热重法提高TG的分辨率。图3(a)显示:在空气气氛下,随着温度的升高,R-CeO2的质量变化过程可分为3个阶段。第一阶段应为自由水的脱除,温度范围为室温至124 ℃,因R-CeO2样品疏松,含水量较高,其失重率约为5.65 %;温度>124~321 ℃为第二阶段,R-CeO2的失重率约为3.212 %,此过程应为少部分未反应的Ce(OH)4发生分解;温度>321 ℃为第三阶段,此时R-CeO2的质量变化较为稳定,并逐渐变成稳定的化学计量CeO2。

图3 空气、氢气气氛下R-CeO2的TG曲线
图3(b)显示:在氢气气氛下,随着温度的升高,R-CeO2的质量持续降低,其质量变化过程可分为4个阶段。第一阶段应为自由水的脱除,115 ℃时,R-CeO2的失重率约为4.075 %。第二阶段,温度>115~288 ℃时,H2吸附在R-CeO2表面,与Ce4+反应并羟基化;随着温度逐渐升高,H2开始还原R-CeO2,并伴随着结合水的脱除,其失重率为5.473 %[15]。温度>288 ~778 ℃为第三阶段,R-CeO2表面开始逐渐被氢气还原,其失重率约为7.991 %;BINET等[16]认为,在此阶段CeO2表面的Ce4+被还原成Ce3+。温度>778 ℃时为第四阶段,表面被还原的R-CeO2开始逐渐向Ce2O3转变,此过程R-CeO2的失重率为4.162 %;BRUCE等[17]认为当温度增加至800 ℃,CeO2倾向于形成另外一种铈的氧化物即Ce2O3,该结论与实验结果相似。
通过不同气氛下的TG分析发现,在>288~778 ℃条件下,氢气处理棒状CeO2会使其表面被还原,并出现较高浓度Ce3+。WANG等[18]在研究CeO2的H2-TPR中发现,CeO2在280 ℃时开始被还原,其表面氧和晶格氧的最大还原峰温度分别在510 ℃和800 ℃处,且其在280~600 ℃时还原率约为40 %。因此,为避免比表面积减小和表面烧结等负面影响,选择600 ℃作为空气和氢气的焙烧对比温度,可确保棒状纳米R-CeO2在氢气条件下焙烧获得较高浓度Ce3+。
2.3 紫外-可见漫反射光谱
将R-CeO2分别在600 ℃空气和600 ℃氢气气氛下焙烧2 h,得到R-CeO2-Air和R-CeO2-H2,并研究其能带结构和光催化特性。其中,在空气气氛下焙烧后,R-CeO2-Air呈鹅黄色;氢气还原处理后,R-CeO2-H2呈灰绿色,表明CeO2被部分还原,与热重结果吻合[12]。R-CeO2-H2发生的化学反应如下:
CeO2+xH2→ CeO2-x+xH2O,
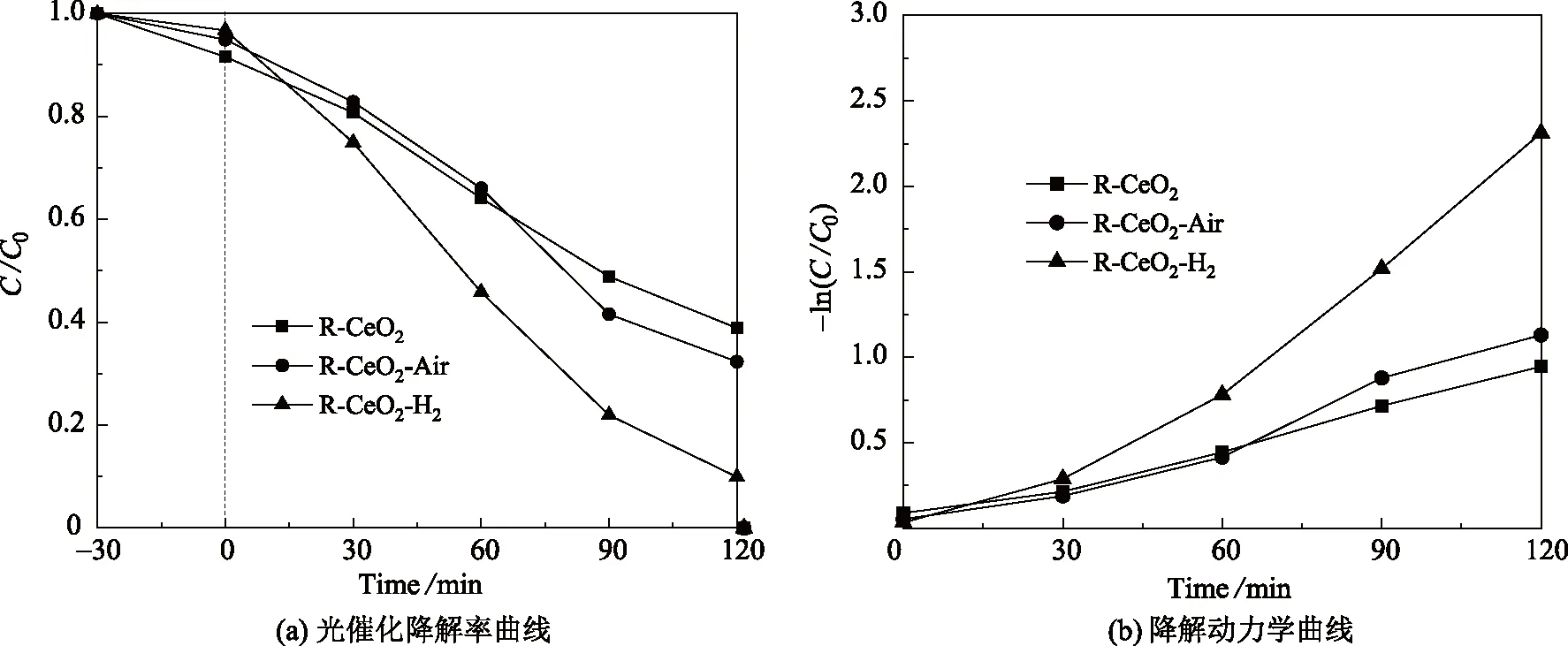
式中0 通过Kubelka-Munk公式[19]:A(hv-Eg)n/2=αhv计算各样品带隙Eg,其中,α为吸收系数,h为普朗克常数,v为光频率,A为比例常数,n的值与半导体材料以及跃迁类型相关。R-CeO2、R-CeO2-Air和R-CeO2-H2的紫外-可见漫反射光谱和带隙如图4所示。从图4(a)可知,R-CeO2的紫外光吸收能力最强,R-CeO2-H2的漫反射光谱较R-CeO2和R-CeO2-Air明显蓝移。据LEE等[19]称不同的合成方法使CeO2的带隙为2.7~3.4 eV。从图4(b)可知,R-CeO2、R-CeO2-Air和R-CeO2-H2的能带间隙分别为2.882 eV、3.019 eV和3.260 eV,表明氢气还原可使棒状纳米CeO2的能带间隙变宽。目前,大多数研究发现Ce3+的出现对能带有窄化效果,ANSARI[20]等发现经电子束照射处理后,CeO2的氧空位浓度增加,其能带间隙从3.36 eV降至3.12 eV;前期研究[21]发现,在KOH-NaOH熔盐中,与使用聚四氟乙烯内衬为反应容器相比,以坩埚为反应容器在200 ℃下制备的CeO2-x,其Ce3+表面分数从14.7 %增加到17.1 %,能带间隙从3.0 eV降至2.9 eV。但是GAO等[10]通过表面刻蚀还原处理得到的CeO2能带间隙有所增加。因此,氢气还原导致CeO2能带间隙变宽的原因还需进一步深入研究。 图4 R-CeO2、R-CeO2-Air和R-CeO2-H2的紫外-可见漫反射光谱和带隙 图5为R-CeO2、R-CeO2-Air和R-CeO2-H2对MB溶液的光催化降解效率曲线和降解动力学曲线。MB溶液降解率[22]的计算方法如下: 图5 R-CeO2、R-CeO2-Air 和 R-CeO2-H2的光催化降解率曲线和降解动力学曲线 降解率(%)=(C0-C)/C0×100 %, 式中,C0和C分别为MB溶液的初始浓度和测试浓度。 在低浓度MB溶液和弱吸附条件下,光催化反应一般遵循L-H(Langmuir-Hinshelwood)动力学方程,故拟一阶反应速率常数方程为[23]: ln(C)=-kt+ln(C0), 式中:k为拟一阶反应速率常数;t为光照时间。计算结果如表1所示。 表1 R-CeO2、R-CeO2-Air 和 R-CeO2-H2的光催化降解率和反应速率常数 从表1和图5可知:R-CeO2-H2在120 min时使MB溶液降解了90.09 %,反应速率常数达到0.015 72 min-1;相比于在空气中焙烧的R-CeO2-Air,氢气还原处理使得棒状CeO2的光催化性能显著提高。未焙烧的R-CeO2的光催化性能较差,这可能是R-CeO2未经焙烧,在光反应过程中微粒团聚,使其接触MB溶液的有效面积减小导致。 CeO2的光催化性能受到比表面积、尺寸、形貌、能带间隙、光生载流子迁移/复合速率和降解溶液与催化剂反应产生的活性离子、自由基等因素的影响。其中,通过窄化CeO2能带结构和提高光生载流子迁移效率,使CeO2对紫外光和可见光均敏感,能显著提升CeO2光催化活性[24]。当催化剂受到大于其能带能量的光照后,价带电子受激发跃迁到导带,在价带留下空穴。产生的电子和空穴在扩散作用下分别迁移至催化剂表面。 氧空位的出现(Ce4+→Ce3+)会促进H2O和O2的吸附,并作为电子陷阱捕获光生载流子,然后转变为具有强氧化性和还原性的超氧自由基和羟基自由基以光催化降解有机物质[25]。YOUNIS等[26]报道称富Ce3+的CeO2可有效提高光生载流子迁移效率并降低光生电子-空穴的复合率,显著提高其光催化效率。因此,采用氢气还原棒状纳米CeO2,可使CeO2表面产生较大浓度Ce3+,在提升催化材料吸附效率的同时,提高CeO2光生载流子的迁移速率并减慢电子和空穴的复合效率。虽然氢气还原处理后棒状纳米CeO2的能带间隙变宽,但其光催化降解效率仍有显著提升。 采用水热法制备的棒状纳米CeO2在600 ℃氢气气氛下易被还原;600 ℃氢气气氛下焙烧2 h后,棒状纳米CeO2的能带间隙增至3.260 eV,较未焙烧或相同温度空气气氛下焙烧的CeO2的能带间隙宽,但其对亚甲基蓝的光催化降解效率显著提升,为90.09%,且反应速率常数较空气条件下焙烧的样品提高了97.5%。
2.4 光催化特性

3 结论
