SLE患儿外周血TLR-4、HMGB1的表达及临床意义
2020-12-03吕迎霞杨俊梅郑莉娟黄庆华
吕迎霞, 杨俊梅, 郑莉娟, 黄庆华
(河南省儿童医院郑州儿童医院 郑州市儿童感染与免疫重点实验室,河南 郑州 450053)
系统性红斑狼疮(systemic lupus erythematosus,SLE)发病机制复杂,有10%以上的SLE在儿童期发病,相对于成人来说,儿童SLE的预后相对较差。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种强力的促炎因子,通过与细胞受体结合等一系列信号途径而促进炎症反应的发展[1]。Toll样受体4(Tolllike receptor 4,TLR-4)与相应的配体结合后,可通过信号转导激活多种免疫细胞,产生多种细胞因子和自身抗体[2]。有研究结果显示,TLR-4、HMGB1可能存在一定的协同作用,可影响儿童SLE的发生、发展[3]。但关于TLR-4、HMGB1与儿童SLE病情相关性的研究鲜有报道。本研究旨在探讨TLR-4、HMGB1在儿童SLE中的临床意义。
1 材料和方法
1.1 研究对象
选取2018年7月—2019年7月河南省儿童医院SLE患儿40例(SLE组)。以系统性红斑狼疮疾病活动度指数(systemic lupus erythematosus disease activity index,SLEDAI)评分≥10分的患儿作为活动期组,其中男12例、女8例,年龄3~13岁;以SLEDAI评分<10分的患儿作为稳定期组,其中男13例、女7例,年龄2~11岁。40例SLE患儿中,狼疮性肾炎患儿24例(狼疮性肾炎组,其中活动期11例、稳定期13例)、非肾炎患儿16例(非肾炎组,其中活动期9例、稳定期7例)。纳入标准:(1)所有患儿均符合《儿科学》(第8版)[4]中的诊断标准;(2)确诊前未使用过免疫抑制剂及糖皮质激素类药物。排除标准:(1)存在交流障碍;(2)伴有心、肝、肾等脏器功能不全;(3)患儿及家属不愿意配合;(4)对本研究所涉及的药物过敏。另选取15名体检健康儿童作为正常对照组,其中男9名、女6名,年龄4~12岁。各组年龄、性别差异均无统计学意义(P>0.05)。本研究经河南省儿童医院伦理委员会批准,所有患儿家属均签署知情同意书。
1.2 方法
采集所有患儿入院后次日清晨、健康儿童体检当日清晨的空腹静脉血5 mL,离心后分离血清,-70 ℃保存待测。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清白细胞介素(interleukin,IL)-17、IL-23、HMGB1及TLR-4水平,试剂盒购自滁州仕诺达生物科技有限公司。采用ELISA检测抗双链DNA(double-stranded DNA,dsDNA)抗体水平,试剂盒购自上海雅吉生物科技有限公司。采用间接免疫荧光法检测抗Sm抗体水平,试剂盒购自上海川至生物技术有限公司。采用免疫比浊法检测血清C3、C4、C反应蛋白(C-reactive protein,CRP)、IgM、IgG水平,试剂盒均购自常州贝源鑫生物科技有限公司,检测仪器为U-8020全自动生化分析仪(桂林优利特公司)。所有操作均严格按仪器和试剂盒说明书操作。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的数据以x±s表示,2个组之间比较采用t检验,多组间比较采用方差分析,两两比较采用q检验。计数资料以率表示,组间比较采用χ2检验。采用Pearson相关分析评估各项指标之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 SLE组与正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较
SLE组血清IL-17、IL-23、HMGB1及TLR-4水平均高于正常对照组(P<0.001)。见表1。
SLE活动期组、稳定期组血清IL-17、IL-23、HMGB1及TLR-4水平均高于正常对照组(P<0.05),且SLE活动期组4项指标均高于稳定期组(P<0.05)。见表2。
2.2 狼疮性肾炎组、非肾炎组及正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较
狼疮性肾炎组及非肾炎组血清IL-17、IL-23、HMGB1及TLR-4水平均高于正常对照组(P<0.05),且狼疮性肾炎组4项指标水平均高于非肾炎组(P<0.05)。见表3。
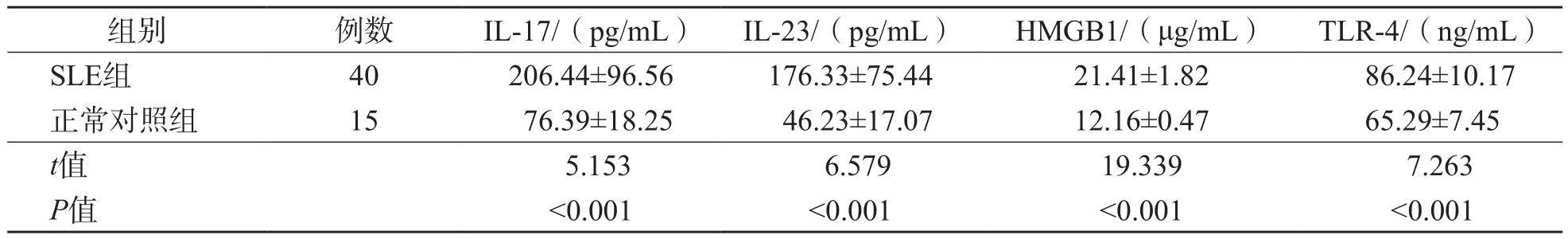
表1 SLE组与正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较 x±s
表2 SLE活动期组、稳定期组及正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较 ±s
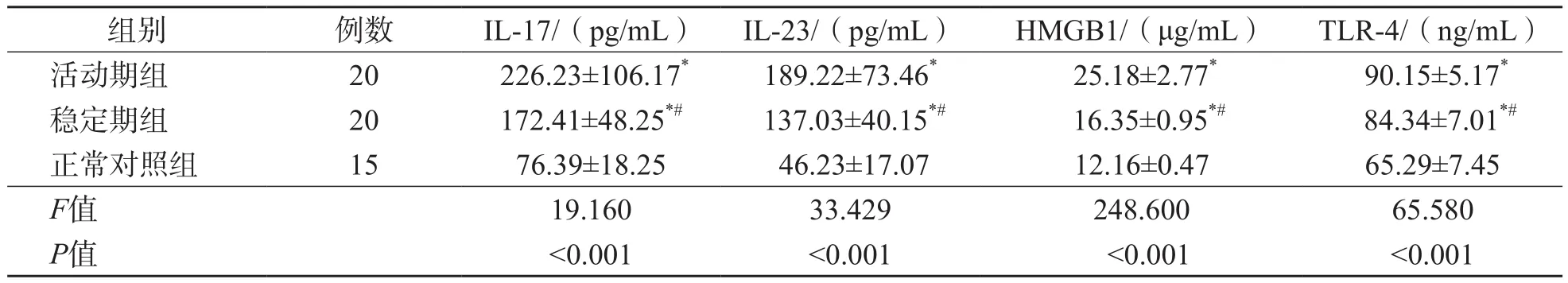
表2 SLE活动期组、稳定期组及正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较 ±s
注:与正常对照组比较,*P<0.05;与活动组比较,#P<0.05
组别 例数 IL-17/(pg/mL) IL-23/(pg/mL) HMGB1/(μg/mL) TLR-4/(ng/mL)活动期组 20 226.23±106.17* 189.22±73.46* 25.18±2.77* 90.15±5.17*稳定期组 20 172.41±48.25*# 137.03±40.15*# 16.35±0.95*# 84.34±7.01*#正常对照组 15 76.39±18.25 46.23±17.07 12.16±0.47 65.29±7.45 F值 19.160 33.429 248.600 65.580 P值 <0.001 <0.001 <0.001 <0.001
表3 狼疮性肾炎组、非肾炎组及正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较 ±s
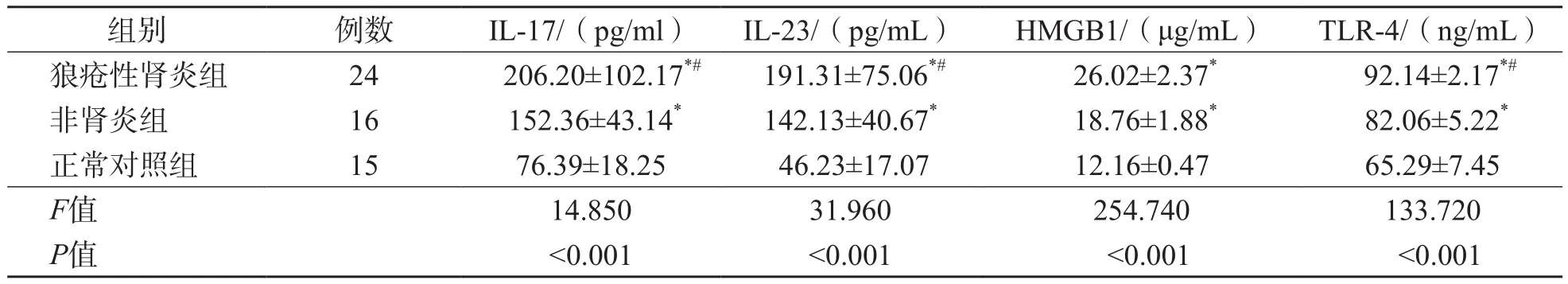
表3 狼疮性肾炎组、非肾炎组及正常对照组血清IL-17、IL-23、HMGB1及TLR-4水平的比较 ±s
注:与正常对照组比较,*P<0.05;与非肾炎组比较,#P<0.05
组别 例数 IL-17/(pg/ml) IL-23/(pg/mL) HMGB1/(μg/mL) TLR-4/(ng/mL)狼疮性肾炎组 24 206.20±102.17*# 191.31±75.06*# 26.02±2.37* 92.14±2.17*#非肾炎组 16 152.36±43.14* 142.13±40.67* 18.76±1.88* 82.06±5.22*正常对照组 15 76.39±18.25 46.23±17.07 12.16±0.47 65.29±7.45 F值 14.850 31.960 254.740 133.720 P值 <0.001 <0.001 <0.001 <0.001
2.3 SLE患儿各项指标的相关性
HMGB1与TLR-4、IL-17、IL-23均呈正相关(r值分别为0.424、0.563、0.498,P<0.05)。IL-17与SLEDAI评分呈正相关(r=0.726,P<0.05),与抗dsDNA抗体、抗Sm抗体、C3、C4、IgM、IgG及CRP均无相关性(r值分别为0.133、0.067、0.143、-0.450、0.214、0.022、0.031,P>0.05)。IL-23与SLEDAI评分、IgM、IgG、CRP均呈正相关(r值分别为0.615、0.321、0.465、0.587,P<0.05),与C3、C4均呈负相关(r值分别为-0.461、-0.399,P<0.05),与抗dsDNA抗体、抗Sm抗体均无相关性(r值分别为0.076、0.046,P>0.05)。HMGB1与SLEDAI评分、抗dsDNA抗体、IgM、IgG均呈正相关(r值分别为0.727、0.659、0.487、0.550,P<0.05),与C3呈负相关(r=-0.367,P<0.05),与抗Sm抗体、C4、CRP均无相关性(r值分别为0.058、-0.238、0.136,P>0.05)。TLR-4与SLEDAI评分、抗dsDNA抗体、CRP、IgM均呈正相关(r值分别为0.762、0.721、0.614、0.636,P<0.05),与C3、C4均呈负相关(r值分别为-0.520、-0.434,P<0.05),与抗Sm抗体、IgG均无相关性(r值分别为0.046、0.045,P>0.05)。
3 讨论
SLE的发病因素目前尚未被完全阐明,一般认为是在各种因素相互作用下,T淋巴细胞被激活、B淋巴细胞增生,产生大量抗体,与体内对应的抗原结合形成免疫复合物[5],在皮肤、血管、肾小球等参与下引起急、慢性炎症和组织坏死,从而导致各系统的损伤。T淋巴细胞亚群中的辅助性T细胞(T helper cell,Th)17主要分泌IL-17、IL-23等细胞因子,具有强大的促炎作用[6]。有研究结果显示,自身免疫性疾病患者IL-17表达异常,而IL-23在Th17的增殖中起重要作用,可促进Th释放IL-17[7]。
HMGB1是高迁移率族蛋白(high mobility group protein,HMG)家族中的一员,是一种核内非组蛋白,在不同状态下与DNA结合,维持核内小体结构,是细胞生存与生长的必须蛋白[8]。HMGB1还可分泌到核外,是一种强大的新型致炎因子,可通过体内单核细胞的刺激或坏死细胞的被动分泌在细胞外参与机体免疫炎症反应[9]。此外,HMGB1作为促炎细胞因子,还参与了体内炎症的发生及发展过程[10-11]。有研究结果显示,TLR-4可能作为HMGB1的受体共同参与信号转导,在HMGB1诱导的巨噬细胞及中性粒细胞活化中起重要作用;而TLR-4被HMGB1激活后可修复白细胞介素受体激酶(interleukin receptor kinase,IRAK),继而激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径,产生炎症应答[12]。有研究结果显示,SLE患儿血浆和血清中HMGB1水平显著升高,HMGB1的核内复合物可激活抗原细胞,影响抗dsDNA抗体,从而促进SLE患者的免疫耐受机制损伤[10,13]。还有研究结果显示,风湿性关节炎和狼疮性肾炎患者HMGB1水平明显升高[11],提示HMGB1与自身免疫性疾病的发生、发展密切相关。
本研究结果显示,SLE组血清IL-17、IL-23、HMGB1及TLR-4水平高于正常对照组(P<0.05),且SLE活动期组高于稳定期组(P<0.05),狼疮性肾炎组高于非肾炎组(P<0.05),提示IL-17、IL-23、HMGB1及TLR-4可能参与了SLE的发生、发展[14]。相关分析结果显示,HMGB1与TLR-4、IL-17、IL-23均呈正相关(r值分别为0.424、0.563、0.498,P<0.05);IL-17与SLEDAI评分呈正相关(r=0.726,P<0.05);IL-23与SLEDAI评分、IgM、IgG、CRP均呈正相关(r值分别为0.615、0.321、0.465、0.587,P<0.05),与C3、C4均呈负相关(r值分别为-0.461、-0.399,P<0.05);HMGB1与抗dsDNA抗体、抗Sm抗体、IgM、IgG均呈正相关(r值分别为0.727、0.659、0.487、0.550,P<0.05),与C3呈负相关(r=-0.367,P<0.05);TLR-4与SLEDAI评分、抗dsDNA抗体、CRP、IgM均呈正相关(r值分别为0.762、0.721、0.614、0.636,P<0.05),与C3、C4水平均呈负相关(r值分别为-0.520、-0.434,P<0.05)。由此可见,SLE患者血清IL-17、IL-23、HMGB1及TLR-4水平升高可能与SLE疾病活动有关,或可作为SLE疾病活动的参考指标[15]。
综上所述,IL-17、IL-23、HMGB1及TLR-4与SLE的发生、发展有一定关系,对SLE的肾脏损伤也有一定的提示作用。
