STC-1通过Bcl-2介导胃癌细胞的增殖和凋亡*
2020-12-03刘亿邓洪姜一帆李宗林赵正飞徐亮
刘亿, 邓洪, 姜一帆, 李宗林, 赵正飞, 徐亮
STC-1通过Bcl-2介导胃癌细胞的增殖和凋亡*
刘亿, 邓洪, 姜一帆, 李宗林, 赵正飞, 徐亮△
(西南医科大学附属医院胃肠外科,四川 泸州 646300)
研究斯钙素1 (STC-1)是否通过Bcl-2介导胃癌AGS细胞的增殖和凋亡。将-敲减或过表达质粒转染AGS细胞,用MTT法和集落形成实验检测细胞的增殖能力,划痕实验检测细胞的迁移能力,Hoechst 33342染色和annexin V-FITC/PI双染法分析细胞凋亡水平, Western blot法检测Bcl-2、survivin、caspase-3及cleared caspase-3蛋白表达水平。RT-PCR法检测20例临床胃癌组织和癌旁组织中STC-1和Bcl-2的mRNA表达水平, Pearson法分析二者的相关性。过表达STC-1后, AGS细胞的增殖和迁移能力提高,且Bcl-2和survivin的表达水平升高,而caspase-3及cleared caspase-3的表达水平降低(<0.05);敲减-表达后, AGS细胞的增殖和迁移能力降低,且Bcl-2和survivin的表达水平降低,而caspase-3及cleared caspase-3的表达水平升高(<0.05)。胃癌组织中STC-1和Bcl-2的mRNA相对表达量均高于癌旁组织。Pearson相关分析结果显示,胃癌组织中STC-1的mRNA与Bcl-2的mRNA表达呈正相关(=0.308,=0.011)。STC-1可能通过改变Bcl-2的表达水平调节胃癌细胞的生物学功能。
斯钙素1;Bcl-2蛋白;细胞增殖;细胞凋亡;胃癌
胃癌是消化系统常见的肿瘤,2020年预计我国胃癌发病率为24.30/10万,新发病例数约为34.6万[1]。外科手术是治疗胃癌的主要方法,然而由于大部分患者确诊胃癌时已属晚期,手术疗效欠佳,术后5年生存率一直维持在30%左右[2]。肿瘤靶向药物是近年来研究的热点。斯钙素1 (stanniocalcin-1, STC-1)是一种分泌性糖蛋白激素,可参与钙磷代谢、线粒体氧化和免疫炎症等多种生物学行为的调控。STC-1高表达于人类多种肿瘤,与肿瘤细胞增殖、分化、侵袭、凋亡和血管生成等密切相关[3-5]。近年来,有研究发现胃癌患者外周血和癌组织中STC-1表达水平显著升高,并且其表达水平与胃癌增殖和转移有关[6-7]。然而STC-1调节胃癌生物学行为的机制研究,既往鲜有。He等[8]发现,STC-1可能通过上调血管内皮生长因子,激活蛋白激酶C βII (protein kinase C βII, PKCβII)和细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)信号通路,从而促进肿瘤血管生成。Bcl-2是凋亡级联反应上游的关键蛋白,Bcl-2与胃癌细胞的增殖和凋亡密切相关[9]。有研究发现,STC-1过度表达可以上调Bcl-2表达,进而抑制细胞凋亡[10]。因此可以猜测,STC-1可以通过Bcl-2介导胃癌细胞的增殖和凋亡。本研究通过构建-干扰重组质粒和STC-1过表达重组质粒,检测胃癌AGS细胞转染后Bcl-2及相关分子caspase-3和survivin表达水平的变化,及其对癌细胞增殖和凋亡的影响,旨在探讨寻找治疗胃癌的潜在靶点。
材料和方法
1 细胞
胃癌AGS细胞购于泉州市睿信生物科技有限公司,培养于含10%胎牛血清的RPMI-1640培养基中,置于37℃、5%CO2的恒温箱中培养。培养48 h时用0.25%胰酶消化,进行传代。取第3代生长良好的细胞用于后续实验。
2 试剂和仪器
RPMI-1640培养基和0.25%胰蛋白酶(杭州吉诺生物医药技术有限公司); RNA检测试剂盒和MTT试剂盒(上海江莱生物科技有限公司);转染试剂Lipofectamine 2000 (Invitrogen); Hoechst 33342活细胞染色液和annexin V-FITC/PI细胞凋亡检测试剂盒(北京市雷根生物技术有限公司);抗Bcl-2、caspase-3和survivin多克隆抗体(Bioworld);细胞培养板(杭州欣友生物技术有限公司)。IX51型荧光显微镜(Olympus); ABI 7900实时定量PCR仪(Bio-Rad);DxI 800全自动化学发光仪(Beckman Coulter);ELx808酶标仪(BioTek)。
3 方法
3.1构建质粒-干扰序列为5'-GCCACTTTGCGTAGCTTAA-3'和5'-GTAAGTGCGGTCGACGCCTGA-3',阴性对照序列为5'-CTTCGGCTTACGACTCTGGT-3' (北京迈基诺基因科技股份有限公司)。shRNA核酸序列与环状模体TTCAAGAGA连接,插入pGPU6-Neo载体(Sigma),转化DH5α化学感受态细胞,从而构建稳定干扰STC-1的稳转细胞[11]。提取STC-1低表达质粒载体pGPU6-shSTC-1和对照质粒pGPU6-Ctrl。本实验有构建好的STC-1过表达质粒载体(pEGFP-N1-STC-1)和对照质粒(pEGFP-N1-Ctrl)。
3.2细胞转染待AGS细胞融合至85%后,将载体用Lipofectamine 2000转染入细胞,1 d后更换培养液。转染2 d后提取细胞总RNA,用RT-qPCR法检测转染后STC-1的mRNA表达水平,并用Western blot法检测STC-1的蛋白表达水平,以确定转染是否成功。
3.3MTT法和集落形成实验检测细胞增殖能力待转染后细胞数超过85%生长融合时,以每孔5×103个的密度接种于培养板,CO2恒温培养箱中培养24 h和48 h;以每孔3×103个的密度接种于培养板上,CO2恒温培养箱中培养72 h。避光条件下每孔加入MTT溶液10 µL,培养3 h后取出,离心后弃去上清液,每孔加入100 µL formazan溶解液,再培养4 h。用酶标仪检测吸光度()值,反映细胞活力。集落形成实验中,细胞以每孔300细胞接种在培养板中,用结晶紫染色后测定每孔的菌落数,仅计数直径>40 μm的菌落[12]。
3.4划痕实验检测细胞迁移能力待转染后细胞数超过85%生长融合时,用无菌移液枪头顺着培养板底端划一字型划痕,用磷酸缓冲盐溶液冲洗,随后换无血清RPMI-1640培养基进行培养,第24 h和48 h在显微镜下测量划痕宽度。细胞迁移率(%)=(1-测量时划痕宽度/初始划痕宽度)×100%[13]。
3.5Hoechst 33342染色和annexin V-FITC/PI 双染法分析细胞凋亡Hoechst 33342染色法步骤:以每孔1.5×105细胞的密度将AGS细胞接种于培养板中,培养24 h后用4%甲醛在PBS中固定10 min。用10 mg/L Hoechst 33342在37℃下染色10 min,用显微镜观察AGS细胞形态学。annexin V-FITC/PI双染法步骤:细胞培养24 h后,用PBS洗涤。室温下用annexin V-FITC/PI染色15 min,最后用流式细胞术检测凋亡情况[14]。
3.6RT-qPCR法检测mRNA的表达水平取细胞上清液进行检测,用Trizol法提取总RNA,逆转录后进行RT-qPCR检测。每个样本最少重复3次,设置3个复孔。反应条件为: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环。引物序列由北京迈基诺基因科技股份有限公司设计并提供。STC-1的上游引物序列为5'-GACTTCAACAGGAGACGCAC-3',下游引物序列为5'-TGCATGAAACTAGGCTTCTG-3'; Bcl-2的上游引物序列为5'-CCATGAAACAAAGCTGCAGG-3',下游引物序列为5'-TGTGCCTGTAAACATAGATT-3';内参照GAPDH的上游引物序列为5'-GCTGCTGTTAGATGTTTTCAGAAGT-3',下游引物序列为5'-CCTCCTCACCGCCAAGTATGAAC-3'。
取20例胃癌患者的癌组织和癌旁组织各50 mg,液氮中研磨,匀浆后提取总RNA。按上法检测STC-1和Bcl-2的mRNA表达水平。
3.7Westernblot法检测蛋白表达水平细胞中加入蛋白裂解液,冰上裂解25 min后离心15 min,将上清液转移至EP管中。样品中加入SDS缓冲液煮沸5 min使蛋白变性。经SDS-PAGE后将蛋白转移至PVDF膜上,用5%脱脂奶粉封闭1 h,孵育Ⅰ抗,4℃过夜,弃去Ⅰ抗,TBST洗膜3次,每次5 min。室温孵育Ⅱ抗2 h,弃去Ⅱ抗,TBST洗膜3次,每次5 min。ECL显色,以β-actin作为内参照。
4 统计学处理
采用SPSS 20.0进行统计学分析。多组间均数比较采用单因素方差分析,两两比较方差齐采用SNK-法,方差不齐采用Dennett T3法。两组间均数比较采用两独立样本检验;重复测量资料组间比较采用协方差分析;相关性检验用Pearson分析。以<0.05为差异有统计学意义。
结果
1 转染后AGS细胞STC-1的表达水平
转染STC-1低表达质粒后,AGS细胞STC-1的mRNA和蛋白表达水平显著下降(<0.05),转染STC-1过表达质粒后,AGS细胞STC-1的mRNA和蛋白表达水平显著升高(<0.05),见图1。
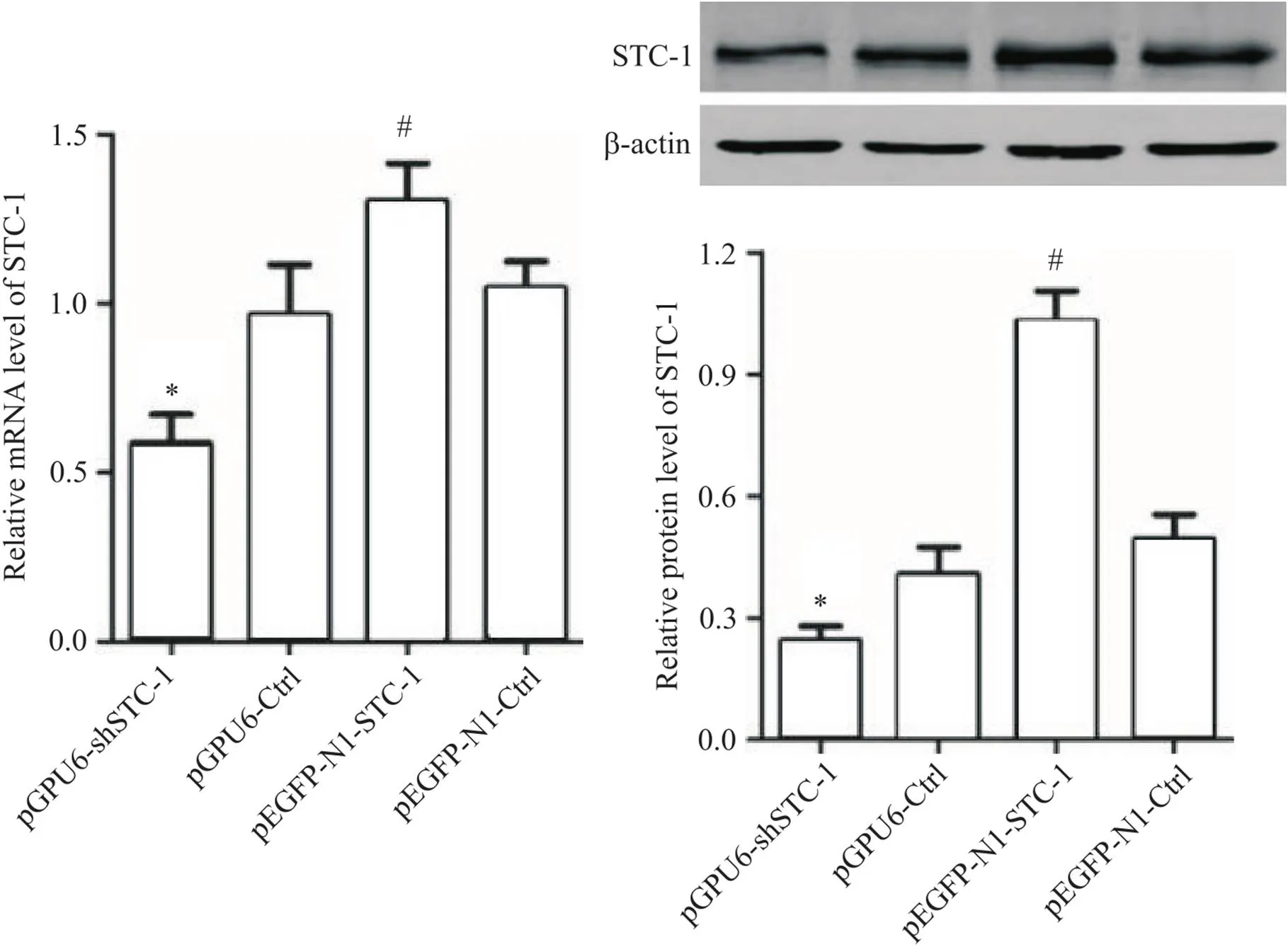
Figure 1. The mRNA and protein expression levels of STC-1 in the AGS cells after transfection. Mean±SD. n=3. *P<0.05 vs pGPU6-Ctrl group; #P<0.05 vs pEGFP-N1-Ctrl group.
2 MTT法和集落形成实验检测AGS细胞的增殖状况
细胞培养至48 h和72 h时,pGPU6-shSTC-1组细胞的活力和集落形成数量均显著低于pGPU6-Ctrl组(<0.05); pEGFP-N1-STC-1组细胞活力和集落形成数量显著高于pEGFP-N1-Ctrl组(<0.05),见图2、3。

Figure 2. MTT assay was used to measure the viability of AGS cells after plasmid transfection. Mean±SD. n=3. *P<0.05 vs pGPU6-Ctrl group; #P<0.05 vs pEGFP-N1-Ctrl group.
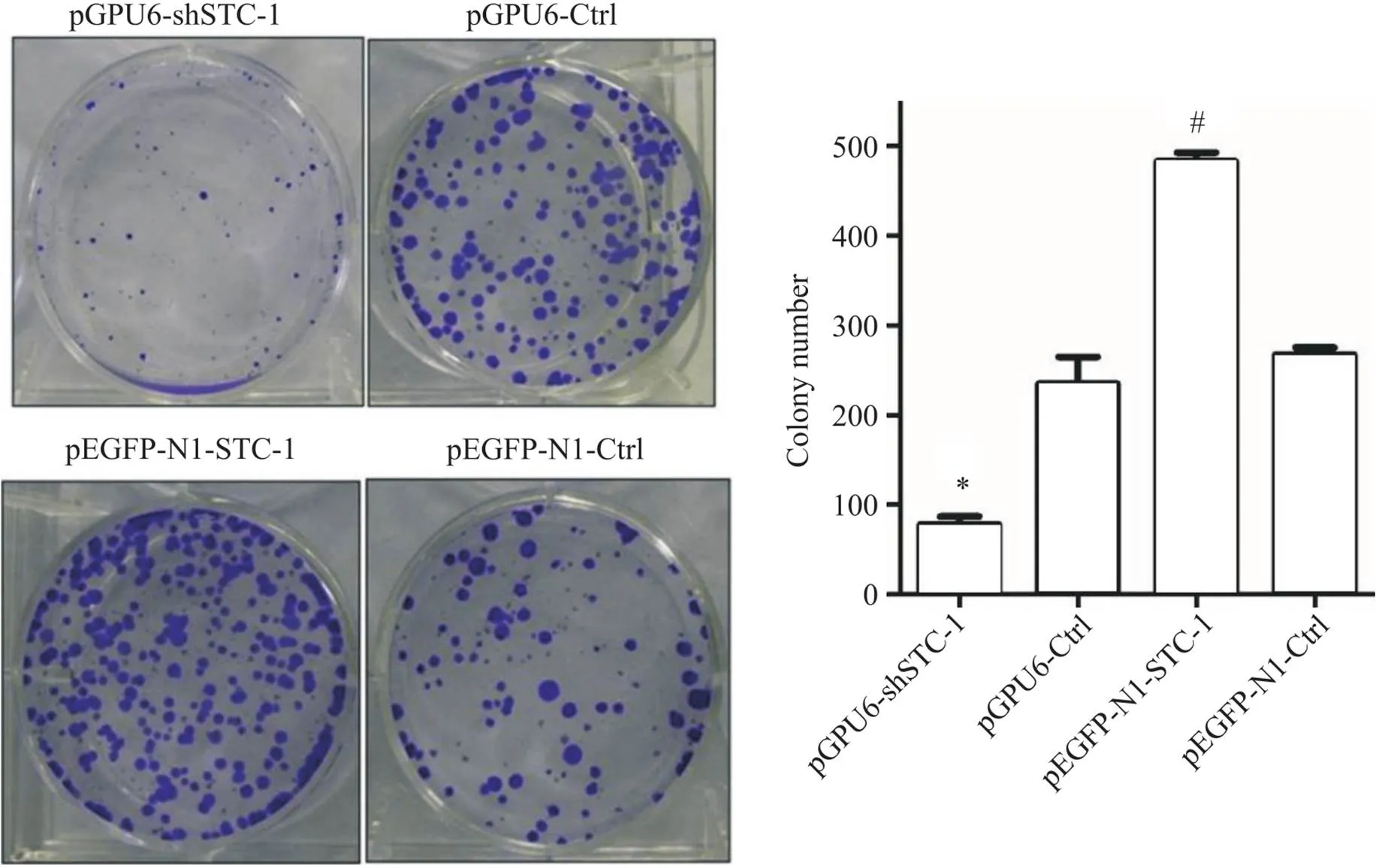
Figure 3. The colony formation of AGS cells after transfection. Mean±SD. n=3. *P<0.05 vs pGPU6-Ctrl group; #P<0.05 vs pEGFP-N1-Ctrl group.
3 划痕实验检测AGS细胞的迁移能力
细胞培养至48 h和72 h时, pGPU6-shSTC-1组细胞的迁移能力显著低于pGPU6-Ctrl组(<0.05);pEGFP-N1-STC-1组细胞的迁移能力显著高于pEGFP-N1-Ctrl组(<0.05),见图4。

Figure 4. Scratch assay was used to detect the migration ability of AGS cells after transfection (×100). Mean±SD. n=3. *P<0.05 vs pGPU6-Ctrl group; #P<0.05 vs pEGFP-N1-Ctrl group.
4 Hoechst 33342染色和annexin V-FITC/PI双染法分析AGS细胞凋亡
pGPU6-shSTC-1组细胞凋亡比例显著高于pGPU6-Ctrl组(<0.05); pEGFP-N1-STC-1组细胞凋亡比例显著低于于pEGFP-N1-Ctrl组(<0.05),见图5、6。

Figure 6. Flow cytometry with annexin V-FITC/PI double staining was used to observe the apoptosis of AGS cells after transfection. Mean±SD. n=3. *P<0.05 vs pGPU6-Ctrl group; #P<0.05 vs pEGFP-N1-Ctrl group.
5 STC-1对Bcl-2及其相关分子蛋白水平的影响
pGPU6-shSTC-1组Bcl-2和survivin蛋白水平均低于pGPU6-Ctrl组(<0.05),而caspase-3及cleared caspase-3的蛋白水平较高(<0.05); pEGFP-N1-STC-1组Bcl-2和survivin的蛋白水平高于pEGFP-N1-Ctrl组,而caspase-3及cleared caspase-3的蛋白水平较低(<0.05),见图7。
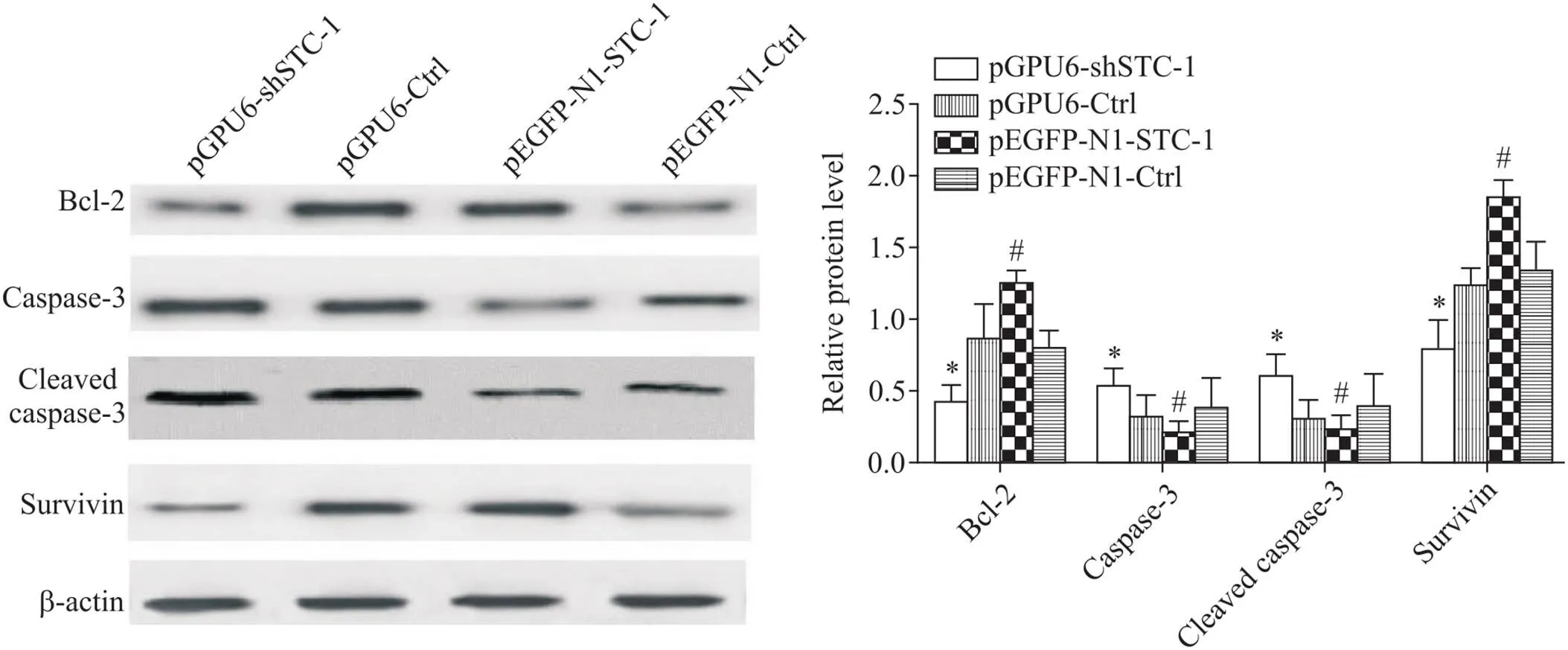
Figure 7. Western blot was used to determine the protein levels of Bcl-2, caspase-3 and survivin. Mean±SD. n=3. *P<0.05 vs pGPU6-Ctrl group; #P<0.05 vs pEGFP-N1-Ctrl group.
6 胃癌组织STC-1和Bcl-2的mRNA表达水平及相关性分析
胃癌组织STC-1和Bcl-2的mRNA相对表达量均高于癌旁组织(<0.05),见图8。Pearson相关分析结果显示,癌组织中STC-1mRNA与Bcl-2 mRNA的表达呈正相关(<0.05),见图9。
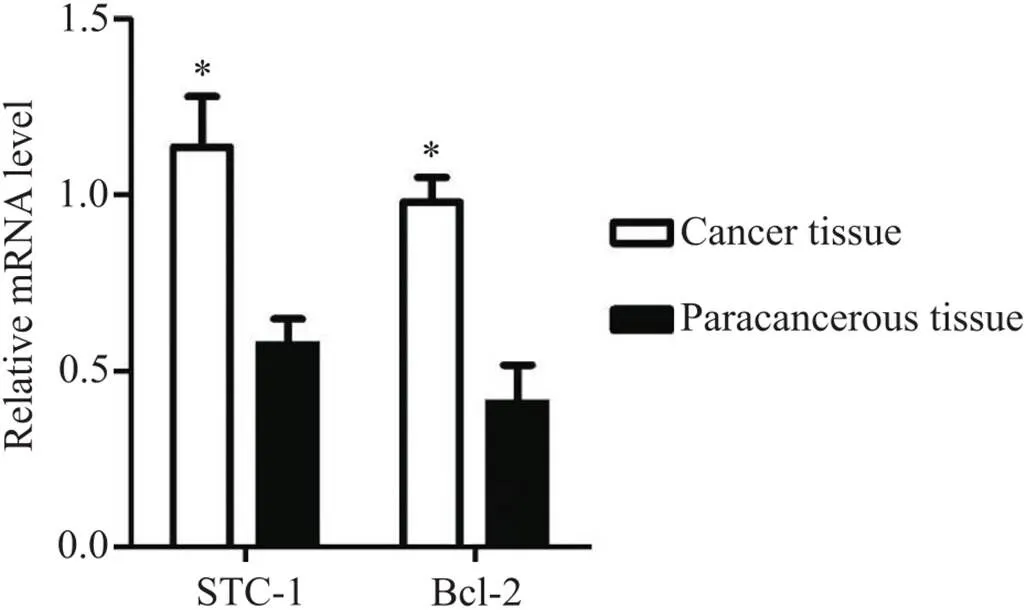
Figure 8. The relative mRNA expression levels of STC-1 and Bcl-2 in the gastric cancer tissues. Mean±SD. n=20. *P<0.05 vs paracancerous tissues.
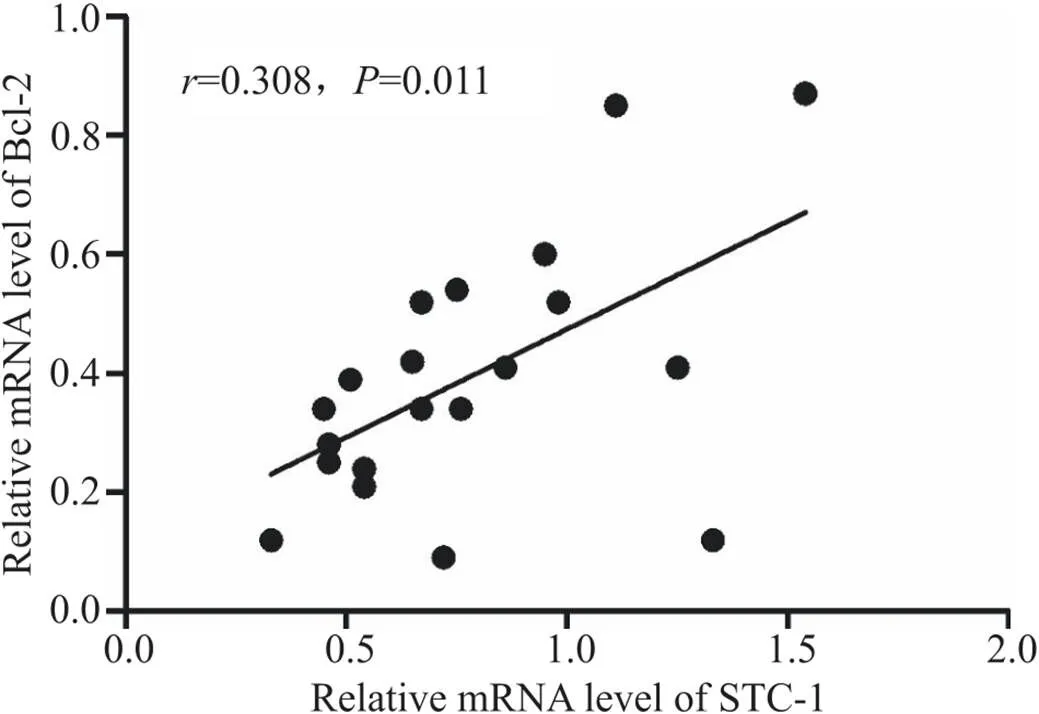
Figure 9. Analysis of correlation between STC-1 and Bcl-2 (n=20).
讨论
STC-1是由一个糖基化同源二聚体细胞分泌的蛋白,其可通过旁分泌方式参与机体多种生理功能,属于多效因子[15]。STC-1具有促进肿瘤细胞增殖、抑制凋亡、促进血管形成和适应低氧微环境等作用[16]。既往研究显示,胃癌患者外周血和癌组织中STC-1表达水平显著升高,并且其表达水平与胃癌增殖和转移有关[6-7]。本研究对AGS 细胞分别转染STC-1低表达质粒和过表达质粒,发现STC-1可能通过调控Bcl-2介导癌细胞的增殖和凋亡。在体内研究中,我们发现胃癌组织STC-1 mRNA的相对表达量高于癌旁组织,说明STC-1在胃癌中扮演重要角色。
STC-1调节癌细胞增殖的研究既往较多,Jeon等[17]发现STC-1可以通过上调Akt/NF-κB通路促进三阴性乳腺癌细胞的增殖。在食管癌的研究中,卜秀梅等[18]发现抑制-基因过表达可以降低食管鳞癌细胞的增殖活力并促进凋亡,另外对JAK2/STAT3信号通路及其介导的炎症损伤有一定的抑制作用。STC-1调控胃癌细胞生物学行为的研究既往较少。He等[8]发现,STC-1可能通过上调血管内皮生长因子,激活PKCβII和ERK1/2信号通路,从而促进肿瘤血管生成。这说明STC-1对肿瘤细胞增殖有促进作用。本研究用MTT法和集落形成实验对胃癌AGS细胞进行检测,结果显示过表达STC-1对AGS细胞增殖有促进作用。划痕实验结果显示,过表达STC-1也可以促进AGS细胞迁移。
凋亡在肿瘤的发生和发展中扮演着重要角色[19-20]。樊鑫等[21]发现STC-1可以抑制膀胱癌5637细胞凋亡,凋亡细胞比例从(53.43±2.04)%下降至(18.48±0.87)%。卜秀梅等[18]在食管癌的研究中也证实了STC-1抗凋亡的作用。本研究采用Hoechst 33342染色和annexin V-FITC/PI双染法分析AGS细胞凋亡,结果显示过表达STC-1抑制了AGS细胞的凋亡。Bcl-2与细胞增殖和凋亡密切相关,本研究发现Bcl-2表达水平的变化与STC-1一致,并且体内研究中肿瘤组织STC-1 mRNA与Bcl-2 mRNA的表达也呈正相关。-是细胞凋亡中最重要的基因,Bcl-2抑制细胞凋亡的机制可能为:减少氧自由基和脂质过氧化;抑制钙离子跨膜流动,影响细胞膜通透性;促进Bax形成二聚体[22]。本研究发现,过表达SCT-1后survivin蛋白表达水平升高,而caspase-3蛋白表达水平降低。caspase-3处于细胞凋亡通路下游,与Bcl-2的表达呈负相关。Bcl-2可以抑制细胞膜通透性和细胞色素C的释放,进而抑制caspase-3的激活及其级联反应,使细胞免于凋亡[23]。survivin是新型凋亡抑制因子,属于IAP家族成员,可以通过抑制caspase-3发挥抗凋亡效应,进而促进癌症的发生[24]。本研究结果提示,STC-1在胃癌细胞凋亡中扮演重要角色。
综上所述,本研究发现STC-1可能通过改变Bcl-2的表达水平调节胃癌AGS细胞的生物学功能。然而STC-1是以何种方式调控Bcl-2,有待进一步研究。STC-1对胃癌的调节还有待深入,进一步阐述其机制有助于胃癌的靶向治疗。
[1]杨之洵. 中国胃癌发病趋势及预测[J]. 中国肿瘤, 2019, 28(5):321-326.
Yang ZX. Incidence and prediction of gastric cancer in China[J]. Chin Cancer, 2019, 28(5):321-326.
[2] Song Z, Wu Y, Yang J, et al. Progress in the treatment of advanced gastric cancer[J]. Tumour Biol, 2017, 39(7):1-9.
[3] Yang Y, Yin S, Li S, et al. Stanniocalcin 1 in tumor microenvironment promotes metastasis of ovarian cancer[J]. Onco Targets Ther, 2019, 12(1):2789-2798.
[4] Li Y, He ZC, Zhang XN, et al. Stanniocalcin-1 augments stem-like traits of glioblastoma cells through binding and activating NOTCH1[J]. Cancer Lett, 2018, 416(1):66-74.
[5] Chan KK, Leung CO, Wong CC, et al. Secretory stanniocalcin 1 promotes metastasis of hepatocellular carcinoma through activation of JNK signaling pathway[J]. Cancer Lett, 2017, 403(1):330-338.
[6]陈忠,陈聆,孟凡祥. 胃癌患者外周血中斯钙素1 mRNA的表达及意义[J]. 广东医学, 2012, 33(21):3243-3245.
Chen Z, Chen L, Meng FX. The expression and significance of stanniocalcin 1 mRNA in peripheral blood of patients with gastric cancer[J]. Guangdong Med J, 2012, 33(21):3243-3245.
[7] Arigami T, Uenosono Y, Ishigami S, et al. Expression of stanniocalcin 1 as a potential biomarker of gastric cancer[J]. Oncology, 2012, 83(3):158-164.
[8] He LF, Wang TT, Gao QY, et al. Stanniocalcin-1 promotes tumor angiogenesis through up-regulation of VEGF in gastric cancer cells[J]. J Biomed Sci, 2011, 18(1):39-46.
[9] Guo D, Zhang B, Liu S, et al. Xanthohumol induces apoptosis via caspase activation, regulation of Bcl-2, and inhibition of PI3K/Akt/mTOR-kinase in human gastric cancer cells[J]. Biomed Pharmacother, 2018, 106:1300-1306.
[10] Liu G, Yang G, Chang B, et al. Stanniocalcin 1 and ovarian tumorigenesis[J]. J Natl Cancer Inst, 2010, 102(11):812-827.
[11] 张梦瑶,杨峰,刘开东,等. 利用同源重组技术构建DKK1、BMP4真核表达载体及共转染成纤维细胞表达的研究[J]. 华北农学报, 2018, 33(5): 117-124.
Zhang MY, Yang F, Liu KD, et al. Construction of eukaryotic expression vector of DKK1 and BMP4 by homologous recombination technology and co-transfection of fibroblast expression[J]. Acta Agric Boreali Sin, 2018, 33(5): 117-124.
[12] Fang F, Chang RM, Yu L, et al. MicroRNA-188-5p suppresses tumor cell proliferation and metastasis by directly targeting FGF5 in hepatocellular carcinoma[J]. J Hepatol, 2015, 63(4):874-885.
[13] Chen GM, Zheng AJ, Cai J, et al. microRNA-145-3p inhibits non-small cell lung cancer cell migration and invasion by targeting PDK1 via the mTOR signaling pathway[J]. J Cell Biochem, 2018, 119(1):885-895.
[14] Jiang Y, Jin S, Tan S, et al. MiR-203 acts as a radiosensitizer of gastric cancer cells by directly targeting ZEB1[J]. Onco Targets Ther, 2019, 12(1):6093-6104.
[15] Dalvin LA, Hartnett ME, Bretz CA, et al. Stanniocalcin-1 is a Modifier of Oxygen-Induced Retinopathy Severity[J]. Curr Eye Res, 2019, 28(1):1-6.
[16] 吴湘光,王薇. 斯钙素-1与肿瘤的研究进展[J]. 基础医学与临床, 2016, 36(10):1425-1428.
Wu XG, Wang W. Research progress of stanniocalcin-1 and tumor[J]. Basic Med Clin, 2016, 36(10):1425-1428.
[17] Jeon M, Han J, Nam SJ, et al. STC-1 expression is upregulated through an Akt/NF-kappaB-dependent pathway in triple-negative breast cancer cells[J]. Oncol Rep, 2016, 36(3):1717-1722.
[18] 卜秀梅,王文刚,李辉,等. 抑制食管癌-基因表达对食管癌细胞凋亡、IL-1β和TNF-α表达及JAK2/STAT3信号的影响研究[J]. 中国免疫学杂志, 2019, 35(2):64-69.
Bu XM, Wang WG, Li H, et al. The effect of inhibiting-gene expression in esophageal cancer cells on apoptosis, IL-1β and TNF-α expression and JAK2/STAT3 signaling in esophageal cancer cells[J]. Chin J Immun, 2019, 35(2):64-69.
[19] 余亮,江惠丽,刘豪杰,等. 褐藻多糖硫酸酯通过调控基因的表达促进胃癌细胞凋亡[J]. 中国病理生理杂志, 2019, 35(6):1075-1080.
Yu L, Jiang HL, Liu HJ, et al. Fucoidan promotes gastric cancer cell apoptosis by regulating the expression ofgene[J]. Chin J Pathophysiol, 2019, 35(6):1075-1080.
[20] Zhang YJ, Li JQ, Li HZ, et al. PDRG1 gene silencing contributes to inhibit the growth and induce apoptosis of gastric cancer cells[J]. Pathol Res Pract, 2019, 27(1):1-8.
[21] 樊鑫,师磊,宋东奎. 斯钙素-1促进膀胱癌5637细胞增殖和迁移、抑制凋亡的研究[J]. 中华实验外科杂志, 2018, 35(5):936-939.
Fan X, Shi L, Song DK. Stanniocalcin-1 promotes proliferation and migration and inhibits apoptosis of bladder cancer 5637 cells[J]. Chin J Exp Surg, 2018, 35(5):936-939.
[22] 刘俊,张雪林,任永生,等. BARF1表达下调通过活化caspase依赖的线粒体通路诱导EBV阳性胃癌细胞凋亡[J]. 中国病理生理杂志, 2015, 31(11):1970-1978.
Liu J, Zhang XL, Ren YS, et al. Down-regulation of BARF1 expression induces apoptosis of EBV-positive gastric cancer cells by activating the caspase-dependent mitochondrial pathway[J]. Chin J Pathophysiol, 2015, 31(11):1970-1978.
[23] Hu PF, Chen WP, Bao JP, et al. Paeoniflorin inhibits IL-1β-induced chondrocyte apoptosis by regulating the Bax/Bcl-2/caspase-3 signaling pathway[J]. Mol Med Rep, 2018, 17(4):6194-6200.
[24] Sam S, Sam MR, Esmaeillou M, et al. Effective targeting survivin, caspase-3 and microRNA-16-1 expression by methyl-3-pentyl-6-methoxyprodigiosene triggers apoptosis in colorectal cancer stem-like cells[J]. Pathol Oncol Res, 2016, 22(4):715-723.
STC-1 mediates proliferation and apoptosis of gastric cancer cells through Bcl-2
LIU Yi, DENG Hong, JIANG Yi-fan, LI Zong-lin, ZHAO Zheng-fei, XU Liang
(,,646300,)
To investigate the effect of stanniocalcin-1 (STC-1) on the proliferation and apoptosis of gastric cancer AGS cells and the role of Bcl-2 in these processes.The AGS cells were transfected with the plasmids for-knockdown or over-expression. The cell proliferation was measured by MTT assay and colony formation assay. The migration ability was detected by scratch assay. Apoptosis was analyzed by Hoechst 33342 staining and flow cytometry with annexin V-FITC/PI double staining. The protein expression of Bcl-2, survivin, caspase-3 and cleared caspase-3 was determined by Western blot. The mRNA expression levels of STC-1 and Bcl-2 in 20 cases of clinical gastric cancer tissues and adjacent tissues were detected by RT-qPCR, and the correlation between them was analyzed by Pearson method.After over-expression of STC-1, the proliferation and migration abilities of the AGS cells were increased, the expression of Bcl-2 and survivin was increased, while the expression of caspase-3 and cleared caspase-3 was decreased (<0.05). After knockdown of-, the proliferation and migration abilities of the AGS cells were decreased, the expression of Bcl-2 and survivin was decreased, while the expression of caspase-3 and cleared caspase-3 was increased (<0.05). The mRNA expression levels of STC-1 and Bcl-2 in the gastric cancer tissues were higher than those in the adjacent tissues. Pearson correlation analysis showed that there was a positive correlation between STC-1 and Bcl-2 mRNA expression in the cancer tissues (=0.308,=0.011).STC-1 may regulate the biological function of gastric cancer cells by altering the expression level of Bcl-2.
Stanniocalcin-1; Bcl-2 protein; Cell proliferation; Apoptosis; Gastric cancer
R735.2; R730.23
A
10.3969/j.issn.1000-4718.2020.11.012
1000-4718(2020)11-2005-08
2020-02-26
2020-04-27
四川省自筹经费科研基金资助项目(No. TUYR3875758)
Tel:0830-3165421;E-mail:rtfnpr@163. com
(责任编辑:宋延君,罗森)
