PD-L1与缺氧诱导的肺癌细胞自噬及增殖相关性的研究
2020-12-03刘辉杨小琼朱烟林何芋香刘杰谭渝
刘辉,杨小琼,朱烟林,何芋香,刘杰,谭渝
646000四川 泸州,西南医科大学附属医院 呼吸与危重症医学科
近年来,以程序性死亡受体相关配体(programmed death 1/programmed death-1 ligand 1,PD1/PD-L1)抑制剂为代表的免疫疗法在恶性肿瘤治疗方面取得突破性进展,提高了晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的客观缓解率[1]。既往研究多集中在单一免疫检测点通路,然而免疫相关不良反应的出现,肿瘤微环境本身的复杂性限制了PD1/PD-L1通路在免疫治疗中的研究进展[2]。有研究表明[3-5],在缺氧等应激状态下,肿瘤细胞内的溶酶体可对受损的细胞器及相关分子进行吞噬降解、再利用,即自噬,以此免受肿瘤微环境的负向影响,从而促进自身的存活。然而,肿瘤微环境尤其是缺氧微环境中,免疫检测点PD1/PD-L1在肿瘤细胞自噬相关通路中的影响机制尚未明确。本研究通过缺氧诱导H1299肺癌细胞自噬,同时给予一种特异性的磷脂酰肌醇三激酶(phosphatidylinositide 3-kinases,PI3K)自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)进行干预,观察缺氧诱导因子1α(hypoxia-inducible factor 1-alpha,HIF-1α)、自噬通路相关的微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ)、AKT和免疫检查点PD-L1的基因表达水平,以及细胞增殖情况,探讨PD-L1在肿瘤细胞自噬相关通路中的作用,为研究肺癌细胞药物耐受、逃避免疫系统攻击的机制,提供新的思路和方法。
1 材料与方法
1.1 试剂及器材
人肺腺癌细胞株H1299购自西南医科大学医学基础研究中心;缺氧培养箱(三通气培养箱,Thermo公司);CCK-8检测试剂盒购于碧云天生物技术有限公司; EntiLinkTM1st Strand cDNA Synthesis Kit购于ELK Biotechnology公司、一抗为单克隆兔抗人的HIF-1α购于abcam公司、兔抗人的LC3-II购于CST公司,二抗HRP-Goat anti Rabbit购于ASPEN公司。
1.2 实验分组及缺氧培养
实验设对照组(Normoxia)、缺氧组(Hypoxia)及缺氧+3-MA组(Hypoxia+3-MA)。细胞用10%胎牛血清的完全培养基,于37℃、5%CO2、21%O2常规培养箱中传代培养,根据后续实验的不同,分别接种于96孔板及60 mm培养皿中,换用无血清培养基培养12 h使细胞周期同步化。更换新鲜培养基后,对照组继续于常规培养箱培养,缺氧+3-MA组加入药物3-MA预处理5 min(通过查阅文献和前期预实验,选择最佳药物作用浓度5 mM),然后缺氧组及缺氧+3-MA组细胞同时置于37℃,1%O2,5%CO2,94%N2缺氧培养箱中培养12 h、24 h和48 h。
1.3 CCK-8测H1299细胞增殖活性
取对数生长期的H1299细胞,0.25%胰酶消化吹打,以10×104个/mL的细胞密度接种于96孔板中,每孔100 μL,设对照组、缺氧组及缺氧+3-MA组,每组3个复孔。缺氧+3-MA组加入药物3-MA(5 mM)预处理5 min。不同组在不同培养箱中培养,分别于12 h、24 h和48 h行CCK-8检测。每孔加入10 μL CCK-8试剂,孵育2 h,于450 nm处测定吸光值,以时间(h)为横坐标,OD450为纵坐标绘制增殖存活曲线。
1.4 Western blot检测HIF-1α及LC3-Ⅱ蛋白表达
取接种于60 mm培养皿中的H1299细胞,缺氧+3-MA组先加入3-MA(5 mM)预处理5 min,分别于12 h、24 h和48 h收集各组细胞。冰上预冷,磷酸盐缓冲溶液洗涤3次,加入蛋白提取试剂。BCA法测定蛋白浓度。12% SDS-PAGE,蛋白上样量为30 μg,恒压电泳。湿转法电转至PVDF膜,5%脱脂奶粉封闭1 h,单克隆兔抗人HIF-1α(1∶500)、LC3-II(1∶1 000)及β-actin(1∶10 000)孵膜,4℃过夜后,洗膜3次,加入辣根酶标记羊抗兔IgG二抗稀释液(1∶10 000),ECL混合液在室温下反应1 min后,进行曝光。最后应用Image J 软件进行图像分析。
1.5 荧光定量PCR检测PD-L1、LC3-II、AKT mRNA基因表达
收取各组在12 h、24 h和48 h的H1299肺癌细胞,加入TRI pure裂解液,充分裂解。将提取的mRNA通过EntiLinkTM1st Strand cDNA Synthesis Kit试剂盒获得cDNA。PD-L1、LC3-II、AKT相关引物序列信息见表1,实时荧光定量PCR,PCR反应条件为95℃ 3 min 预变性;95℃, 10 s→58℃,30 s→72℃,30 s,扩增40个循环。以 β-actin为内参,数据采用△△CT法定量分析扩增曲线及溶解曲线。
1.6 统计学分析
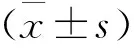
2 结 果
2.1 建立肺癌缺氧模型
本实验通过缺氧培养环境模拟缺氧微环境,以Western blot 检测HIF-1α的表达来验证模型。如图1所示,在常氧培养中,HIF-1α的蛋白表达较低,缺氧培养中,HIF-1α的蛋白表达明显增高, 缺氧组12 h、24 h和48 h蛋白表达水平分别为0.316±0.021、0.434±0.029及0.566±0.039,和对照组在不同时间相比,差异有统计学意义(P=0.001、P=0.002、P=0.007)。

图1 缺氧诱导因子HIF-1α在常氧及缺氧环境中不同时间点的表达水平Figure 1. Expression of HIF-1α in Normoxic and Hypoxic Environments at Different Time Points (*P=0.001, **P<0.05)A: Protein expression at different time points in hypoxia and normoxia groups by Western blot; B: Protein expression levels at different time points between the hypoxia group and the normoxia group.HIF-1α: Hypoxia-inducible factor 1-alpha.
2.2 CCK-8检测H1299肺癌细胞增殖活性
如图2所示,CCK-8检测对照组、缺氧组、缺氧+3-MA组在分别培养12 h时,OD450值为:0.536±0.013、0.473±0.014和0.356±0.009;24 h的OD450值分别为:0.623±0.004、0.782±0.007和0.506±0.006;48 h的OD450值分别为:0.686±0.005、0.982±0.010和0.577±0.004。在12 h时,缺氧组表达量较对照组降低,两者的差异有统计学意义(P=0.001),缺氧+3-MA组表达量较缺氧组降低,两者的差异有统计学意义(P=0.005);在24 h时,缺氧组表达量较对照组明显增高,差异有统计学意义(P=0.020),缺氧+3-MA组较缺氧组明显降低,两者差异有统计学意义(P=0.001);在48 h时,缺氧组表达量亦较对照组明显增高,差异有统计学意义(P=0.010),缺氧+3-MA组亦较缺氧组明显降低,两者差异有统计学意义(P=0.003)。

图2 缺氧和自噬抑制剂3-MA在不同时间对H1299肺癌细胞增殖活性的影响Figure 2. Effects of Hypoxia and Autophagy Inhibitor 3-MA on the Proliferation of H1299 Lung Cancer Cells at Different Time3-MA: 3-Methyladenine.
2.3 Western Blot检测自噬相关通路蛋白LC3-II表达水平
如图3所示,随着常氧培养及缺氧时间的延长(12~48 h),LC3-II表达量逐渐升高,并呈时间依赖性。和对照组相比,缺氧组在3个作用时间点的LC3-II表达量明显增加,差异有统计学意义(P=0.046、P=0.001、P=0.023)。和缺氧组相比,缺氧+3-MA组在3个时间点的LC3-II表达量明显降低,差异亦有统计学意义(P=0.016、P=0.001、P=0.045)。

图3 缺氧和3-MA在不同时间对H1299肺癌细胞自噬相关通路蛋白LC3-II表达水平的影响Figure 3. Effects of Hypoxia and 3-MA on the Expression of Autophagy-Related Protein LC3-II in H1299 Lung Cancer Cells at Different TimesA: Protein expression levels by group at different time points detected by Westernblot; B: Protein expression levels by group at different time points.Compared to the normoxia group, *P < 0.05, **P = 0.001; compared to the hypoxia group, +P < 0.05, ++P = 0.001.LC3-II: Microtubule-associated protein 1 light chain 3-II.
2.4 不同时间点检测H1299细胞中PD-L1基因mRNA表达水平
通过荧光定量PCR检测对照组、缺氧组、缺氧+3-MA组的PD-L1基因表达水平,12 h分别为:1.04±0.04、1.87±0.19、1.48±0.06;24 h分别为:1.21±0.07、2.77±0.11、2.33±0.18;48 h分别为:1.72±0.12、3.64±0.29、3.00±0.04。如图4所示,在12 h时,缺氧组的PD-L1基因mRNA表达量较对照组高,两者差异有统计学意义(P=0.004),缺氧+3-MA组和缺氧组相比有所降低,但差异无统计学意义(P=0.067);24 h时,PD-L1表达量缺氧组较对照组明显增高,两者差异有统计学意义(P=0.001), 缺氧+3-MA组较缺氧组明显降低,差异亦有统计学意义(P=0.012);在48 h时,缺氧组的PD-L1 mRNA表达水平较对照组明显增高,两者差异有统计学意义(P=0.032), 缺氧+3-MA组较缺氧组有所降低,差异亦有统计学意义(P=0.011)。

图4 缺氧和自噬抑制剂3-MA在不同时间对H1299肺癌细胞PD-L1mRNA基因表达水平的影响Figure 4. Effects of Hypoxia and Autophagy Inhibitor 3-MA on the Expression of PD-L1mRNA in H1299 Lung Cancer Cells at Different TimeCompared to the normoxia group, *P < 0.05, **P = 0.001; compared to the hypoxia group, +P < 0.05.PD-L1: Program death-1 ligand 1.
2.5 同一时间点各组间PD-L1、LC3-II、AKT基因mRNA表达水平的比较
我们通过荧光定量PCR检测不同时间点(12~48 h)PD-L1、LC3-II、AKT基因mRNA表达水平,发现48 h三者的表达水平均最高,故选此时三者基因表达量进行组间差异性比较。对照组分别为:1.00±0.09、0.90±0.10和1.12±0.12;缺氧组分别为:2.78±0.16、2.14±0.17和2.03±0.04;缺氧+3-MA组分别为:2.05±0.14、1.68±0.08和1.98±0.07。如表2所示,Hypoxia组的PD-L1基因mRNA表达水平较Normoxia组增高,差异有统计学意义(P<0.05),Hypoxia+3-MA组较Hypoxia组显著降低,差异有统计学意义(P<0.001);Hypoxia组的LC3-II基因表达水平较Normoxia组明显增高,差异有统计学意义(P<0.05),Hypoxia+3-MA组较Hypoxia组显著降低,差异亦有统计学意义(P<0.001);Hypoxia组的AKT基因mRNA表达量较Normoxia组显著增高,差异亦有统计学意义(P<0.05),Hypoxia+3-MA组较Hypoxia组有所降低,但差异无统计学意义(P>0.05)。

表2 PD-L1、LC3-II和AKT基因水平的比较Table 2. Expression Levels of PD-L1, LC3-II and AKT Genes
3 讨 论
免疫治疗在NSCLC中是继靶向治疗后又一突破性治疗手段,极大提高了广泛期NSCLC治疗成功率。近来发现的PD-L1因其在肿瘤组织上广泛表达且参与肿瘤的发展,已成为免疫学和肿瘤学的研究热点[6]。目前,驱动基因阴性的晚期NSCLC患者, 推荐PD1/PD-L1抑制剂联合化疗药物作为一线治疗选择方案,并写入美国国立综合癌症网络指南[7]。既往研究表明,PD-L1与表达于T细胞表面的抑制性受体PD1结合,对免疫T细胞的激活具有负向调控作用[8-10]。PD1/PD-L1抑制剂通过封闭免疫检查点PD1/PD-L1,从而特异性激活免疫系统,发挥肿瘤免疫杀伤作用。然而,随着单一或联合PD1/PD-L1抑制剂在越来越多的肺癌患者中得到应用,其免疫相关不良反应和影响治疗的因素也越来越受到人们的关注[11]。
HIF-1α被认为是低氧条件下产生的主要标记分子,在常氧环境,HIF-1α常被蛋白酶降解而不稳定[12-13],我们通过模拟缺氧微环境,Western blot检测HIF-1α表达水平进行模型评估,从而构建稳定的肿瘤缺氧微环境模型,保证后续实验的准确性和延续性。本研究通过缺氧诱导肺癌细胞自噬,检测相关通路蛋白及基因水平的表达,发现缺氧可促进肿瘤细胞自噬相关通路蛋白的表达及细胞增殖活性的增加,且这个过程可被PI3K抑制剂3-MA所抑制,PD-L1与肺癌细胞自噬及细胞增殖水平的变化有明显的相关性。随着对肿瘤细胞自噬研究的深入,缺氧微环境中,免疫检测点PD-L1与肺癌细胞自噬逐渐被认识。
既往研究发现,肿瘤细胞与肿瘤微环境可以相互影响,肿瘤细胞可以重塑肿瘤微环境,微环境反之能进一步影响肿瘤细胞的行为和状态。 其中缺氧是肿瘤微环境最明显的特征之一,缺氧微环境能够诱导肿瘤细胞中与自噬、增殖、分化、 侵袭转移及免疫耐受等相关癌基因的表达,来维持癌细胞生长和转移、免疫逃逸等恶性表型[14]。其中自噬是普遍存在于大部分真核细胞中的一种保守的分解代谢过程,对于肿瘤细胞而言,自噬的形成过程极其复杂,包括:自噬体的形成、降解、再利用的过程,自噬体的形成为其核心[15-16],多种自噬相关基因参与其中。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是最重要的自噬相关通路蛋白之一,LC3前体形成后,在胞浆中加工成可溶性形式微管相关蛋白1轻链3-I(microtubule-associated protein 1 light chain 3-I,LC3-I),随后被修饰成膜结合形式的LC3-II蛋白,并定位于自噬前体和自噬体膜上,使之成为自噬体的标志分子。溶酶体和自噬体融合成自噬溶酶体后,自噬体内的LC3-II可被溶酶体中的水解酶降解,LC3-lI含量的多少与自噬体数量成正相关。与此同时,微管相关蛋白在自噬相关泛素化途径,如ATG12-ATG5-ATG16L的修饰过程中起重要作用,通过检测LC3-II蛋白表达情况,可初步反映自噬水平[17-18]。
PI3K是细胞内一种重要的信号转导分子,激活后可使蛋白激酶AKT获得催化活性,进而激活或抑制下游的靶向蛋白,如NF-κB、mTOR、Bc1-2家族、E2F、Caspase-9、p53和S6蛋白激酶等,进而发挥一系列生物学活性[19]。3-MA为一种特异性的PI3K抑制剂,研究发现,自噬的激活过程需依赖PI3K[20],该抑制剂可通过阻碍Beclin-1-PtdIns3KC3相关复合物的形成,而抑制可溶性形式LC3-I向膜结合形式LC3-Ⅱ转化。其广泛参与了自噬小体的形成与发展,在抑制自噬相关通路中起到及其重要的作用,被普遍用于自噬相关通路研究。上述实验发现,缺氧组AKT、LC3-II、PD-L1在基因表达水平较对照组明显升高,加入自噬抑制剂(3-MA)后,三者的表达水平均降低。可见,缺氧可同时上调自噬相关通路蛋白AKT、LC3-II及PD-L1表达,而这个过程可被特异性的PI3K抑制剂3-MA所抑制,PD-L1随着AKT、LC3-II基因水平的变化而变化,表明PD-L1可能参与了肺癌细胞自噬相关通路的表达,推测可能与PI3K/AKT通路有关。上述研究表明,LC3-II及PD-L1与H1299肺癌细胞增殖活性密切相关。在实验12 h时,可见缺氧组H1299肺癌细胞增殖活性较常氧组低,随着缺氧培养时间的延长(12~48 h),肺癌细胞的增殖活性逐渐增强。通过上述实验结果推测,缺氧早期自噬水平较低,肺癌细胞抵御外界环境的能力较差,甚至早期自噬可能抑制肺癌细胞增殖,可能为12 h细胞增殖降低的原因之一,但随着肿瘤微环境的逐渐恶化,肿瘤细胞逐渐调整策略,可能通过激活PI3K/AKT自噬相关通路,上调PD-L1及LC3-II蛋白的表达,增强肺癌细胞自噬水平,从而逃避恶劣的肿瘤微环境的影响,最终使得自身得以生存。目前发现PD-L1可能参与了PI3K/AKT自噬相关通路表达,但免疫检查点、缺氧微环境与肿瘤细胞自噬水平之间仍有许多问题亟待解决,PD1/PD-L1本身的免疫负调控通路和肿瘤细胞自噬相关通路是否存在其它交叉反应,以及缺氧微环境会不会影响免疫检查点和自噬的其它通路,都需要进一步探究。该实验是通过缺氧的培养环境模拟肿瘤细胞的缺氧微环境,和体内实际的缺氧微环境有一定区别,接下来我们的工作,是研究PD1/PD-L1抑制剂在动物体内缺氧微环境中对自噬水平的影响机制,通过缺氧微环境、自噬与免疫检查点相关研究,探索一种联合治疗的策略,进一步提高人体肿瘤免疫治疗的效果。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
