利拉鲁肽通过自噬及改善氧化应激缓解大鼠糖皮质激素性骨质疏松
2020-12-03杨丽娜丁庭庭潘天荣
杨 婧,杨丽娜,丁庭庭,钟 兴,潘天荣
糖皮质激素性骨质疏松(glucocortieoid-induce osteoporosis,GIOP)作为最常见的继发性骨质疏松类型,在长期接受糖皮质激素(glucocorticoid,GC)治疗的患者中发病率高达30%~50%,已成为一个十分严峻的全球健康问题[1]。胰高血糖素样肽-1(glucagonlike peptide-1,GLP-1)是肠促胰素的一种,近年来一些研究显示,它不但能够作用于胰脏,与骨代谢也密切相关[2]。其类似物利拉鲁肽对骨骼有正性作用,但是具体机制尚不明确[3]。该研究建立GIOP大鼠模型,使用利拉鲁肽进行干预,通过分析骨密度(bone mineral density,BMD)、骨微结构、自噬(autophagy)及氧化应激(oxidative stress,OS)水平的变化,探讨利拉鲁肽对GIOP的影响,并初步讨论其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 8周龄雄性SD大鼠30只,体质量(220±10) g,由安徽省实验动物中心提供。饲养环境:标准鼠笼分笼饲养,每笼5只,温度(23.0±2.0)℃,湿度(55±5)%,光照时间7:00~19:00,通风环境良好,每周更换2次墊料,每12 h添加饲料及水1次,不限制大鼠摄食及饮水。
1.1.2主要药物、器材与试剂 地塞米松(石药银湖制药有限公司);利拉鲁肽(丹麦诺和诺德公司);活性氧(reactive oxygen species,ROS) 测定试剂盒、丙二醛(malonaldehyde, MDA) 测定试剂盒及超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(万类生物公司) ;Beclin-1抗体、Atg5抗体、LC3B抗体、p62/SQSTM1W抗体及β-actin(碧云天生物公司);Micro-CT(美国通用公司)。
1.2 实验方法
1.2.1实验动物分组及模型的建立 所有雄性SD大鼠适应性喂养1周后,采用数字表法随机平均分为地塞米松组(DXM组)、地塞米松加利拉鲁肽干预组(DXM+Lira组)及正常对照组(CON组),每组各10只,全程药物干预12周,具体方式如下:① CON组:给予0.1 ml生理盐水每日肌肉注射;② DXM组:按照1 mg/kg剂量配置成0.1 ml地塞米松溶液每周2次肌肉注射;③ DXM+Lira组: 在相同剂量及频率地塞米松溶液注射的同时,给予利拉鲁肽200 μg/kg剂量每日皮下注射。每周定时对所有大鼠进行体质量测定,并根据其数值变化相应地调整药物的使用剂量。
1.2.2样本收集 于实验12周末,使用10%水合氯醛(3.5 ml/kg)腹腔注射麻醉大鼠,心房放血处死大鼠后收集双侧股骨,剔除全部附着肌肉、软组织及骨髓,包裹生理盐水纱布置于-20 ℃冰箱备用。
1.2.3Micro-CT检测BMD、骨微结构 将左侧股骨室温下解冻后固定于样品固定器内,以15 μm的分辨率行Micro-CT扫描并行组织结构重建。得到重建图像后,使用自带软件定量分析得到BMD、骨小梁体积比率(bone volume/tissue volume,BV/TV)、骨小梁数量(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁间距(trabecular separation,Tb.Sp)和骨小梁连接密度(connectivity density, Conn.D)参数。
1.2.4试剂盒检测骨组织氧化应激指标 取大鼠右侧股骨远端骨组织,放入液氮中反复研磨直至粉末状,加入PBS后使用1 000g离心10 min收集上清液,按照说明书使用试剂盒测定ROS、SOD及MDA含量。
1.2.5蛋白免疫印迹(Western blot)分析自噬相关蛋白表达 取大鼠股骨远端骨组织粉末,使用Western及IP细胞裂解液提取干骺端总蛋白,转移至PVDF膜上后与特异性抗体孵育,曝光显影后通过灰度分析Beclin-1、Atg5、p62/SQSTM1W及Map1-LC3-Ⅱ的表达水平。
2 结果
2.1 骨组织Micro-CT分析Micro-CT下股骨骨形态计量学结果显示,与CON组比较,DXM组大鼠BMD降低,BV/TV下降,Tb.N减少,Tb.Th变薄,Tb.Sp增宽,连接变差,差异有统计学意义(P<0.05);而在利拉鲁肽干预下,DXM+Lira组较DXM组BMD增加,骨小梁变多变粗变密,连接改善,差异有统计学意义(P<0.05)。见表1。
2.2 骨组织氧化应激水平变化与CON组比较,DXM组大鼠骨组织氧化应激产物ROS和MDA水平增加,抗氧化酶SOD水平下降,差异有统计学意义(P<0.05);与DXM组比较,DXM+Lira组大鼠骨组织ROS和MDA水平下降,SOD水平上升,差异均有统计学意义(P<0.05)。见表2 。
2.3 骨组织自噬水平变化与CON组比较,DXM组大鼠股骨远端骨组织自噬相关蛋白Beclin-1、Atg5及Map1-LC3-Ⅱ表达水平上升,p62/SQSTM1W蛋白表达水平略有下降,差异有统计学意义(P<0.05)。与DXM组比较,DXM+Lira组Beclin-1、Atg5及Map1-LC3-Ⅱ的蛋白表达水平下降,p62/SQSTM1W蛋白表达水平略有上升,差异有统计学意义(P<0.05)。见图1。
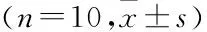
表1 鼠左侧股骨Micro-CT结果
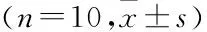
表2 股骨组织中氧化应激指标变化
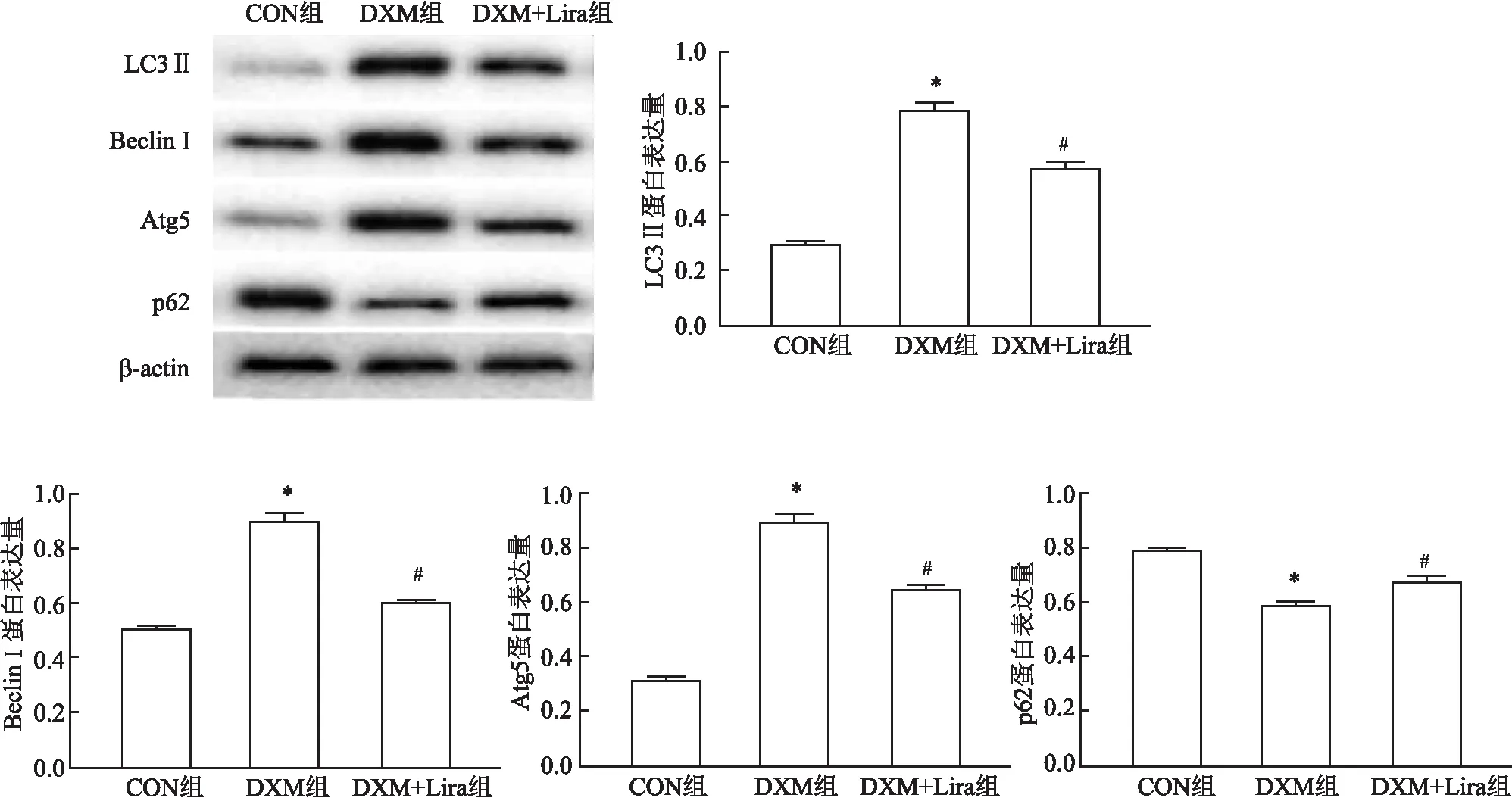
图1 大鼠骨组织Beclin-1、Atg5、p62 及LC3 Ⅱ的蛋白表达变化与CON组比较:*P<0.05;与DXM组比较:#P<0.05
3 讨论
利拉鲁肽是一种利用酵母生产的人工合成长效GLP-1类似物,与天然GLP-1具有97%的序列同源性,可通过多种方式作用于骨骼并具有保护作用[4]。Mansur et al[5]发现,在GIOP小鼠模型中,利拉鲁肽可以预防骨丢失,延缓骨质疏松进程。另有研究[6]表明,利拉鲁肽对于绝经后骨质疏松小鼠模型也有增加BMD,改善骨结构等作用。本研究及前期研究[7]结果与其一致,经Micro-CT扫描,DXM组的大鼠较CON组BMD下降,BV/TV、Tb.N、Tb.Th、Conn.D下降,提示骨小梁变少变疏变细,骨质疏松模型造模成功。在利拉鲁肽干预下,与DXM组比较,大鼠BMD增加,Tb.Th、Conn.D增加,提示骨小梁微结构得到改善,说明利拉鲁肽可以增加BMD、防止骨微结构的破坏,对GIOP具有一定的改善作用。
氧化应激反应可以抑制成骨细胞分化并促进其凋亡,诱导破骨前体细胞的增殖分化并提高其活性,对维持骨代谢平衡十分重要[8]。在高剂量糖皮质激素诱导下,机体内产生的自由基水平高于细胞的抗氧化防御能力,过量的活性氧ROS存在于组织或细胞内将诱发氧化应激反应,并直接或间接导致氧化损伤。动物实验表明[9],相较对照组,GIOP家兔模型的BMD下降,血清自由基水平升高,抗氧化酶活性降低,当注射抗氧化剂干预后,可有效地逆转上述改变。本研究结果与之相符,与CON组比较,DXM组大鼠骨组织氧化应激产物ROS、MDA水平均上升,抗氧化酶SOD水平下降,说明大鼠氧化应激水平升高,且出现了骨质疏松,其可能原因是地塞米松引起了氧化应激损伤从而导致了骨代谢失衡。在利拉鲁肽干预下,相较于DXM组,大鼠氧化应激产物ROS、MDA水平均下降,抗氧化酶SOD水平上升,且BMD及骨微结构指标好转,提示利拉鲁肽可能通过改善氧化应激缓解大鼠GIOP的程度。
自噬对骨代谢及其相关重要细胞也有重要影响,适度的自噬可以使骨细胞保持功能,但是过度的自噬则会激活调亡或转换为自噬性死亡导致骨代谢紊乱[10]。有研究[11]表明低剂量的GC可以诱导骨细胞自噬,具有保护作用;高剂量的GC会引起成骨细胞的凋亡,从而导致骨强度下降。本研究结果与之符合,DXM组大鼠较CON组自噬相关基因Beclin-1、Atg5及Map1-LC3-Ⅱ蛋白表达水平均升高,p62/SQSTM1W蛋白表达水平略有下降,并伴BMD下降,骨微结构破坏。相较于DXM组,利拉鲁肽干预组自噬相关蛋白Beclin-1、Atg5及Map1-LC3-Ⅱ的表达水平下降,p62/SQSTM1W蛋白表达水平略有上升,且大鼠BMD增加,骨微结构改善,提示利拉鲁肽可能通过调整自噬水平,改善大鼠BMD与骨微结构。
氧化应激反应与自噬对于骨代谢都十分重要,并且这两者关系密切,互相作用。一方面,氧化应激的主要产物ROS可以通过多种机制促进自噬[12]。在自噬的诱导阶段中,过量的ROS可以抑制PI3K-Akt-mTOR从而激活自噬。在自噬体形成过程中,ROS可以通过抑制Atg4的活性引起LC3-Ⅱ堆积,使得自噬体增多从而促进自噬。在饥饿条件下,细胞内产生的大量ROS可以氧化Atg4抑制LC3-Ⅱ去脂化从而保证自噬体延伸。ROS还能促进待降解物质的泛素化修饰,使待降解物与p62 及LC3-Ⅱ泛素化结合从而易于被自噬。另一方面,自噬可以抑制氧化应激及其造成的损伤[13]。作为氧化应激的直接引物,约90%的ROS产生于线粒体内膜呼吸链,持久严重的氧化应激将造成线粒体损伤从而产生更多的ROS。通过清除损伤的线粒体,自噬可以直接调控ROS水平。实验[14]表明,用脂多糖刺激心肌细胞会产生大量ROS继而损伤线粒体,通过线粒体自噬则能及时清除受损线粒体并降低ROS水平。此外,自噬还可以通过修复损伤的DNA以避免氧化应激造成的细胞死亡。有研究[15]表明,敲除自噬相关基因Beclin-1、Atg5及Atg7将导致DNA损伤累积,加速细胞死亡。
氧化应激对于自噬的调节功能呈现两面性,自噬对于骨代谢也存在双重影响。少量的ROS可以激活自噬,通过抑制氧化应激损伤自噬可以减少成骨细胞凋亡,大量的ROS则会导致过度自噬,从而激活凋亡或者转换为自噬性死亡。因而在本研究中,DXM组自噬水平增高,但是并未通过提高自噬水平阻止BMD下降及骨微结构破坏,其可能原因是大剂量的地塞米松引起了氧化应激损伤并直接导致了骨代谢的失衡,氧化应激反应中产生的过量活性氧ROS又引起了过度自噬诱发成骨细胞凋亡从而进一步加剧了骨质疏松。在利拉鲁肽干预下,大鼠骨组织内活性氧ROS以及脂质过氧化代谢产物MDA的表达减少,抗氧化酶SOD的活性增加,部分自噬相关蛋白表达降低,BMD及骨微结构改善,提示利拉鲁肽可能是通过改善氧化应激水平并调整细胞自噬,从而起到缓解骨质疏松作用。
综上所述,利拉鲁肽改善由GC诱导的大鼠骨质疏松,推测其可能与改善氧化应激和调节自噬有关,但确切的作用机制还需进一步研究深入探讨。
