PCT、WBC、NEU%对新生儿肺炎的诊疗价值
2020-12-02金华强秦莲李翔张莹
金华强 秦莲 李翔 张莹
摘要:目的 探讨降钙素原(PCT)、白细胞计数(WBC)、中性粒细胞比例(NEU%)对新生儿肺炎的诊疗价值。方法 选取2018年4月至2019年3月祥云县人民医院收治的144例新生儿肺炎患者,以114例同期健康新生儿为对照组,观察PCT、WBC、NEU%在两组之间的差异,以及新生儿肺炎组治疗前后的差异。结果 与对照组比较,肺炎组PCT、WBC、NEU%的水平显著升高,差异有统计学意义(P0.01);肺炎组PCT、WBC、NEU%的阳性率显著大于对照组(P0.01)。治疗后肺炎组WBC、NEU%、PCT较治疗前均有明显降低(P0.01)。治疗前肺炎组患儿PCT水平与NEU%呈正相关(P0.01),与WBC无相关性(P>0.05)。结论 PCT作为一种已有的诊断工具,有望成为临床指导用药以及疗效评价的可靠指标。
关键词:降钙素原;白细胞计数;中性粒细胞比例;新生儿肺炎
【中图分类号】R722.13 【文献标识码】B 【文章编号】1673-9026(2020)04-001-03
新生儿肺炎是新生儿常见病,根据病因分为新生儿吸入性肺炎和新生儿感染性肺炎,可发生在产前、产时以及产后。由于新生儿呼吸系统功能尚不成熟,以及免疫力较低下,如不及时诊治,易诱发呼吸衰竭、心力衰竭、败血症等,是导致新生儿死亡的第二大原因[1]。因此,临床上快速、敏感的检测指标对于肺炎患儿的早期诊断和疗效评价十分重要。降钙素原(PCT)是无激素活性降钙素前肽物质,正常情况下人血清中PCT浓度极低,几乎不被检测到,当机体发生感染、脓毒症和脏器衰竭时,在细菌毒素和炎症因子的刺激下3~4h开始升高,12~48h达到峰值,2~3d后恢复正常[2,3]。本研究通过检测肺炎新生儿的PCT、白细胞计数(WBC)、中性粒细胞比例(NEU%)的水平,探讨PCT在新生儿肺炎中的诊断和治疗中的价值。
1 资料与方法
1.1一般资料
选取2018年4月至2019年3月祥云县人民医院收治的144例新生儿肺炎患儿,以114例同期健康新生儿为对照组。
1.2方法
WBC和NEU%测定仪器为日本光电血球仪MEK641,仪器和试剂均购自日本光电公司,PCT测定仪器为南京基蛋Getein1600,仪器和试剂均购自南京基蛋公司。所有患者于入院24h内采集空腹静脉血,30min内完成检测。正常参考值如下:WBC (4~10)109/L;NEU% 50%~70%;PCT 0~0.5 ng/mL。
1.3 统计学处理
采用SPSS22.0统计学软件进行分析,计数资料以例数(n)或百分率(%)表示,组间比较采用x2检验。计量资料以均数±标准差()表示,组间比较采用t检验。以P0.05为差异具有统计学意义。
2 结果
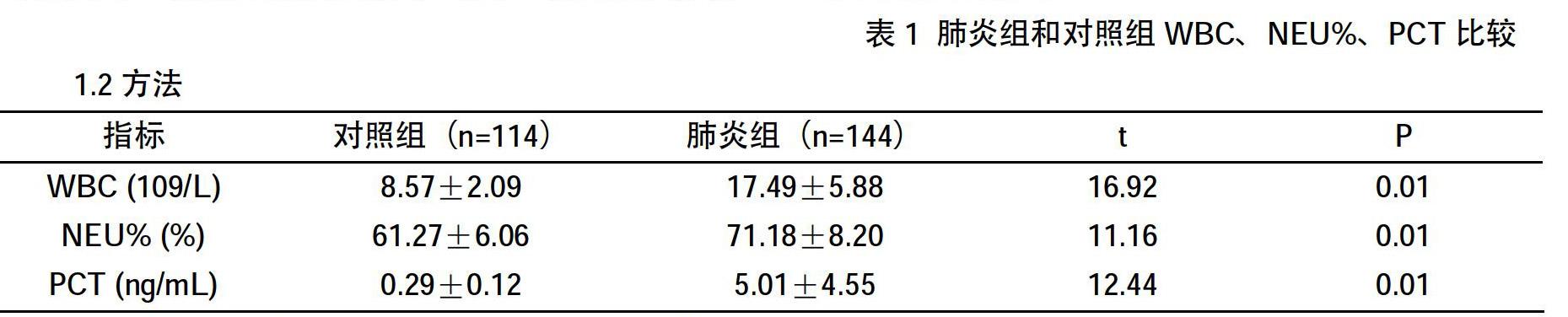
2.1 肺炎组和对照组WBC、NEU%、PCT比较
对照组WBC、NEU%、PCT分别为(8.57±2.09)109/L、(61.27±6.06)%、(0.28±0.12)ng/mL,肺炎组WBC、NEU%、PCT分别为(17.49±5.88)109/L、(71.18±8.20)%、(5.01±4.55)ng/mL,肺炎组3个指标水平均显著高于对照组,差异均有统计学意义(P0.01),见表1。
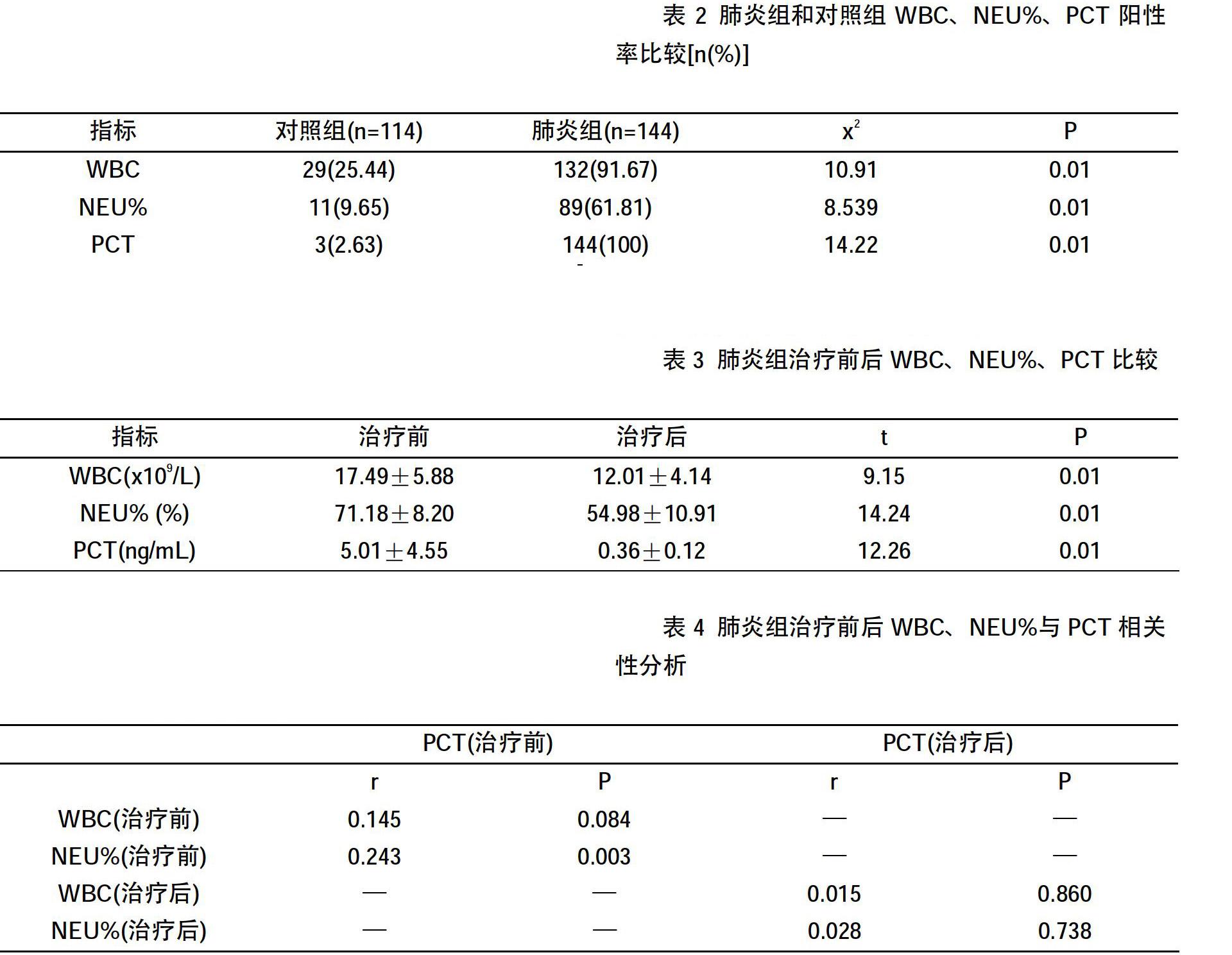
2.2 肺炎组和对照组WBC、NEU%、PCT阳性率比较
对照组WBC、NEU%、PCT的阳性率分别为25.44%、9.65%、2.63%,肺炎组患儿WBC、NEU%、PCT的阳性率分别为91.67%、61.81%、100%,肺炎组3个指标的阳性率显著大于对照组(P0.01),见表2。
2.3 肺炎组治疗前后WBC、NEU%、PCT比较
肺炎组治疗前WBC、NEU%、PCT分别为(17.49±5.88)109/L、(71.18±8.20)%、(5.01±4.55)ng/mL,治疗后WBC、NEU%、PCT分别为(12.01±4.14)109/L、(54.98±10.91)%、(0.36±0.12)ng/mL,治疗后 3个指标均显著低于治疗前(P0.01),见表3。
2.4 肺炎组WBC、NEU%与PCT水平的关系
Spearman相关性分析显示,治疗前肺炎组患儿PCT水平与NEU%呈正相关(r=0.243,P0.01),与WBC无相关性(P>0.05),治疗后肺炎组患儿PCT水平与WBC和NEU%均无相关性(P>0.05),见表4。
3 讨论
新生儿肺炎临床症状不显著,与其他呼吸系统疾病症状相似,且易受围产期并发症的影响,临床上容易造成误诊或漏诊[4]。目前主要通过细菌培养的方式进行确诊,但因其耗时较久,难以尽早明确诊断。因此寻找快速敏感的诊断指标,将有助于临床医师及时使用抗生素以控制病情[5]。
目前国内常见的感染性指标包括PCT、C反应蛋白(CRP)、血清淀粉样蛋白A(SAA)、白细胞介素6(IL-6)等。本研究显示新生儿肺炎组患儿的PCT、WBC和NEU%显著高于健康新生儿对照组,且这三个指标的阳性率也高于对照组。较多研究表明在新生儿肺炎早期诊断的价值方面,PCT明显提高了新生儿肺炎的诊断率,其敏感性和特异性高于hs-CRP和IL-6[6-8],另有其他文献指出PCT对于新生儿细菌感染敏感性最高,而SAA对于病毒感染敏感性最高[9,10]。Bian等[11]发现相比较CRP和IL-6,PCT在反映新生儿的感染程度方面具有较高的诊断价值,且PCT与IL-6呈正相关关系。本研究的结果与上述的文献一致,肺炎组患儿PCT水平与NEU%呈正相关,但与WBC无相关性。对于新生儿,如果没有其他原因能够解释PCT水平超过0.5 ng/mL的界限,往往认为存在感染或者炎癥反应[12]。杨青原等[13]的研究显示诊断新生儿肺炎时,以PCT>1.0 ng/mL为界限值时的灵敏度和特异性高于以PCT>0.5 ng/mL为界限值。
Falcao Goncalves等[14]提出一种依据PCT水平制定的诊治策略,PCT<0.1 ng/mL不需要微生物学检测,>0.1 ng/mL需要微生物学检测,>1.0 ng/mL表明存在细菌感染,这种由PCT指导的演算法减少了将近50%的抗生素治疗。一项针对不同类型呼吸道感染患者由PCT指导的抗生素治疗算法的meta分析研究中指出,建议/强烈建议停止抗生素治疗的PCT cut-off值分别为,门诊和急诊肺炎患者0.25/ 0.1 ng/mL,ICU患者0.5/ 0.25 ng/mL,脓毒症患者减少量超过峰值的80%[15]。一项针对中国某医院16405名呼吸道感染患者的队列研究显示,相比较通常的治疗方案,基于PCT制定的治疗方案使住院病人节约72万元,使门诊病人节约240万元,大大减少了不必要的抗生素使用[16]。Kordek等[17]指出给予产妇抗生素用药并不会降低早发型感染的新生儿血液中PCT的水平。Liang等[18]的研究显示在出生24小时内的新生儿肺炎组,由PCT指导的抗生素治疗平均时间为4.0天,而标准对照组的抗生素治疗平均时间为4.9天,PCT可帮助临床医生决定何时停止抗生素治疗。
PCT不仅作为一种已有的诊断工具,也有望成为临床指导抗生素使用以及疗效评价的可靠指标,大大减少患儿的费用,降低耐药菌株的产生。本研究所选标本量较少,后期可通过加大标本量以及增加分析项目来进行深入研究。
参考文献
[1] 左霞. 降钙素原和白细胞介素6在新生儿肺炎早期诊断中的价值[J]. 山西职工医学院学报, 2019, 26(13): 73-74.
[2] Aloisio E, Dolci A, Panteghini M. Procalcitonin: Between evidence and critical issues[J]. Clin Chim Acta, 2019, 496: 7-12.
[3] Memar MY, Varshochi M, Shokouhi B, et al. Procalcitonin: the marker of pediatric bacterial infection[J]. Biomed Pharmacother, 2017, 96(): 936-943.
[4] 秦道建, 唐宗生, 陈淑丽, 等. 中性粒细胞CD64和降钙素原联合检测在新生儿细菌感染早期诊断中的价值[J]. 中国当代儿科杂志, 2017, 19(8): 872-876.
[5] 杨芳芳, 王阜蕾. 血清降钙素原含量检测对新生儿肺炎的早期诊断价值及其与血小板参数、心肌损伤的相关性[J]. 中国妇幼保健, 2019, 34(1): 116-118.
[6] 芦娟, 陈渊博. 新生儿肺炎患儿的早期诊治中血清IL-6与PCT的临床检测意义[J]. 首都食品与医药, 2019, 26(13): 73-74.
[7] Niu T, Liu Y, Zhu F, et al. Time-resolved fluorescent immunoassay-based combined detection of procalcitonin, C-reactive protein, heparin binding protein, and serum amyloid A1 to improve the diagnostic accuracy of early infection[J]. J Clin Lab Anal, 2019, 33(2): e22694.
[8] Li YL, Zhai LC, Ji JH, et al. Detection of combined procalcitonin and c-reactive protein applied in the diagnosis of bacterial infections[J]. J Biol Regul Homeost Agents, 2017, 31(1): 177-181.
[9] 管建. 血清淀粉樣蛋白A、降钙素原、C反应蛋白联合检测在新生儿感染中的应用价值[J]. 黑龙江医学, 2018, 42(8): 819-820.
[10] 胡爱星, 李情操. 血清淀粉样蛋白A、C反应蛋白和降钙素原联合检测在新生儿感染诊断中的应用[J]. 上海预防医学, 2019, 31(5): 413-416.
[11] Bian F, Wu YE, Zhang CL. Variation in the levels of IL-6 in pediatric patients with severe bacterial infectious diseases and correlation analysis between the levels of IL-6 and procalcitonin[J]. Exp Ther Med, 2017, 13(6): 3484-3488.
[12] Lee J, Bang YH, Lee EH, et al. The influencing factors on procalcitonin values in newborns with noninfectious conditions during the first week of life[J]. Korean J Pediatr, 2017, 60(1): 10-16.
[13] 杨青原, 符珍珠, 陈连凤. 血清PCT、IL-6和hs-CRP早期诊断新生儿肺炎的临床价值研究[J]. 中国煤炭工业医学杂志, 2019, 22(2): 140-145.
[14] Falcao Goncalves P, Menezes Falcao L, Duque Pinheiro I. Procalcitonin as Biomarker of Infection: Implications for Evaluation and Treatment[J]. Am J Ther, 2017, 24(3): e243-e249.
[15] Schuetz P, Bolliger R, Merker M, et al. Procalcitonin-guided antibiotic therapy algorithms for different types of acute respiratory infections based on previous trials[J]. Expert Rev Anti Infect Ther, 2018, 16(7): 555-564.
[16] Stojanovic I, Schneider JE, Wei L, et al. Economic evaluation of procalcitonin-guided antibiotic therapy in acute respiratory infections: a Chinese hospital system perspective[J]. Clin Chem Lab Med, 2017, 55(4): 561-570.
[17] Kordek A, Torbe A, Tousty J, et al. The determination of procalcitonin concentration in early-onset neonatal infection [J]. Clin Pediatr, 2017, 56(4): 333-340.
[18] Liang JW, Wang LL, Zhou W, et al. Value of Procalcitonin in Neonatal Infection within 24 Hours after Birth: a Retrospective Cohort Study[J]. Clin Lab, 2019, 65(7): 181212..
