生态湿地中抗生素抗性基因的污染控制研究*
2020-12-02周振超商卫纯
郑 吉 郭 莉 刘 扬 周振超 陈 红 商卫纯
(1.宁波市生态环境科学研究院,浙江 宁波 315012;2.浙江大学环境与资源学院,浙江 杭州 310058)
生态湿地是通过人工模拟自然湿地的结构和功能而设计和建造的湿地,主要由基质、植物、微生物等组成,它充分利用物理、化学和生物的三重协同作用,通过过滤、吸附、沉淀、离子交换、植物吸收和微生物分解等作用来实现对污水的高效净化[1]。不同类型的生态湿地对不同污染物的处理能力存在较明显差异,因此能够有针对性地处理不同污染物[2-3]。近年来纳米材料、个人护理产品、抗生素抗性基因(ARGs)等新型污染物在水体中不断被检出。这些新型污染物虽然并没被列为水质监测指标,但是已有许多研究表明这些新型污染物在环境中的富集对人及其他生物将产生健康风险[4-5]。
饮用水水源中ARGs的检出对饮用水处理工艺提出了更高的要求[6]。生态湿地虽然已经被广泛证实可有效去除水中有机物、氮、磷、重金属等污染物[7-8],但其对ARGs去除效果的相关研究较少。
宁波某水库控制集雨面积为259 km2,总库容为1.198亿m3[9]15,目前是宁波市级饮用水源地之一。该水库生态湿地依据原有鱼塘改造而成,作为饮用水预处理工程承担着流域富营养化防治的任务[10]4817。本研究以该水库生态湿地为研究对象,采用荧光定量聚合酶链式反应(PCR)等方法探究了此生态湿地各模块出水中8种常见的ARGs(β内酰胺类抗性基因blaOXA-48、blaTEM,磺胺类抗性基因sul1、sul2,四环素类抗性基因tetO、tetW,大环内酯类抗性基因ermX、ermB)、一类整合子(intI1)与16S rRNA的控制情况。另外,本研究还探究了该生态湿地中ARGs与16S rRNA、intI1间的相关性,为探索生态湿地对ARGs的去除效果提供数据与支撑。
1 材料与方法
1.1 生态湿地总体布局
宁波某水库生态湿地占地4.33 hm2,净水能力5万t/d,设计平均水深为1.2 m,水力停留时间为20 h。该生态湿地由水杉涵养林生态沟净化系统、多级强化生物膜系统、营养盐集约式植物资源化系统、高效自净水生态系统、生态滤地系统这5个子系统组成,包含15 个湿地模块。各模块结构[9]17,[10]4817如表1所示。

表1 生态湿地各模块的结构
溪水从堰坝经引水管流入生态湿地,自生态湿地的A-1流至C-2后分成2股(A线和B线)分别流向C-6和C-8,汇合于D-1, 经E-1流入水库,具体流程见图1。

注:A线为A-1→B-1→C-1→B-2→C-2→C-3→C-4→B-3→C-6→D-1→E-1;B线为A-1→B-1→C-1→B-2→C-2→C-5→B-4→C-7→C-8→D-1→E-1。
1.2 样品采集
对生态湿地各模块的进出水进行多次采样,分别于2019年3、6、9月采集16个样品(包括进水(即原水))的3次平行样,每个样品采样2 L。样品存放在含有冰块的采样箱中低温保存,并在12 h之内完成水样预处理。采集样品时,用便携式pH计(HQ11d)和溶解氧仪(LDOTM)测定湿地进出水样品的温度、pH和溶解氧。
水样脱氧核糖核酸(DNA)提取的预处理:采用抽滤方式富集微生物,用0.22 μm滤膜进行真空抽滤。随后采用FastDNA Spin Kit for soil试剂盒(MP,美国)进行DNA提取。DNA浓度采用微量分光光度仪(ND-1000)测定,置于-85 ℃保存。
1.3 常规水质指标测定
对2019年6月生态湿地整体进出水样品进行COD、总氮、总磷、氨氮、总有机碳(TOC)的测定。COD的测定采用酸性高锰酸钾氧化法,总氮的测定采用碱性过硫酸钾消解紫外分光光度法,氨氮的测定采用纳氏比色法,总磷的测定采用钼酸铵分光光度法,TOC由TOC分析仪(5000TOCi)测定。
1.4 荧光定量PCR
荧光定量PCR在Bio-rad IQ5荧光定量PCR仪(Bio-Rad IQTM5)中进行。荧光定量PCR反应体系放在96孔板中,其中包含7.5 μL SYBR溶液,0.3 μL ROX溶液,0.3 μL摩尔浓度为10 mmol/L的前后引物,4.6 μL超纯水,2 μL 10 ng/μL的DNA样品。引物见表2。反应温度程序为:95 ℃ 预变性30 s后,进行40个循环扩增(95 ℃变性5 s,退火30 s,72 ℃延伸30 s),最后进行55~95 ℃的熔解曲线分析。每个扩增进行3个技术重复,并采用空白实验来排查误差。基因的绝对丰度由达到荧光阈值时所需的循环数对照标准曲线进行计算。
1.5 数据分析
采用SPSS V22.0软件进行相关性分析、差异性分析,P<0.05被认为存在显著性。
2 结果与讨论
2.1 常规水质指标的去除效果
如表3所示,该生态湿地对营养盐具有较好的去除效果,总氮和氨氮的去除率最高,分别为51.6%和40.5%,总磷的去除率为37.5%。多级强化生物膜系统和营养盐集约式植物资源化系统等对氮磷的控制效果较好。此外,COD的去除率为26.2%,TOC的去除率为12.3%,生态湿地对饮用水源水质净化效果较好。
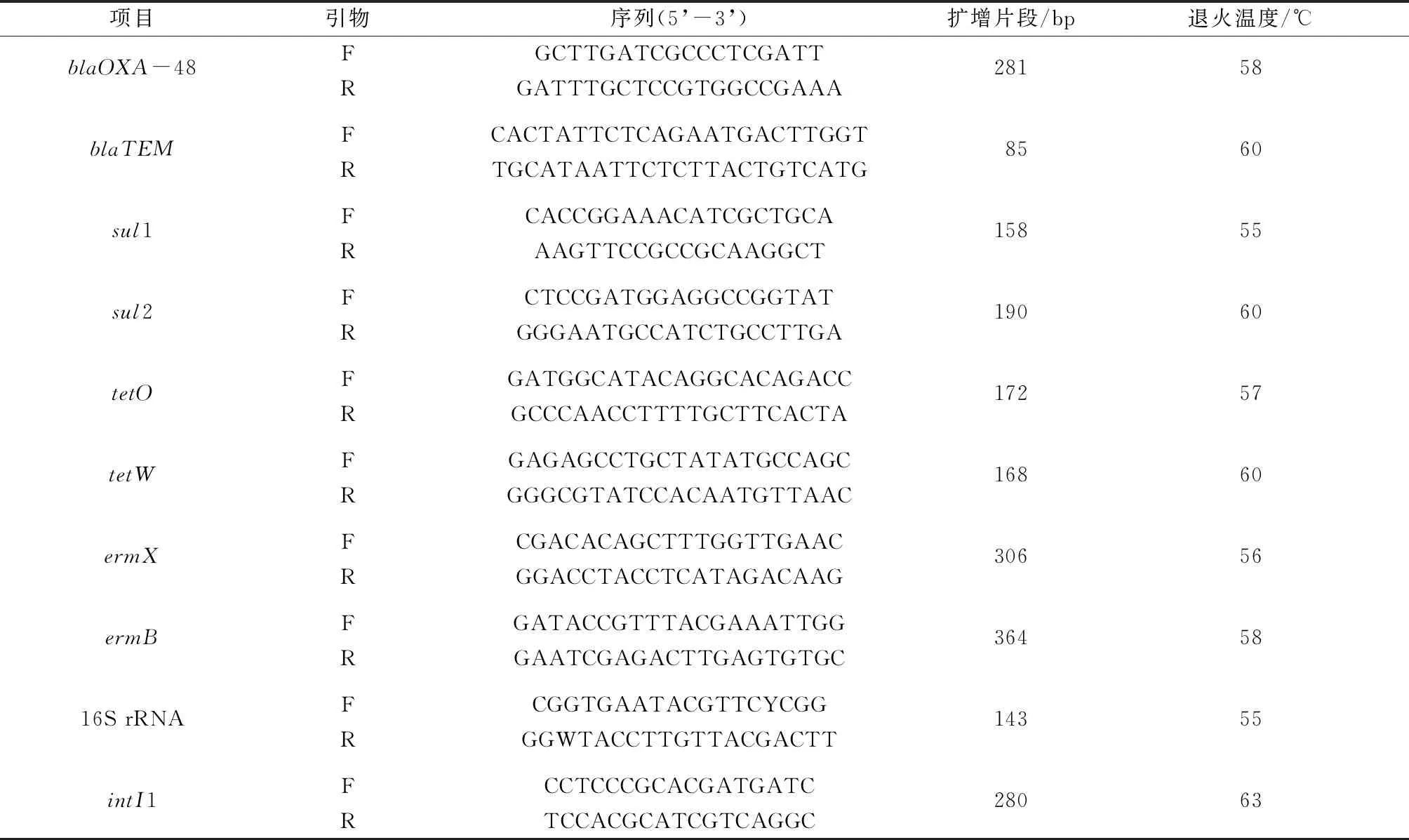
表2 引物序列
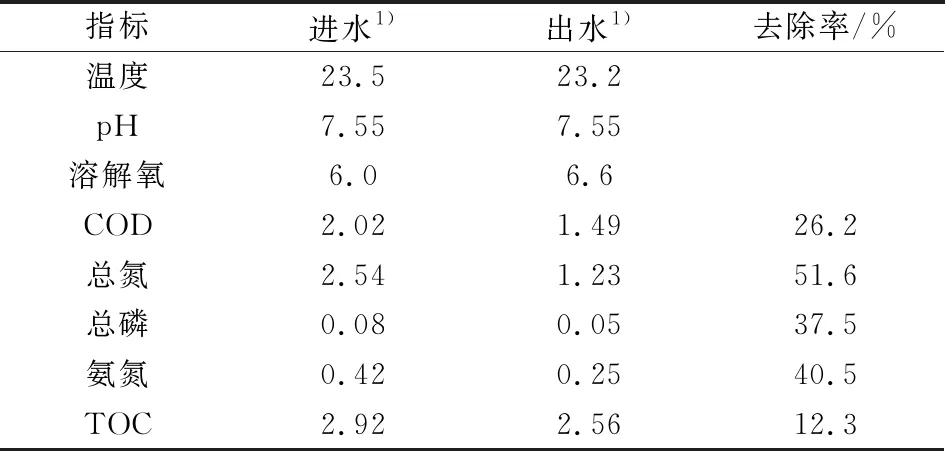
表3 常规水质指标的去除效果
2.2 ARGs的丰度
对生态湿地各模块出水中8种常见的ARGs检测结果显示,blaOXA-48、blaTEM、sul1、sul2、tetO、ermX6种ARGs均有不同程度地检出。水样中检出的各类ARGs比例较为相似,其中磺胺类抗性基因sul1、sul2绝对丰度最高,约占总检出ARGs的81.84%~88.97%,其次为四环素类抗性基因tetO(约占6.81%~13.68%),两者约占总检出ARGs的92.02%~97.87%,β内酰胺类抗性基因blaOXA-48、blaTEM和大环内酯类抗性基因ermX绝对丰度较低。磺胺和四环素类抗生素是较为广泛使用的药品,部分研究中也发现地表水中存在高丰度的磺胺类抗性基因和四环素类抗性基因[11-12],这两类ARGs需要引起关注。
ARGs的相对丰度为ARGs绝对丰度与16S rRNA的比值,代表着每个细菌中所含的ARGs拷贝数。生态湿地中ARGs的相对丰度如图2所示。该生态湿地中细菌总体变化不大,16S rRNA绝对丰度在2.19×106~3.50×106拷贝数/L波动,而ARGs的相对丰度在处理过程中大体呈现下降趋势,出水中ARGs的相对丰度仅为进水的26.69%。这意味着,携带ARGs的细菌在生态湿地中的比例逐步降低,这可能与生态湿地内增加的微生物群落和非生物物质有关[13]。

图2 ARGs的相对丰度和16S rRNA的绝对丰度
虽然生态湿地出水中sul1、sul2、tetO等的绝对丰度低于同类研究对饮用水源的调查结果[14],但ARGs相对丰度仍处于较高水平。这些ARGs排入水库后随着基因的垂直和水平转移,其绝对丰度有可能会再次上升,对人体健康造成威胁[15]。因此,需要进一步提升生态湿地对ARGs的去除能力。
2.3 ARGs的去除效果
图3显示的是该生态湿地A线、B线对4类ARGs的去除情况,采用秩和检验来检验ARGs绝对丰度的差异性。该生态湿地能显著降低磺胺类抗性基因sul1、sul2和四环素类抗性基因tetO的绝对丰度(P<0.05)。sul1的去除率为73.9%,sul2的去除率为75.9%,tetO的去除率为80.2%。而对β内酰胺类抗性基因blaOXA-48、blaTEM和大环内酯类抗性基因ermX的去除效果较差。同类研究表明,生态湿地对污水中ARGs的去除率基本在87.8%左右[16],生态湿地对水环境中ARGs的控制效果较好。不同水处理系统(曝气生物滤池、生态湿地和紫外线消毒)对ARGs去除效果的比较研究中发现,生态湿地对ARGs的去除率为90%~99%,曝气生物滤池的去除率为40%~90%,但紫外线消毒没有明显的效果,说明生态湿地在ARGs去除方面具有优势,可以优先成为污水处理厂进一步去除ARGs的处理系统[17]。
生态湿地A线、B线ARGs的去除规律较为相似,这可能与A线、B线中所涉及的模块组成较为相似有关。而不同生态湿地模块对ARGs的去除率不同。高效自净水生态系统主要由生态浮岛组成,种植再力花、水生鸢尾、美人蕉、钱币草,其对ARGs的去除率最高,约为33.9%。水杉涵养林生态沟净化系统(14.8%)、多级强化生物膜系统(15.1%)的去除率次之,水杉涵养林生态沟净化系统种植水杉、水生鸢尾、钱币草、苦草、黑藻、伊乐藻,多级强化生物膜系统主要在悬挂弹性挂膜材料里种植高密度再力花、钱币草、美人蕉、茭草。营养盐集约式植物资源化系统搭建生态沟,遴选湿生和水生高等植物进行套作,其对ARGs的去除率约为8.4%。而生态滤地系统对ARGs无去除效果,反而使ARGs增加了9.4%。这可能是由于生态滤地系统主要为水洗砂和碎石填装的三级垂直潜流滤床,种植植物单一。生态湿地对ARGs的去除可能主要与植物的根基有关。挺水植物比沉水植物处理效果好,这可能是因为挺水植物生命活动更为旺盛,微生物环境比沉水植物复杂,对多种ARGs的削减潜能更大[18]。

图3 生态湿地对ARGs的去除效果
2.4 相关性分析
整合子是一种可以在整合酶的作用下捕获外源基因盒并在特定的位点进行重组而使之表达的可移动基因元件,同时整合子又可整合到质粒上或自身作为转座子的一个组成部分而参与转移,成为环境中不同菌属间ARGs传播的重要途径[19]。本研究对生态湿地中的intI1进行调查,其绝对丰度为6.81×104~2.63×105拷贝数/L。磺胺类抗性基因sul1、sul2,四环素类抗性基因tetO与一类整合子intI1之间呈显著的正相关性(P<0.05),R2分别为0.82、0.91、0.93。一类整合子作为可移动基因元件之一,在磺胺类抗性基因、四环素类抗性基因的传播中具有重要作用[20]。因此对于水环境中sul1、sul2及tetO的削减和控制,应关注一类整合子在环境中的转移行为特征。
3 结 论
(1) 生态湿地中磺胺类抗性基因和四环素类抗性基因绝对丰度较高,约占总检出ARGs的92.02%~97.87%,β内酰胺类抗性基因和大环内酯类抗性基因较低。
(2) 生态湿地对磺胺类抗性基因和四环素类抗性基因去除率高,sul1的去除率为73.9%,sul2的去除率为75.9%,tetO的去除率为80.2%。
(3) 生态湿地不同模块对ARGs的去除效果不同,可能与植物种植情况和植物种类有关。
(4) 生态湿地中ARGs与intI1之间存在相关性,ARGs的去除与intI1有关。
