腹腔镜胃袖状切除术治疗2型糖尿病合并肥胖症的长期疗效观察
2020-12-02郭晨浩韩建立马鹏郗光霞吕志敢管杰赵浩亮
郭晨浩,韩建立,马鹏,郗光霞,吕志敢,管杰,赵浩亮
山西医科大学附属白求恩医院,太原030000
2型糖尿病(T2DM)已成为日益严重的公共卫生问题之一。糖尿病及其相关并发症在严重危害人们身心健康的同时加重了经济负担。而且,肥胖症发生率逐年上升,与T2DM发病率呈平行上升趋势,加大了糖尿病并发症的发生风险[1]。针对BMI明显超标的T2DM患者,腹腔镜胃袖状切除术(LSG)因其操作简单、保留正常消化道结构、术后并发症少、减重效果好、短期内胰岛β细胞功能改善效果好等特点[2],已成为国内最常用的减重术式之一[3]。LSG治疗机制主要与调节胃肠道激素水平、改善肠道微生态及肠-脑轴对营养和代谢的调控作用有关[4]。目前关于LSG治疗T2DM的长期临床随访资料较少,对该术式的长期疗效观察不足。因此,本研究对收治的34例T2DM合并肥胖症患者的临床资料进行分析,评估LSG术后5年内患者体质量、血糖的控制效果。
1 资料与方法
1.1 临床资料 2013年4月~2019年6月在本院行LSG的T2DM合并肥胖症患者34例,男17例、女17例,年龄17~61岁,T2DM病程3~19年,术前BMI 29.2~60.9 kg/m2,空腹血糖(FPG) 7.14~10.9(9.5±2.6)mmol/L,空腹胰岛素(FINS) 14.3~68.1(29.1±11.8)μIU/mL,糖化血红蛋白(HbA1c) 5.1%~10.7%(7.4%±1.4%)。在行LSG之前,仅服用降糖药18例(52.9%),其中10例(29.4%)仅服用1种药物、8例(23.5%)服用2种药物;6例(17.6%)仅接受胰岛素治疗;4例(11.8%)接受胰岛素联合1种降糖药治疗;2例(5.9%)接受胰岛素联合2种降糖药治疗;4例(11.8%)未接受任何药物治疗。纳入标准[5]:具有一定胰岛素分泌功能的T2DM患者;BMI>27.5 kg/m2,血糖难以控制,存在多种代谢综合征;年龄16~65岁。排除标准:妊娠期糖尿病等特殊类型糖尿病患者,各种原因不能手术者。本研究经医院伦理委员会批准通过,患者对本研究知情同意。
1.2 手术方法 患者取仰卧位,双手外展,脐缘处切开皮肤,10 mm Trocar穿刺入腹,作为观察孔,置入腹腔镜。脐上10 cm左、右锁骨中线处切开皮肤置入5 mm、12 mm Trocar,作为操作孔。镜下观察后,沿胃大弯侧紧贴胃壁离断胃网膜组织,充分显露胃底与胃后壁。经口置入36 Fr支撑胃管后,在距幽门4~6 cm处使用直线切割闭合器向上切割至贲门His角左侧1.5 cm,完整切除胃底与大弯侧胃壁,形成袖状胃,容积100 mL左右。使用倒刺可吸收缝线连续浆肌层缝合包埋切缘,取出标本,检查无活动性出血及胃漏,关腹结束手术。
1.3 观察指标 记录患者术前、术后1个月、术后3个月、术后6个月、术后12个月、术后3年、术后5年时体质量相关指标[体质量、BMI、超重体质量减少百分比(EWL%)]和血糖相关指标[FPG、HbA1c、FINS、胰岛敏感性指数(ISI)、胰岛素抵抗指数(HOMA-IR)]。
1.4 疗效评价 LSG术后5年,参考《2型糖尿病代谢手术术后管理中国专家共识》进行疗效评价[6]。糖尿病部分缓解:术后仅通过改变生活方式即可控制血糖;HbA1c<6.5%;FPG 5.6~6.9 mmol/L,且餐后2 h血糖7.8~11.0 mmol/L,保持1年以上。糖尿病完全缓解:术后无需服用降糖药,仅通过改变生活方式干预即可控制血糖;HbA1c<6.0%;FPG<5.6 mmol/L,且餐后2 h血糖<7.8 mmol/L,保持1年以上。糖尿病长期缓解:达到完全缓解且保持5年以上。糖尿病病情改善:HbA1c和FPG显著降低,尽管未达到部分缓解标准但药物需求减少(停止胰岛素治疗或口服降糖药或减少到一半剂量)。失效:血糖一度控制,后又恢复至术前水平。

2 结果
34例患者均顺利实施手术,术后未见严重并发症。术后1、3、6、12个月及术后3、5年体质量和BMI均低于术前(P均<0.05);术后3、6、12个月体质量和BMI逐渐下降(P均<0.05);患者体质量、BMI于术后1年时基本稳定,至术后3年时处于平台期。术后1、3、6、12个月及术后3、5年FPG、HbA1c、FINS、HOMA-IR低于术前,ISI高于术前(P均<0.05);术后3、6、12个月FPG、HbA1c、FINS、HOMA-IR、ISI逐渐降低,术后3、5年较术后12个月略有升高(P均<0.05)。详见表1。疗效评价:27例(79.4%)完全缓解,4例(11.8%)部分缓解,2例(5.8%)改善,1例(3%)失效。
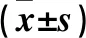
表1 34例患者手术前后体质量、血糖相关指标变化
3 讨论
早期高胰岛素血症导致胰岛素抵抗,随病情进展最终导致β细胞功能障碍,胰岛素缺乏;当机体不能有效利用胰岛素或胰腺不能产生足够胰岛素就会导致T2DM的发生。以上两者均是T2DM发生发展的重要环节,且在这一过程中相互促进[7,8]。因此,对于T2DM患者而言,提高机体对胰岛素敏感性是治疗关键。
本研究对T2DM合并肥胖症患者LSG术后不同阶段胰岛素相关参数进行随访,结果显示,ISI较术前逐渐上升、HOMA-IR较术前明显下降,平均在术后12个月时恢复正常。根据疗效评估标准,LSG术后T2DM缓解率为91.2%,提示患者术后胰岛素敏感性升高,胰岛细胞功能改善。另外,我们还观察到,术后1月时手术带来的收益最明显,FINS、HbA1c和HOMA-IR显著降低,其后这一趋势逐渐放缓,至术后1年时降至最低,在术后3年和术后5年时略微有所上升,但与术前相比差异均具有统计学意义。这表明LSG后患者胰岛素抵抗明显改善,这一效果可能在术后1年时达到最佳,并且能够长期保持。以上数据表明LSG在改善血糖方面的长期疗效较好,复发率低,手术收益随着时间的推移有所下降,这与相关研究[9]结果一致。现有研究发现,胃底细胞分泌的胃饥饿素(ghrelin)能够结合并激活表达于δ细胞的ghrelin受体,刺激其分泌生长抑素而间接发挥抑制胰岛素分泌的作用[10,11]。LSG术后胃底细胞的切除或许对该激素的分泌产生了重要影响。另一种胃肠激素胰高血糖素样肽1(GLP-1)可与胰岛β细胞膜表面的GLP-1受体相结合,随后细胞内腺苷酸环化酶被激活,激活环磷酸腺苷/蛋白激酶A信号转导通路,刺激胰岛β细胞增殖,促进胰岛素分泌[12,13]。因此,LSG术后ghrelin分泌减少与血清GLP-1水平的升高有助于维持血糖稳态[14],与LSG术后胰岛细胞功能改善密切相关。
肥胖在糖尿病的发生发展中扮演着重要角色。国内一项研究显示,肥胖是胰岛素抵抗与糖尿病之间关联的主要因素[7]。肥胖患者普遍存在脂代谢紊乱,由于胰岛素抵抗,激素敏感性脂肪酶活性无法被有效抑制,脂肪分解速率明显加快,TG被大量分解为游离脂肪酸(FAA),高水平的FAA既能诱导胰岛素及其受体抵抗,还可以抑制胰岛素分泌[15,16]。另一方面,当FAA含量过高、超过脂肪细胞的储存与代谢能力时,会易位沉积在肝脏、肌肉等储脂能力弱的组织中,这同样是导致胰岛素抵抗的重要原因之一[17]。因此,对于T2DM合并肥胖症的患者来说,减轻体质量、降低体脂、纠正脂肪易位沉积是治疗关键[18]。
本研究中,合并肥胖症的T2DM患者在LSG术后体质量与BMI显著下降,EWL%明显增加,在术后6个月、12个月时EWL%分别达到58.8%、61.0%,表明LSG在减重方面短期疗效显著。这可能与LSG术后ghrelin分泌减少、血清GLP-1水平升高有关,有助于患者降低食欲,减少进食量[19]。患者体质量在术后1年时进入平台期,其间患者体质量有小幅度波动,并维持至术后5年。根据随访结果来看,体质量波动的原因可能与患者饮食逐渐恢复正常且日常运动量少有关。总体来说,LSG在减重方面同样有着较好的长期疗效,体质量不易反弹,该术式在减重方面的收益对患者血糖控制起到了至关重要的作用。
综上所述,对于T2DM合并肥胖症的患者,选择LSG治疗在减重与血糖控制方面的疗效显著且持久稳定,复发率低,具有较好的应用价值。伴随着减重代谢专业的发展,大样本量、长时间的临床随访将进一步揭示减重代谢手术在治疗T2DM等代谢综合征方面的长期疗效。
