ZEA与DON单一及联合染毒致仔猪睾丸支持细胞凋亡的影响
2020-12-02贾北平徐静茹冯士彬吴金节王希春
朱 雷,贾北平,曹 利,徐静茹,赵 杰,冯士彬,李 玉,吴金节,王希春
(安徽农业大学 动物科技学院,安徽 合肥 230036)
霉菌毒素(mycotoxins)是由镰刀菌属(Fusarium)、曲霉菌属(Aspergillus)和青霉菌属(Penicillium)等真菌在生长过程中产生的次生有毒代谢产物。据统计,全世界每年大约有25% 的谷物在收获或者存储过程中遭受霉菌毒素污染,且具有明显的地区差异[1]。霉菌毒素化学性质稳定,耐高温,毒性效应广泛,动物摄入后会造成生产性能下降,免疫功能障碍,繁殖能力降低,以及继发其他疾病,严重影响畜牧业的健康发展[2-3]。玉米赤霉烯酮(ZEA)与脱氧雪腐镰刀菌烯醇(DON)是世界范围内常见的2种霉菌毒素,在农产品与饲料中的检出率和检出量一直居高不下,混合污染较为严重,且不易除去。研究表明,ZEA与DON均可造成雄性动物的生殖毒性,引起雄性动物睾丸组织中的生殖细胞减少,从而降低血清中睾酮浓度,影响生育能力[4]。睾丸支持细胞(sertoli cell,SC)是曲细精管内唯一与生精细胞直接接触的体细胞,通常是外界有毒物质的靶细胞,一些毒性物质对雄性生殖系统产生损伤作用时,通常最先破坏的是支持细胞的结构和功能[5]。细胞凋亡是ZEA、DON发挥毒性作用的重要途径之一。猪是对霉菌毒素最敏感的动物,目前的研究多以鼠为模型动物,且ZEA与DON对猪睾丸支持细胞联合毒性作用的报道较少。基于以上研究现状,本试验以仔猪睾丸支持细胞为模型,探讨ZEA与DON单一与联合染毒致仔猪睾丸支持细胞凋亡的作用机理,旨在为揭示ZEA与DON对猪生殖系统的联合毒性作用机制提供理论依据。
1 材料与方法
1.1 试验材料与仪器
仔猪睾丸支持细胞株,购于青旗(上海)生物技术发展有限公司;ZEA、DON标准品(含量≥99%),购于美国Sigma公司;DMEM高糖培养基,购于美国HyClone有限公司;胎牛血清,购于美国Clark有限公司;胰酶细胞消化液,购于碧云天生物技术有限公司;Trizol RNA提取试剂盒,购于大连宝生物工程有限公司;流式Annexin V-FITC/PI试剂盒,购于万类(沈阳)生物科技有限公司;线粒体膜电位检测试剂盒(JC-1),购于碧云天生物技术有限公司;BIOMIGA SYBR qPCR Mix 试剂盒,购于日本 Toyobo 公司。其他试剂均为分析纯。
1.2 方法
1.2.1 细胞培养与溶液配置
将冻存于液氮中的的细胞置于37 ℃水浴锅中融化,然后转移至 4 cm×6 cm 细胞培养瓶中,每瓶加入5 mL的DMEM高糖培养基(100 mL·L-1胎牛血清、100 U·mL-1青霉素、0.1 mg·mL-1链霉素和0.25 μg·mL-1两性霉素B),在37 ℃、5% CO2饱和湿度的细胞培养箱中进行培养。在倒置显微镜下观察细胞的生长状态,当细胞覆盖培养瓶面积的80% 以上时可按需进行传代培养。
将5 mg DON标准品溶解于5 mL无菌双蒸水中,将5 mg ZEA标准品溶解在5 mL 二甲基亚砜(DMSO)中,配成浓度为1 mg·mL-1的母液备用。
1.2.2 ZEA与DON攻毒浓度筛选
根据细胞活率确定最佳攻毒浓度比,取处于对数生长期的仔猪睾丸支持细胞接种于96孔板中,每孔约5 000 个细胞,培养至贴壁后,用不同质量浓度(0、5、10、15、20、25 μg·mL-1)ZEA与(0、0.1、0.2、0.4、0.8、1.6 μg·mL-1)DON单一及联合攻毒24 h后,更换培养液,每孔中分别加入10 μL的CCK-8试剂,于恒温箱中孵育2 h,用酶标仪在波长为450 nm处检测吸光度,计算细胞的存活率。细胞存活率(%)=[(试验组D值-空白组D值)/(对照组D值-空白组D值)]×100%。
1.2.3 细胞形态观察
将处于对数生长期的仔猪睾丸支持细胞接种于6孔细胞培养板中,细胞密度为1×105mL-1,培养至贴壁后,更换含有不同浓度ZEA与DON的细胞培养液,继续培养24 h后,在倒置显微镜下观察各试验组细胞形态变化。
1.2.4 ZEA与DON对仔猪睾丸支持细胞超微结构的影响
用含不同浓度毒素的培养液培养仔猪睾丸支持细胞24 h后,胰酶消化收集,1 000 ×g离心5 min,吸弃上清液,缓缓加入2.5% 戊二醛1 mL,将细胞放置在4 ℃ 静置24 h进行固定。用预冷过的PBS对细胞漂洗3次,加入不同体积分数的乙醇溶液进行脱水,加入丙酮将乙醇除去,再以1% 饿酸室温处理2 h,用环氧树脂进行包埋,包埋经干燥后,修块超薄切片,采用醋酸双氧铀和柠檬酸铅染色,分别染色5 min和15 min;将处理好的细胞,用透射电镜观察ZEA与DON对细胞超微结构的影响。
1.2.5 凋亡率检测
将处于对数生长期的仔猪睾丸支持细胞用ZEA与DON染毒处理24 h,胰酶消化后离心收集细胞,并用PBS洗涤2次。采用Annexin V-FITC/PI试剂盒测定,向细胞沉淀中加入100 μL Binding buffer 重悬细胞,先加入5 μL Annexin V-FITC,在恒温箱中孵育15 min,然后加入5 μL PI(propidium iodide),5 min后加入适量稀释液采用流式细胞仪上机检测。
1.2.6 线粒体膜电位检测
将密度为1×105mL-1的仔猪睾丸支持细胞接种于6孔细胞培养板,用ZEA与DON染毒处理24 h,胰酶消化并离心收集细胞,用PBS洗涤细胞1次,每管加入1 mL细胞培养液和1 mL JC-1染色工作液,混匀,于37 ℃、5% CO2培养箱中避光孵育20 min后,4 ℃、1 000 ×g离心5 min,收集细胞,JC-1染色缓冲液洗涤2次,用适量缓冲液重悬细胞,用流式细胞仪检测细胞线粒体膜电位。
将密度为1×105mL-1的仔猪睾丸支持细胞接种于铺有爬片的24孔细胞培养板,用含有ZEA与DON的培养液处理贴壁细胞24 h后,用PBS洗涤细胞1次,加入0.25 mL细胞培养液和0.25 mL JC-1染色工作液,混匀,于37 ℃、5% CO2培养箱中避光孵育20 min后,吸弃上清液,用JC-1染色缓冲液洗涤2次,将细胞爬片转移到载玻片上,于激光共聚焦显微镜下观察。
Ca1、ca2、ca3 {font-size:l6px;list-style:none;Width:300px;padding:l2px;background-color:# ddd;}
1.2.7 凋亡相关基因mRNA表达水平的测定
将处于对数生长期的仔猪睾丸支持细胞用ZEA与DON染毒处理24 h,Trizol法抽提RNA并测定浓度,使用First Strand cDNA Synthesis Kit 将RNA反转录成cDNA。根据GenBank相关序列设计合成目的基因Bax、Bcl-2、Bid、Caspase-3、Caspase-9和β-actin内参基因引物的序列,引物序列和参数见表1。

表1 主要凋亡基因及内参基因β-actin的引物参数Table 1 Parameters of primer for main apoptotic genes and β-actin genes
按照StepOneTMReal-Time PCR System和BIOMIGA SYBR qPCR Mix 试剂盒的说明配制实时荧光定量PCR(qRT-PCR)反应液。采用三步法qPCR 程序:预变性95 ℃ 2 min;PCR反应95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;55 ℃ 1 min,55 ℃→98 ℃,每 0.01 s 升温 0.05 ℃,20 ℃ 10 s。每个样品基因和内参基因β-actin均在相同条件下进行扩增反应,重复3次。
1.2.8 数据处理
数据采用SPSS 17.0软件中的ANOVA进行方差分析,LSD显著性检验,P<0.05为差异显著,P<0.01为差异极显著。运用GraphPad Prism 5.0进行柱状图的绘制。
2 结果与分析
2.1 ZEA与DON攻毒浓度筛选与分组
用含不同质量浓度ZEA与DON 的培养液处理仔猪睾丸支持细胞24 h 后,CCK-8法检测结果如图所示,与对照组相比,ZEA质量浓度在10 μg·mL-1即可显著降低细胞活率(P<0.05),在15 μg·mL-1时细胞活率下降极显著(P<0.01);0.2 μg·mL-1的DON即可显著降低细胞活率(P<0.05),0.4 μg·mL-1DON即可导致细胞活率极显著降低(P<0.01);10 μg·mL-1ZEA与0.2 μg·mL-1DON联合即可导致细胞活率极显著降低(P<0.01),且随着质量浓度的升高,高质量浓度组之间细胞活率差异较小。因此,选用ZEA攻毒质量浓度为10 μg·mL-1,DON攻毒质量浓度为0.2 μg·mL-1。
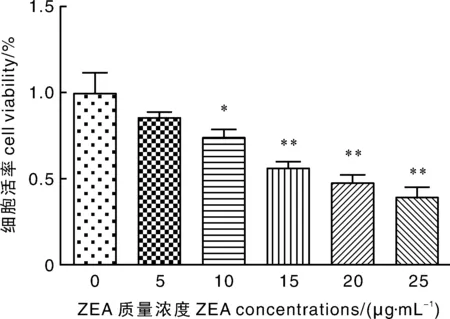
*和**表示与对照组相比,差异显著(P<0.05)和极显著(P<0.01),下同。* and ** indicated significant differentces at P<0.05 and P<0.01 compared with control group.The same as below.图1 不同浓度ZEA对细胞活率的影响Fig.1 Effect of ZEA at different concentrations on cell viability
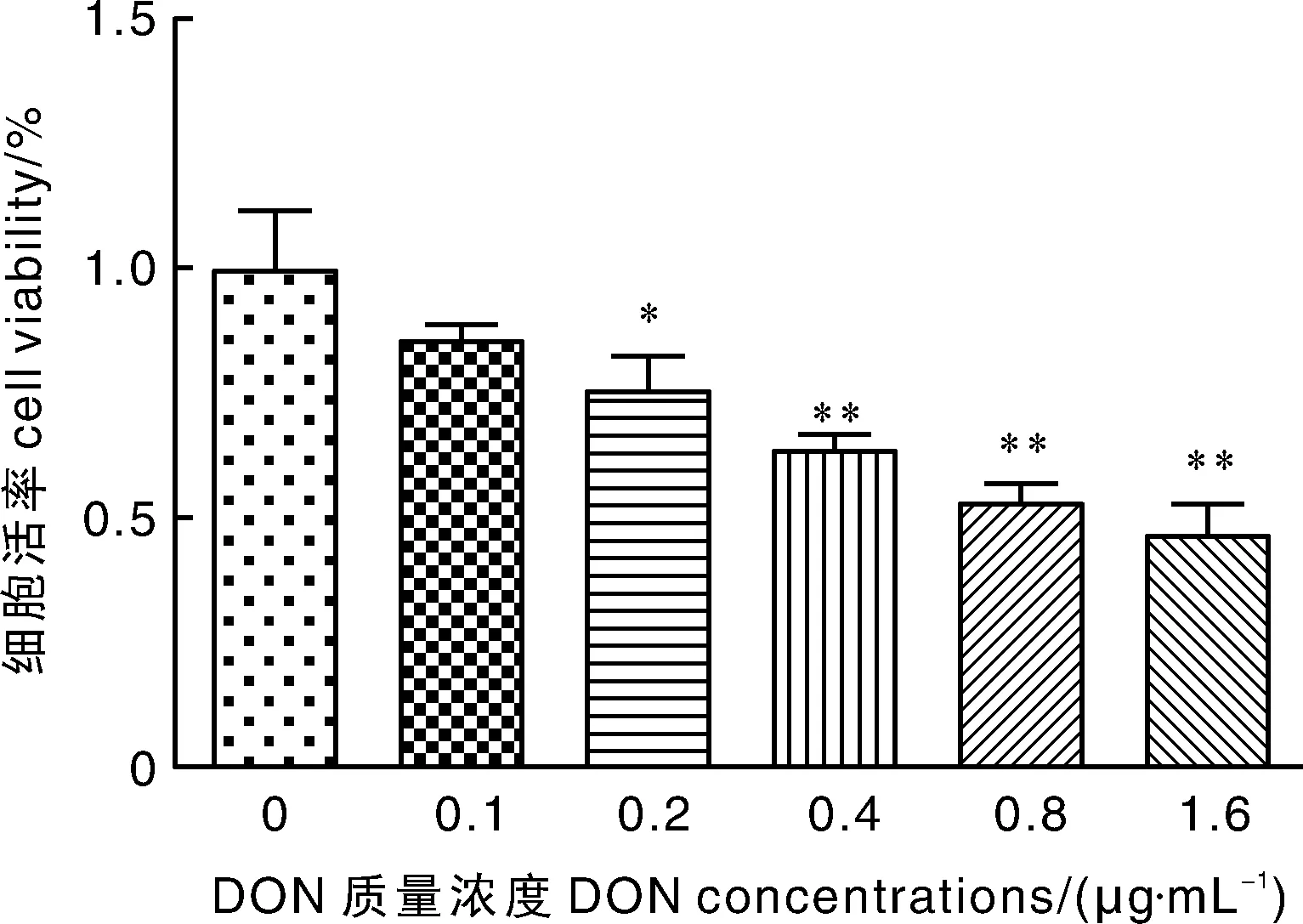
图2 不同浓度DON对细胞活率的影响Fig.2 Effect of DON at different concentrations on cell viability
试验分为4个组,对照组、Z(10 μg·mL-1ZEA)组、D(0.2 μg·mL-1DON)组、L(10 μg·mL-1ZEA+0.2 μg·mL-1DON)组,每个组均设置3个重复。
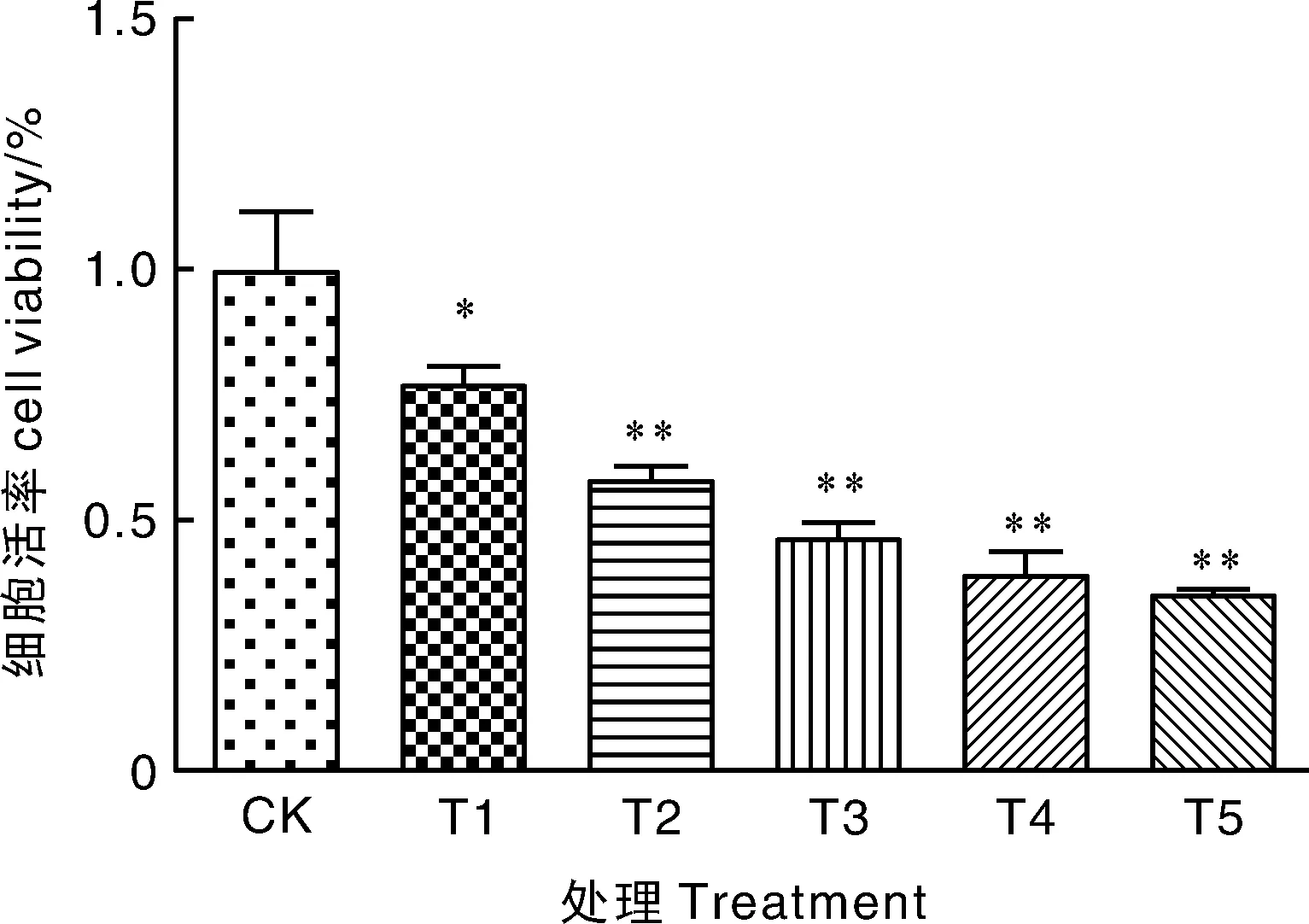
T1,5 μg·mL-1 ZEA+0.1 μg·mL-1 DON;T2,10 μg·mL-1 ZEA+0.2 μg·mL-1 DON;T3,15 μg·mL-1 ZEA+0.4 μg·mL-1 DON;T4,20 μg·mL-1 ZEA+0.8 μg·mL-1 DON;T5,25 μg·mL-1 ZEA+1.6 μg·mL-1 DON.图3 ZEA与DON联合对细胞活率的影响Fig.3 Effect of combination of ZEA and DON on cell viability
2.2 ZEA与DON对仔猪睾丸支持细胞形态与活率的影响
用含ZEA与DON 的培养液处理仔猪睾丸支持细胞24 h 后,结果如图4所示。对照组细胞形态与生长状态正常,细胞形态饱满,生长旺盛,细胞间排列紧密;Z组细胞明显发生皱缩、空泡化,悬浮、死亡的细胞增多;D组细胞并未出现明显皱缩,但细胞间排列稀疏,细胞分裂增殖减少,悬浮、贴壁不紧的细胞增多;L组细胞生长状态最差,细胞间排列稀疏,细胞明显皱缩,悬浮、死亡细胞明显增多。

图4 ZEA与DON仔猪睾丸支持细胞形态的影响(×400)Fig.4 Effect of ZEA and DON on sertoli cell morphology in piglets (× 400)
2.3 ZEA与DON对仔猪睾丸支持细胞超微结构的影响
电镜观察结果如图5所示,对照组细胞饱满,细胞膜、核膜清晰可见,线粒体与内质网结构完整无断裂,核染色质均匀;Z组细胞皱缩明显,核膜出现破损,内质网断裂,结构模糊,线粒体破裂,形成自噬囊泡,细胞核皱缩,核染色质浓缩;D组细胞皱缩不显著,核膜轻微破损,线粒体受损严重,生成自噬囊泡较多,细胞核皱缩,核染色质浓缩;L组细胞明显皱缩,细胞膜破损,胞质内自噬泡增多,内质网与线粒体嵴断裂,结构模糊,核膜边缘被核染色质附着,核染色质严重浓缩。

图5 ZEA与DON对仔猪睾丸支持细胞超微结构的影响(×8000)Fig.5 Effect of ZEA and DON on ultrastructure of sertoli cells in piglets(×8000)
2.4 ZEA与DON对仔猪睾丸支持细胞凋亡率的影响
流式细胞仪检测结果如图6所示,与对照组相比,Z组细胞凋亡率极显著升高(P<0.01),D组凋亡率显著升高(P<0.05),L组凋亡率极显著升高(P<0.01),L组凋亡率均高于其他各组。
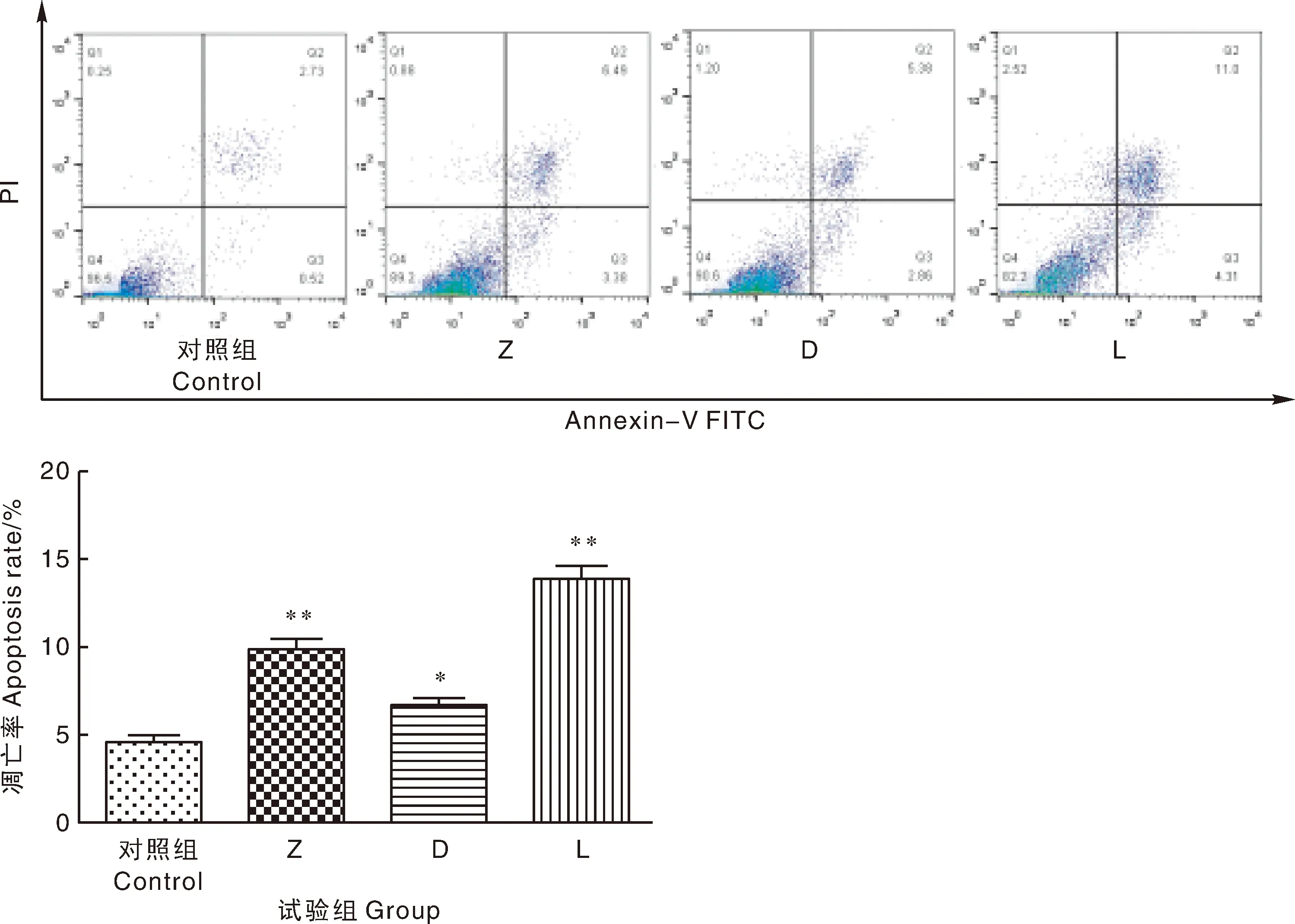
图6 ZEA与DON对仔猪睾丸支持细胞凋亡率的影响Fig.6 Effect of ZEA and DON on apoptosis rate of sertoli cells in piglets
2.5 ZEA与DON对仔猪睾丸支持细胞线粒体膜电位的影响
用ZEA与DON处理仔猪睾丸支持细胞24 h后,JC-1探针装载,用流式细胞仪检测,细胞散点如图7所示。与对照组相比,Z组、D组与L组线粒体膜电位下降均极显著(P<0.01)。免疫荧光检测结果显示,对照组细胞荧光为正常的橙红色,Z组与D组绿色荧光增强,L组绿色荧光增强极显著。
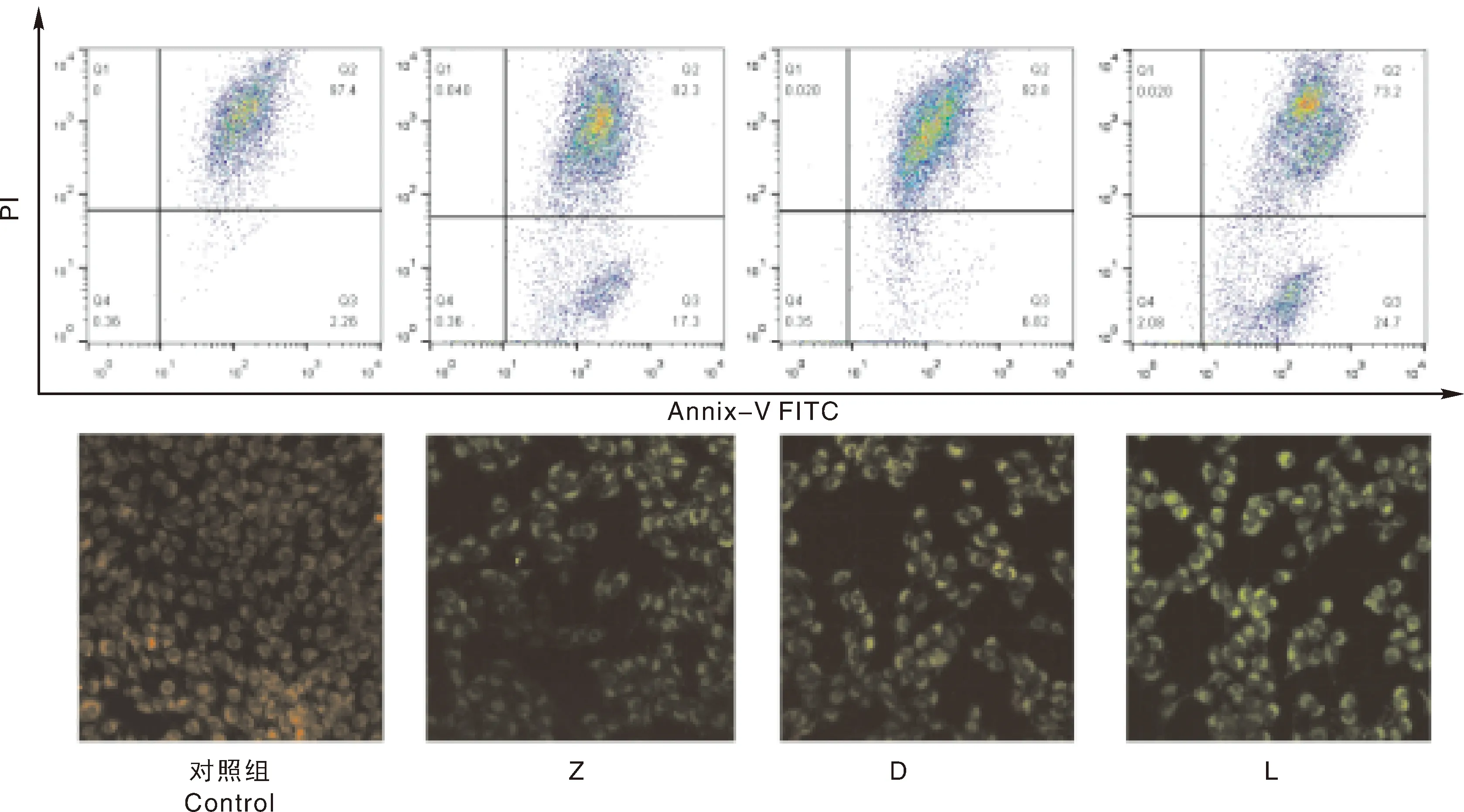
图7 ZEA与DON对仔猪睾丸支持细胞线粒体膜电位的影响Fig.7 Effect of ZEA and DON on mitochondrial membrane potential of sertoli cells in piglets
2.6 ZEA与DON对猪睾丸支持细胞凋亡基因表达的影响
qRT-PCR检测凋亡相关基因Bax、Bcl-2、Bid、Caspase-3和Caspase-9 mRNA 表达水平,结果如图8所示。与对照组相比,Z组Bax、BidmRNA表达量与Bax/Bcl-2极显著升高(P<0.01),Bcl-2的表达量显著降低(P<0.05);D组Bax、BidmRNA表达量显著升高(P<0.05),Bax/Bcl-2极显著升高(P<0.01),Bcl-2的表达量降低不显著;L组Bax、BidmRNA表达量与Bax/Bcl-2极显著升高(P<0.01),Bcl-2的表达量极显著降低(P<0.01)。

图8 ZEA与DON对仔猪睾丸支持细胞凋亡基因表达的影响Fig.8 Effect of ZEA and DON on apoptosis gene expression of sertoli cells in piglets
与对照组相比,Z组Caspase-3 mRNA 表达量极显著增加(P<0.01),Caspase-9 mRNA 表达量增加显著(P<0.05);D组Caspase-3、Caspase-9 mRNA 表达量增加显著(P<0.05);L组Caspase-3、Caspase-9 mRNA 表达量增加极显著(P<0.01)。
3 讨论
众多研究表明,ZEA与DON在饲粮中常共同存在,两者均具有生殖毒性,且具有一定的互作效应。王新等[6]给予性成熟的雄性SD大鼠腹腔注射ZEA 6 h后,大鼠血清睾酮和促黄体生成素极显著降低,睾丸环腺苷酸(cAMP)在显著下降,睾丸LHR mRNA表达水平显著下调,表明ZEA可对雄性动物生殖系统造成急性损伤。用DON对雄性小鼠连续灌胃28 d后,DON 可导致小鼠出现精子数量减少、睾丸中变性的生殖细胞的增加、血清睾酮水平降低、精子释放障碍等症状[7]。DON 与ZEA 的联合作用可显著降低小鼠淋巴细胞的增殖,并且与剂量呈依赖性相关,二者具有加性效应[2];ZEA可显著降低同时给予DON小鼠迟发性超敏反应的抑制效应,并明显提高小鼠肝脏细胞的凋亡率,并表现为亚加性效应[8]。此外,ZEA 和 DON 联合染毒可显著影响小鼠的子宫指数,并可导致卵母细胞减数分裂过程中染色质形态异常,抑制卵母细胞成熟,也可导致雄性昆明小鼠睾丸脏器系数、精子活率及数量、血清性激素含量以及抗氧化酶活性显著降低,精子畸形率、血清丙二醛含量显著上升,睾丸组织内生精小管基膜出现病变,体积缩小,细胞空泡化增多[9-10]。本试验以仔猪睾丸支持细胞为模型,于体外探讨ZEA与DON的单一及联合毒性。结果表明,ZEA与DON单一与联合染毒均可对仔猪睾丸支持细胞造成损伤,并诱导其发生凋亡,试验结果与上述报道内容相一致,但本试验中较低浓度毒素即可引起猪睾丸支持细胞活率显著下降,表明猪对ZEA与DON具有较高的敏感性。
细胞凋亡是ZEA、DON造成细胞毒性的重要途径,细胞调亡又称程序化死亡,是正常机体细胞内外刺激因子启动的一个主动、有序的过程,受到严格的调控信号调节[11]。细胞凋亡是机体在发育和受到损伤时的一种生理性保护机制,可及时清除体内多余及损伤的细胞而不伤害周围细胞或组织。当机体被外界不良因素过度刺激时,可导致细胞凋亡调控失衡,引起细胞过度死亡和过度凋亡,从而对机体造成损伤[12]。凋亡发生过程中常伴随着细胞核皱缩,染色质浓缩,碎裂等形态学变化等特征,这与本试验电镜观察结果一致,ZEA与DON单一与联合均可导致睾丸支持细胞发生皱缩,线粒体与内质网断裂以及空泡化,细胞核皱缩,核染色质浓缩。流式细胞术检测结果显示,ZEA与DON导致睾丸支持细胞凋亡率显著或极显著升高,表明ZEA与DON可诱导睾丸支持细胞过度凋亡,且联合毒性呈亚加性效应。
线粒体作为产生能量的重要细胞器,在内源性凋亡途径中发挥了重要作用。在细胞凋亡进程中,线粒体膜电位的下降是细胞发生凋亡的重要标志[13]。外界不良因素引发的应激可导致线粒体膜的通透性升高,生成动态的线粒体通透性转变孔道,使得线粒体跨膜电位耗散,细胞进入不可逆的凋亡过程,其中Bcl-2家族因子在调控线粒体膜通透性和激活下游凋亡信号分子方面起到了至关重要的作用[14]。Bcl-2蛋白家族主要分布于线粒体膜外,细胞凋亡与否主要由促凋亡基因Bax与抗凋亡基因Bcl-2的比值决定[15]。Bcl-2蛋白能够稳定线粒体膜完整性,抑制线粒体释放AIF和Cyt C,具有抗凋亡功能。Bax是Bcl-2家族中的一员,既可以形成同聚体促进凋亡,也可以与Bcl-2结合,从而抑制Bcl-2的抗凋亡作用。当Bax/Bcl-2的比值升高,可引起线粒体膜通透性改变,可导致线粒体膜电位紊乱,并使得线粒体内容物外流增多,大量Cyt C 被释放到细胞质中。Bid蛋白也是Bcl-2家族中促凋亡类的蛋白,当细胞暴露于凋亡诱导因子的环境中,可被Caspase 8酶切调控,进而诱导Cyt C从线粒体内释放,从而起到促凋亡作用[16-17]。本试验结果显示,ZEA与DON单一与联合染毒均导致线粒体膜电位极显著下降,Bax、BidmRNA表达量与Bax/Bcl-2显著或极显著升高,Bcl-2 mRNA表达量显著或极显著降低,表明ZEA与DON通过调节Bcl-2、Bax和Bid基因表达水平来诱导睾丸支持细胞凋亡。
当Bax/Bcl-2的比值升高,大量Cyt C 被释放到细胞质中激活了下游的Caspase-9,并进一步激活胱天蛋白酶级联反应,活化Caspase-3,最终引起细胞凋亡。Caspase-9位于级联反应的最上游,是细胞线粒体依赖的凋亡途径中最重要的起始因子[18]。当细胞接收到凋亡刺激信号时,线粒体释放Cyt C与凋亡蛋白酶活化因子Apaf-1和procaspase-9相结合,形成“凋亡体”,共同激活Caspase-9,并顺序激活下游Caspases最终引起细胞损伤,导致细胞凋亡[19-20]。Caspase-3在细胞凋亡过程中起非常重要的作用,活化后的Caspase-3会使细胞DNA断裂、染色质凝聚、生成凋亡小体[21-22]。本次试验结果表明,ZEA可极显著上调Caspase-3 表达量,并显著上调Caspase-9表达量,DON 显著上调Caspase-3、Caspase-9表达量,ZEA与DON联合可极显著上调Caspase-3、Caspase-9表达量,表明Caspase-3与Caspase-9参与了睾丸支持细胞的凋亡过程,ZEA与DON可通过调节Caspase-3与Caspase-9表达水平诱导睾丸支持细胞凋亡。
4 结论
ZEA与DON对仔猪睾丸支持细胞均具有毒性损伤作用,可导致仔猪睾丸支持细胞活率下降,凋亡率升高,线粒体膜电位降低,并抑制线粒体相关抗凋亡基因Bcl-2表达,上调促凋亡基因Bax、Bid,以及凋亡相关基因Caspase-3和Caspase-9的表达量,表明ZEA与DON可通过线粒体途径诱导仔猪睾丸支持细胞凋亡,且联合毒性大于单一毒性,表现为亚加性效应。
