米根霉发酵米糠工艺优化及其益生活性研究
2020-12-02张夏秋刘丽娅王丽丽佟立涛周闲容周素梅
张夏秋 刘丽娅 王丽丽 佟立涛 周闲容 周素梅
(中国农业科学院农产品加工研究所,北京 100193)
米糠是稻谷加工的主要副产物之一,由果皮、种皮、珠心层和糊粉层等组成,占稻谷总质量的8%~10%[1],我国米糠平均年产量约1 200万t[2]。米糠含有米糠多糖、蛋白质、膳食纤维、B族维生素、矿物质等多种营养成分[3],还富含γ-氨基丁酸、酚酸、类黄酮等生物活性物质,这些活性物质在调节血压、抗疲劳、抗氧化、预防人体心脑血管疾病等方面具有一定功效,是开发功能性食品的理想原料[4]。目前,国外对米糠的研究开发比国内领先,在保存米糠资源和综合利用上已取得较大进展,大量以米糠为原料的可食用产品被开发利用并取得了不错的经济效益[5]。然而在国内,米糠大多用作饲料,少部分被用于提取米糠油后直接丢弃,导致大部分营养成分未得到充分利用,造成资源的极大浪费[6]。
米糠油脂含量较高,稳定性差,易哈败变质,为保证充分利用米糠资源并对其进行后续深加工,必须首先采取快速有效的方式对新鲜米糠进行稳定化处理,抑制其酸败。通过发酵提高米糠中可溶性膳食纤维(soluble dietary fiber,SDF)含量来改善稳定化米糠的口感风味[7],提高米糠的营养功能特性。研究表明,黑曲霉发酵可有效提高米糠粕中SDF含量[8];纳豆芽孢杆菌发酵能显著提高小米糠中膳食纤维的溶胀性,从而改善小米糠的生理特性[9];采用枯草芽孢杆菌(Bacillussubtilis)B4发酵米糠粕,SDF得率显著提高[10]。在米根霉发酵米糠研究领域,一方面集中在功能活性的研究如抗氧化活性变化等[11],另一方面主要是成分变化研究如蛋白质、脂肪酸等含量的变化[12]。然而有关米根霉发酵条件对SDF得率的影响及米根霉发酵前后米糠益生活性的变化尚鲜见报道。因此,本研究采用过热蒸汽对米糠进行稳定化处理,然后选取3种米根霉作为发酵菌种,以SDF得率和感官评分为指标,筛选最佳发酵菌种,并通过单因素试验和正交试验确定米根霉发酵米糠的最佳工艺,并对发酵前后米糠的益生活性进行评价,以期为改善食用米糠产品质量,提高米糠功能特性以及今后米糠在发酵方面的应用提供理论基础,为开发新型米糠功能食品奠定基础。
1 材料与方法
1.1 材料与试剂
米糠,黑龙江金都稻米公司当季稻谷所碾新鲜米糠,过40目筛;3种米根霉(酒香型、甜香型、风味型),安琪酵母股份有限公司;α-淀粉酶(15 U·mg-1)、胃蛋白酶(474 U·mg-1)、胰酶(4×USP),美国Sigma公司;猪胆汁,北京索莱宝生物有限公司;蛋白胨,奥博星生物技术有限公司;酵母膏、胰蛋白胨,英国Oxoid公司;2XSG PCR MasterMix,美国Applied Biosystems公司;95%乙醇、磷酸氢二钾、磷酸二氢钾、七水硫酸镁等均为分析纯,国药集团药业股份有限公司。
1.2 仪器与设备
TABLE-TOP 350型过热蒸汽烤制设备,日本Naomoto公司;HZQ-F160振荡培养箱,上海一恒科学仪器有限公司;LGI-25C冷冻干燥机,巩义市予华仪器有限责任公司;UT-760厌氧发酵罐,广州市尤德生物科技有限公司;ABI 7500实时定量PCR仪,美国Perkin Elmer公司;78900B气相色谱仪,美国Agilent科技有限公司;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;FW100高速万能粉碎机,天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 米糠稳定化条件优化 采用过热蒸汽设备对米糠进行稳定化处理。米糠于55℃烘干,随机分为3组,每组3份,每份100.0 g,平铺于不锈钢盘中。将装有米糠样品的不锈钢盘迅速放入设定温度处理室(过热蒸汽处理器),且处理室温度变化不超过1℃,并开始计时。处理设定温度分别为120、140、160℃,每个温度下分别处理1、2、3 min。样品处理完毕后测定其脂肪酶活力,确定最佳稳定化温度和时间。
1.3.2 脂肪酶活力测定 参照GB/T 5523-2008[13],采用滴定法测定米糠脂肪酶活力。
1.3.3 米根霉发酵米糠菌种筛选 3种米根霉固定料液比1∶2.0、发酵温度35℃,接种量0.5%,分别发酵24、36、48、60、72 h。取20.0 g最佳稳定化条件处理后的米糠于250 mL锥形瓶中,加入一定量的无菌水搅拌均匀,加入耐高温α-淀粉酶,于121℃灭菌20 min,冷却至室温后接种,置于振荡培养箱中发酵(转速180 r·min-1), 发酵完成后,121℃灭菌20 min,冷冻干燥后用高速万能粉碎机粉碎,装于自封袋,置于-20℃储存备用。每组试验设3个平行。
1.3.4 米糠SDF提取及得率测定 参照王旭等[14]的方法提取米糠SDF。分别称取2.0 g米糠样品,按1∶50(g·mL-1)的料液比加入蒸馏水,沸水浴搅拌40 min,冷却至室温后,加入200 μL耐高温α-淀粉酶,调节pH值至中性后进行酶解。105℃加热15 min灭酶后冷却至室温。之后加入50 mL 1.12%(m∶v)NaOH溶液,搅拌均匀后置于80℃水浴锅中反应60 min。取出后冷却至室温,4 000 r·min-1离心20 min后取上清液,用4倍体积95%乙醇沉淀,4 000 r·min-1离心10 min,将所得沉淀物真空干燥后得到SDF,于4℃保存备用。
采用GB/T 5009.88-2014[15]测定膳食纤维(dietary fiber,DF),并根据公式计算SDF得率:
(1)
式中,m1为烘干至恒重时米糠干物质中SDF的质量,g;m0为米糠干物质中DF的质量,g。
1.3.5 发酵米糠的感官评价 选择10名从事食品专业的人员组成评定小组,分别从质地、色泽、气味、酸甜度及风味5个方面对发酵米糠的感官品质进行评价。在评价过程中,要求评定小组人员客观公正,并充分领会各项评价指标的含义。根据评分标准进行评分(表1),结果取平均值。
1.3.6 米根霉发酵米糠工艺条件优化 以米根霉最佳发酵菌种进行工艺条件优化。
1.3.6.1 单因素试验设计 发酵温度35℃、接种量0.5%、料液比1∶2.0、发酵时间36 h,固定三个基础条件,改变其中一个条件进行单因素试验。料液比(m:v)(1∶0.50、1∶1.00、1∶1.50、1∶2.00、1∶2.25、1∶2.50)、接种量(0.25%、0.50%、0.75%、1.00%、1.50%)、发酵时间(24、36、48、60、72 h)、发酵温度(25、30、35、40℃),测定不同条件下发酵米糠SDF得率。
1.3.6.2 正交试验设计 根据发酵菌种的筛选结果及单因素试验结果,以料液比、接种量、发酵时间、发酵温度为试验因素,以SDF得率为指标设计试验,采用L16(45)正交表(表2),每组重复3次,取平均值。
1.3.7 发酵米糠的体外消化及模拟肠道发酵 (1)体外消化:参照 Connolly等[16]和Guergoletto等[17]的方法,并略作修改。准确称取12.00 g米糠样品(最佳发酵工艺条件下所得米糠样品)于250 mL锥形瓶中,加入200 mL 无菌水搅拌均匀,随后加入1.25 mL含有10.00 mg唾液α-淀粉酶的CaCl2溶液(1 mmol·L-1,pH值7.0),空白组不加米糠,置于37℃恒温水浴振荡反应,消化15 min后,用HCl溶液(6 mol·L-1) 调节反应液pH值至 2.0,继续加入5 mL溶有0.24 g胃蛋白酶的HCl溶液(0.1 mol·L-1),置于37℃恒温水浴振荡反应;消化2 h后,用NaOH溶液(6 mol·L-1) 调节反应液pH值至6.8,继续加入10 mL溶有0.22 g胰酶和0.70 g胆汁的NaHCO3溶液(0.5 mol·L-1), 置于37℃恒温水浴振荡摇床反应,消化4 h后,将反应液全部转移至1 kDa透析袋中透析24 h。最后将消化液冷冻干燥(-40℃,8.33 Pa),置于-20℃保存,用于模拟肠道发酵试验。

表1 发酵米糠感官评价标准Table 1 Sensory evaluation standard of fermented rice bran

表2 正交试验因素水平表Table 2 Factors and levels of the orthogonal test
(2)人体粪便样品制备:用无菌采样袋和灭菌药匙收集5名年龄为23~27岁健康志愿者的新鲜粪便样品,所有志愿者身体状况良好,且在试验前至少6个月内未使用过抗生素。将粪便样品等量均匀混合后,立即用已灭菌的1 mmol·L-1pH 值7.0的磷酸盐缓冲液(phosphate buffered saline,PBS)按照 1∶5的比例(m∶v) 进行稀释。
(3)基础培养基配制:参考Ramnani等[18]和胡婕伦[19]的方法,并略作修改。基础培养基的营养成分配比:4.5 g·L-1NaCl、0.01 g·L-1MgSO4·7H2O、0.01 g·L-1CaCl2、2.5 g·L-1KCl、2 g·L-1NaHCO3、0.04 g·L-1K2HPO4、0.04 g·L-1KH2PO4、3 g·L-1蛋白胨、3 g·L-1胰蛋白胨、4.5 g·L-1酵母膏、10 μL·L-1维生素K1、0.5 g·L-1胆盐3号、0.5 g·L-1L-半胱氨酸盐酸盐、0.05 g·L-1氯高铁血红素、2 mL·L-1吐温80。上述所有成分溶解后,将pH值调至7.0并灭菌(120℃,20 min),备用。
(4)体外模拟肠道发酵:参考Guergoletto等[17]的方法,并略作修改。采用严格厌氧条件,向已灭菌的发酵瓶中加入40 mL基础培养基和5 mL粪便稀释液,然后加入冻干后的米糠消化产物使其最终含量为 2%(m∶v),涡旋混匀,充入N21 min后封口。将所有发酵瓶放入厌氧发酵罐,于37℃ 恒温培养24 h,取3 mL发酵液测定肠道菌群数量和短链脂肪酸含量。从粪便采集至开始发酵尽量在30 min内完成。阳性对照组中加入等量菊粉,空白组中不添加碳源。
1.3.8 肠道菌群数量测定 利用实时荧光定量PCR检测肠道菌群数量,测定发酵液中双歧杆菌、乳酸杆菌、拟杆菌和肠杆菌数量[20]。取3 mL发酵24 h的发酵液,11 000 r·min-1离心20 min,沉淀物用于检测发酵液中双歧杆菌、乳酸杆菌、肠杆菌及拟杆菌数量。根据双歧杆菌、乳酸杆菌[21]、拟杆菌和肠杆菌[17]16S rDNA 基因序列设计特异性PCR引物,取标准菌株DNA和发酵液样品DNA进行常规PCR反应,检测引物特异性。

表3 实时荧光定量PCR引物序列Table 3 Primer sequence of quantitative real-time PCR
1.3.9 短链脂肪酸(short chain fatty acid, SCFA)含量测定 参照倪香艳[22]的方法。取3 mL发酵24 h后的发酵液,40℃、11 000 r·min-1离心20 min后,收集上清液用于短链脂肪酸含量测定。
气相色谱条件:色谱柱:DB-FFAP(15 cm×0.32 mm×0.25 μm);柱温:100℃,2℃·min-1升温至120℃,保持10 min;进样口温度:250℃;检测器温度:280℃;恒压:21.8 kPa;分流比:1∶50;进样量:2 μL。
1.4 数据分析
采用SPSS 19.0进行数据分析;采用Origin 9.0 制图;采用单因素方差分析显著性(Duncan′s multiple range test),显著性水平为0.05。
2 结果与分析
2.1 过热蒸汽稳定化米糠结果分析
由图1可知,当过热蒸汽处理时间相同时,随着温度升高,米糠脂肪酶失活率呈上升趋势;且随着处理时间的延长,相同处理温度下米糠脂肪酶失活率呈上升趋势。当过热蒸汽处理温度为160℃、处理时间为2 min时,米糠脂肪酶失活率达到最高,为88.01%。综上,过热蒸汽160℃处理2 min为米糠稳定化的最佳条件。

图1 过热蒸汽处理对米糠脂肪酶活力的影响Fig.1 Effect of superheated steam treatment on lipase activity of rice bran
2.2 菌种筛选结果分析
由图2可知,3种菌种经不同发酵时间后米糠SDF得率存在明显差异。在24、36、48和60 h发酵时段,甜香型菌种的米糠SDF得率最高,且在发酵48 h时达到最高值,为4.66%。在36、48 60 h发酵时段,酒香型菌种的米糖SDF得率仅次于甜香型菌种,其最高为4.47%。表明酒香型和甜香型菌种发酵米糠SDF得率高于风味型菌种。

图2 菌种类型对发酵米糠产物SDF得率的影响Fig.2 Effect of strain type on SDF yield of fermented rice bran
由图3可知,酒香型和甜香型菌种发酵的米糠感官总分较高,其中甜香型菌种发酵的米糠经48 h发酵后,其感官评价总分最高(90.0);风味型菌种经72 h发酵后米糖感官总分最低,为65.0分。由图4经发酵48 h后米糖感官评分可知,不同菌种发酵的米糠在色泽、质地方面的差异较小,在气味、酸甜度及风味等方面的差异较大。综上,甜香型菌种发酵米糠在气味、酸甜度和风味等方面评分均最高,其次为酒香型菌种。因此,选取甜香型米根霉作为米糠最佳发酵菌种进行后续试验。

图3 菌种类型对发酵米糠感官总分的影响Fig.3 Effect of strain type on sensory total score of fermented rice bran

图4 菌种类型对发酵米糠各项感官分数的影响Fig.4 Effect of strain type on the sensory components of fermented rice bran
2.3 单因素试验结果分析
2.3.1 料液比对米糠SDF得率的影响 由图5可知,当料液比小于1∶2.25时,随着加水量的增加,米糖SDF得率升高,当料液比为1∶2.25时,米糠SDF得率达到最高,继续增加料液比,米糠SDF得率降低。这可能与米根霉发酵时对底物的含水量有一定要求相关,加水量过少会导致菌体与底物接触不充分,导致发酵不够彻底;当含水量达到一定程度后,继续提高料液比,发酵底物逐渐被稀释,且米糠吸水膨胀,导致底物透气性下降,从而影响发酵效果[23]。本试验中,料液比为1∶2.00的米糠SDF得率与料液比1∶2.25无显著差异。因此考虑米糠发酵的经济节约性,确定米根霉发酵米糠最适料液比为1∶2.00。

注:不同小写字母表示差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level. The same as following.图5 料液比对米糠SDF得率的影响Fig.5 Effect of solid-liquid ratio on SDF yield of rice bran
2.3.2 接种量对米糠SDF得率的影响 由图6可知,当米根霉接种量低于0.50%时,随着接种量的增加,米糖SDF得率显著增加,这可能是由于米根霉发酵产生的纤维素酶增加,将更多的不溶性膳食纤维(insoluble dietary fiber,IDF)降解为小分子多糖所致;当米根霉接种量大于0.50%时,米糖SDF得率未显著增加,这可能是因为当接种量继续增加时,米根霉菌体生长旺盛,菌体之间相互竞争激烈,导致底物中营养物质不足,致使菌体发酵能力降低[24]。因此,确定米根霉发酵米糠最佳接种量为0.50%。
2.3.3 发酵时间对米糠SDF得率的影响 由图7可知,随着米根霉发酵时间的延长,米糠SDF得率整体呈先上升后下降的趋势。当发酵时间大于36 h时,米糠SDF得率增加缓慢,当发酵时间为48 h时,米糠SDF得率最高,随后SDF得率开始下降。这可能是由于米糠经48 h发酵后,底物中的营养物质等被消耗,不足以维持菌体生长,导致米根霉发酵能力降低,产酶能力下降[8];此外,随着发酵时间的延长,底物pH值逐渐降低,也可能会影响菌体生长。因此,确定米根霉发酵米糠最适时间为36 h。

图7 发酵时间对米糠SDF得率的影响Fig.7 Effect of fermentation time on SDF yield of rice bran
2.3.4 发酵温度对米糠SDF得率的影响 由图8可知,随着发酵温度的升高,米糠SDF得率逐渐增加,当发酵温度为40℃时,米糠SDF得率最高,为4.75%。这可能是因为温度过低时,菌体生长缓慢,产酶能力降低;而适当的高温能够促进菌体的生长,其释放的酶类活性也相应升高,致使米糠SDF得率上升。但考虑到米根霉发酵的最适温度,最终确定米根霉发酵米糠最适温度为35℃。

图8 发酵温度对米糠SDF得率的影响Fig.8 Effect of fermentation temperature on SDF yield of rice bran
2.4 正交试验结果分析
由表4、5可知,米糠SDF得率的极差分析得到影响米糠SDF得率因素的主次排序:B>C>A>D,最佳发酵条件:料液比1∶2.25、接种量0.7%、35℃下发酵24 h;感官总分的极差分析得到影响米糠SDF得率因素的主次排序:B>C>D>A,最佳发酵条件:料液比1∶1.00、接种量0.5%、35℃下发酵36 h。综合考量,选取最优组合为A4B4C1D3,即各因素最优水平为料液比1∶2.25、接种量0.7%、35℃和24 h发酵。
2.5 发酵米糠肠道益生活性结果分析
2.5.1 肠道菌群数量分析 双歧杆菌、乳酸杆菌等益生菌对保持宿主肠道正常微生态环境具有非常重要的作用。由图9可知,在最佳发酵工艺条件下,米糠消化产物经体外24 h发酵后,发酵米糠添加组双歧杆菌和乳酸杆菌数量的对数值分别为6.85和5.23,显著低于阳性对照组(菊粉组);与阴性对照组(空白组24 h)相比,未发酵米糠添加组与发酵米糠添加组的拟杆菌数量均显著降低,且发酵米糠添加组显著低于未发酵米糠添加组。肠杆菌是肠道中常见的致病菌[25]。体外发酵24 h期间,与阴性对照组(空白组24 h)相比,发酵米糠添加组与未发酵米糖添加组体外发酵液中肠杆菌数量均明显升高,且发酵米糠添加组对肠杆菌的抑制作用明显优于未发酵米糠添加组。表明经甜香型米根霉发酵后的米糠,在维持肠道健康方面的效果显著优于未发酵米糠。

注:不同小写字母表示同一菌不同组之间差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference between the same bacteria in different groups at 0.05 level.图9 米糠体外消化产物肠道菌群数量分析Fig.9 Analysis of intestinal flora of rice bran digesting products in vitro
2.5.2 SCFAs含量分析 碳水化合物在肠道中经肠道菌发酵后会产生代谢终产物CFAs[26]。SCFAs作为宿主的能量来源,有利于维持宿主健康的肠道微生态环境[27]。由表6可知,体外发酵24 h后,与阴性对照组(空白组24 h)相比,发酵米糠添加组发酵液中的乙酸、丙酸、丁酸含量均显著升高,发酵米糠添加组和未发酵米糠添加组对SCFAs总量的促进作用均显著高于阳性对照组(菊粉),且发酵米糠添加组的发酵液中SCFAs总量显著高于未发酵米糠添加组。表明,甜香型米根霉发酵米糠与未发酵米糠对SCFAs含量均有显著影响,前者对SCFAs含量的促进作用更明显。

表4 米根霉发酵米糠正交试验结果Table 4 Results of orthogonal test of hizopus oryzae fermenting rice bran

表5 方差分析表Table 5 Analysis of variance
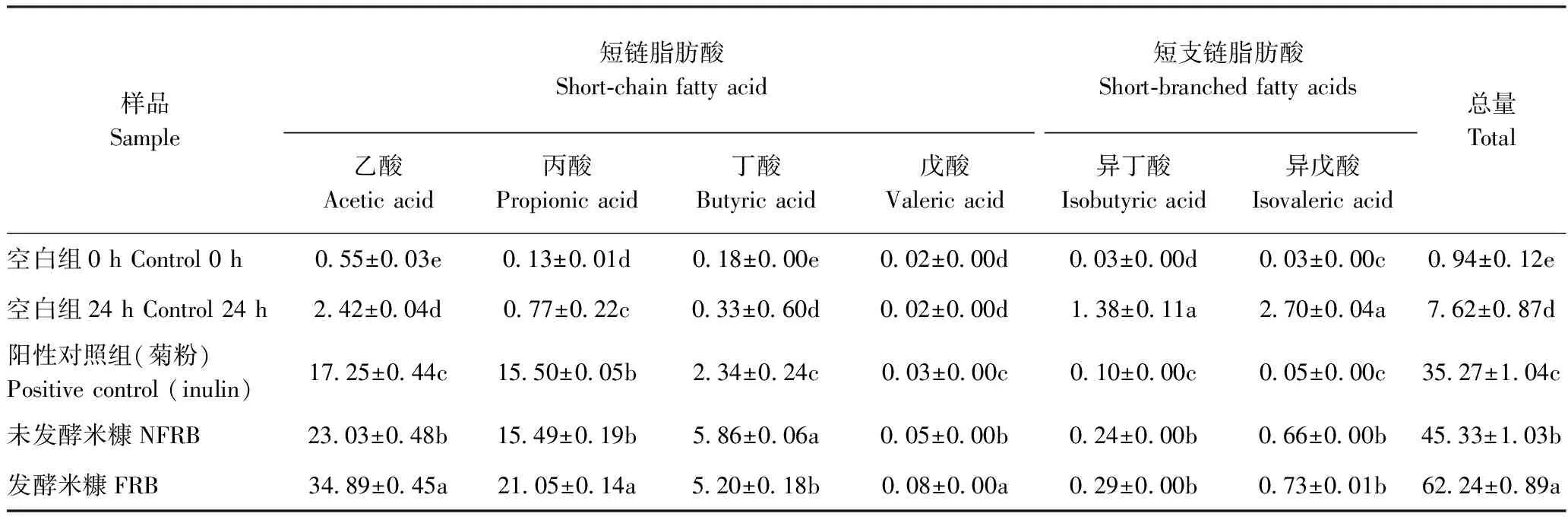
表6 米糠体外消化产物短链脂肪酸含量分析Table 6 Analysis of short-chain fatty acids content ofrice bran digesting products in vitro /(mmol·L-1)
3 讨论
本研究发现采用过热蒸汽对米糠进行稳定化处理,随着处理温度的升高及处理时间的延长,脂肪酶活力逐渐降低,当米糠经过热蒸汽160℃处理2 min时,脂肪酶失活率达到最高,为88.01%,继续延长处理时间并不能使脂肪酶失活率继续上升。这是由于部分脂溶性酶类的耐热性极强,很难钝化,如磷脂酶、糖酶以及酯酶等[28]。胡迪[29]采用过热蒸汽160℃处理米糠2 min,其脂肪酶的失活率为86.59%,与本研究结果类似。本试验还发现,当温度继续升高会导致米糠变焦黄色,同时米糠特有香味变淡,且温度过高造成能耗大幅度增加。
本研究以发酵米糠的SDF得率和感官评分为指标,从酒香型、甜香型、风味型3种米根霉菌种中筛选出甜香型米根霉为最佳发酵菌种,根据单因素试验和正交试验结果,确定最佳发酵条件为甜香型米根霉为发酵菌种,料液比为1∶2.25,接种量0.7%、发酵温度35℃、发酵时间24 h,此条件下SDF得率为5.83%。
研究表明谷物在体内外对肠道微生态具有良好的调节作用[25]。本研究发现,与未发酵米糖相比,发酵米糠对双歧杆菌和乳酸杆菌均有显著的增殖效果,本研究还发现,米糠能够促进肠道益生菌产生SCFAs,且促进效果显著高于阳性对照组(菊粉),同时经米根霉发酵米糠的促进作用显著高于未发酵米糠。Arcila等[30]以麦麸为原料通过体外厌氧发酵24 h发现SCFAs含量增加1.4倍;Saya等[31]研究发现植物乳杆菌发酵米糠与未发酵米糠对小鼠肠道菌群有不同程度的影响;张媛等[32]报道双歧杆菌能够将脱脂小米糠作为碳源加以利用,从而促进小鼠肠道内双歧杆菌的增殖;Junna等[33]发现米糠能够促进乳酸杆菌的生长,上述研究均与本研究结果一致。这可能是由于米糠经米根霉发酵后将更多的不可溶膳食纤维降解转化为可溶膳食纤维,更有利于双歧杆菌、乳酸杆菌等有益菌的利用;同时发酵改性后的米糠,可显著提高体外发酵过程中有机酸的含量,从而降低肠道pH值,在一定程度上抑制肠杆菌的生长。
4 结论
本研究通过对米根霉发酵米糠工艺优化确定了最佳发酵条件为:料液比1∶2.25、接种量0.7%、发酵温度35℃,发酵时间24 h,在此条件下,米糠SDF得率为5.83%,比发酵前提高了近一半。另外,通过甜香型米根霉发酵米糠与未发酵米糠的对比发现,米根霉发酵米糠的肠道益生活性显著增强,可有效促进双歧杆菌(对数值6.85)和乳酸杆菌(对数值5.23)的增殖;且总短链脂肪酸含量显著提高。本研究为米糠的加工提供了指导,通过米根霉发酵的米糠可作为一种有潜力的功能性配料用于食品中,对今后米糠在发酵方面的应用具有一定的指导意义。
