铝胁迫下外源抗坏血酸对水稻幼苗抗氧化性能的影响
2020-12-02周小华周泽仪李昆志
周小华 周泽仪 李昆志
(1 昆明学院昆明滇池(湖泊)污染防治合作研究中心,云南 昆明 650214;2 华南农业大学资源环境学院,广东 广州 510000;3 昆明理工大学生命科学与技术学院,云南 昆明 650500)
酸性土壤占全球可耕面积的50%[1],其中我国酸性土壤占全国可耕面积的21%[2]。当土壤pH值低于5.5时,土壤中难溶性铝可溶解释放出Al3+,微摩尔级Al3+即可对植物造成毒害,严重抑制根系的生长以及氮、磷等营养物质的吸收[3],导致水稻[4]、大豆[5]等作物减产。我国约有30%的水稻生长在酸性土壤中,铝毒已成为水稻生长及产量的重要限制因素之一。
抗坏血酸(ascorbic acid,AsA)是植物体内重要的非酶抗氧化物质,可维持植物逆境条件的氧化还原平衡及物质代谢,促进种子萌发及幼苗生长[6-7]。已有研究表明,外源AsA可改善盐胁迫下商麦1619种子的抗氧化酶活性和发芽率[8],提高铅胁迫下秋葵的抗氧化能力[9],降低铬胁迫下小麦的活性氧(reactive oxygen species,ROS)含量,有效减轻根系细胞受铬的毒害程度[10],提高盐胁迫下大麦的脯氨基含量[11],提高Na2SO4胁迫下燕麦幼苗活力指数和根长[12],改善逆境条件下植物的生长状态。然而,外源AsA对铝胁迫下水稻抗氧化能力的影响尚不清楚,本研究以四叶龄水稻幼苗为试验材料,探讨铝胁迫下添加外源AsA对根尖过氧化氢(hydrogen peroxide,H2O2)、丙二醛(malondialdehyde,MDA)含量、渗透调节物质含量、抗氧化酶活性等指标的影响,研究外源AsA在水稻抵御逆境胁迫过程中的作用及生理生化影响机制,以期为外源AsA在缓解水稻铝毒方面的应用提供科学支撑。
1 材料与方法
1.1 试验材料
供试水稻(OryzasativaL.)品种为滇优5号,由云南农业大学水稻研究所提供。
1.2 试验设计
选取长势一致的水稻幼根,用pH值4.5的0.05 mmol·L-1CaCl2溶液预处理12 h后,再转移至铝离子浓度为0(CK)、20、50、100、200、400 μmol·L-1的AlCl3营养液(内含CaCl2,pH值4.5)处理3~24 h。每组10个重复,用于测量相对根伸长量及进行染色试验。
将发芽的种子用pH值4.5,1/4浓度的水稻营养液(IRRI,国际水稻所)培养至一叶龄幼苗,然后用pH值4.5的水稻全营养液培养[13],每2 d更换一次营养液,于25℃、光照(1 200 μmol·m-2·s-1)12 h·d-1的温室中,置于盛有3.5 L营养液的塑料盆中进行漂浮培养。水稻长至四叶龄时,在AsA浓度分别为0、0.5、1、2、4、8 mmol·L-1,pH值4.5的水稻全营养液中添加50 μmol·L-1AlCl3处理24 h,分析根尖H2O2含量,以确定AsA最佳处理浓度。以无铝无AsA处理为对照(CK),在铝浓度分别为0、50、100、200、400 μmol·L-1水稻全营养液中,添加AsA最佳浓度处理水稻24 h,每组3个重复。收集根尖(0~20 mm),用于测定H2O2含量、MDA含量、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性、超氧化物歧化酶(superoxide dismutase, SOD)活性、过氧化氢酶(catalase, CAT)活性、超氧化物歧化酶(superoxide dismutase, SOD)活性、根系活力、内源AsA含量、脯氨酸含量、可溶性蛋白质含量和可溶性糖含量。
1.3 测定项目与方法
1.3.1 相对根伸长率 直尺测量不同铝浓度处理3、6、12、18、24 h时前后幼根的长度,前后2次测量值的差值即为幼苗根的伸长量,相对根伸长率=铝胁迫处理不同时间根的净伸长量/CK根净伸长量×100%。
1.3.2 铬天青染色 分别取不同铝浓度溶液(pH值4.5)处理24 h的水稻幼根,去离子水浸洗2~3次,去除表面的残留铝,然后置于0.1%铬天青染色液染色15 min,浸洗至溶液为无色,显微镜观察根尖的染色情况。
1.3.3 生理生化指标的测定 参照Gay等[14]的方法测定H2O2含量;参照Chen等[15]的方法测定MDA含量;参照陈建勋等[16]的方法测定POD、SOD、APX、CAT活性,根系活力以及脯氨酸、可溶性蛋白质和可溶性糖含量;参照李媚等[17]的方法测定内源AsA含量。
1.4 数据处理
用Excel 2007处理数据并作图,使用SPSS 21.0软件采用Duncan,s法分析数据差异性(P<0.05)。
2 结果与分析
2.1 水稻耐铝性分析
由图1-A可知,水稻的相对根伸长率随着铝胁迫浓度增加及胁迫时间的延长而降低,50~400 μmol·L-1铝胁迫处理组的相对根伸长率为CK的0.80~0.48倍,相对根伸长率基本与铝胁迫24 h的根生长表型一致(图1-B)。由图2-A可知,根尖铝含量随着铝胁迫浓度增加而增加,根尖铬天青特异性染色深度(图2-B)与根尖铝含量呈正相关关系,浓度≤50 μmol·L-1铝胁迫处理组水稻的根尖区域染色相对较浅,而浓度>50 μmol·L-1铝胁迫处理组水稻的根尖颜色随着浓度增加逐渐加深,并出现损伤性裂纹,说明根的完整性受到破坏。
2.2 不同外源AsA浓度对铝胁迫水稻根尖H2O2含量的影响
由图3可知,与单一铝胁迫组相比,AsA处理组根尖H2O2含量均有不同程度的降低,外源AsA浓度≥1 mmol·L-1时,根尖H2O2含量均显著低于单一铝胁迫组,其中2、4、8 mmol·L-1AsA处理组根尖的H2O2含量均显著低于1 mmol·L-1AsA处理组,但三组之间的H2O2含量无显著差异。表明2 mmol·L-1的外源AsA能有效地降低根尖H2O2含量,因此,采用2 mmol·L-1的外源AsA进行后续试验。
2.3 外源AsA对铝胁迫水稻根系活力的影响
由图4可知,水稻根系活力随铝胁迫浓度增加而减小,50 μmol·L-1铝胁迫处理组的根系活力是CK的0.79倍,外源AsA+50 μmol·L-1铝胁迫处理组的根系活力则恢复到CK的0.93倍,且与CK无显著差异,是单一铝胁迫处理组根系活力的1.18倍;400 μmol·L-1铝胁迫处理组的根系活力仅为CK的0.40倍,外源AsA+400 μmol·L-1铝胁迫处理组的根系活力则恢复到CK的0.45倍,是单一铝胁迫处理组根系活力的1.12倍。表明外源AsA可以显著提高水稻根系活力。
2.4 外源AsA对铝胁迫水稻根尖H2O2及MDA含量的影响
铝胁迫下水稻根尖H2O2和MDA含量与铝浓度呈正相关关系,50 μmol·L-1铝胁迫处理组根尖的H2O2(图5-A)和MDA(图5-B)含量分别为CK的1.55和1.86倍,外源AsA+50 μmol·L-1铝胁迫处理组根尖的H2O2和MDA含量降低至CK的1.15和1.51倍,是单一铝胁迫处理组的0.74和0.81倍;400 μmol·L-1铝胁迫处理组根尖的H2O2和MDA含量分别为CK的2.53和4.16倍,外源AsA+400 μmol·L-1铝胁迫处理组根尖的H2O2和MDA含量降低至CK的2.04和3.69倍,是单一铝胁迫处理组的0.81和0.89倍。表明铝胁迫增加了根尖H2O2和MDA含量,外源AsA可有效降低根尖H2O2的积累和膜脂过氧化程度。

注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference among treatments at 0.05 level. The same as following.图1 铝胁迫处理水稻的相对根伸长率(A)及根系生长表型(B)Fig.1 Relative root enlongth(A) and phenotype(B) of rice roots under Al3+stress
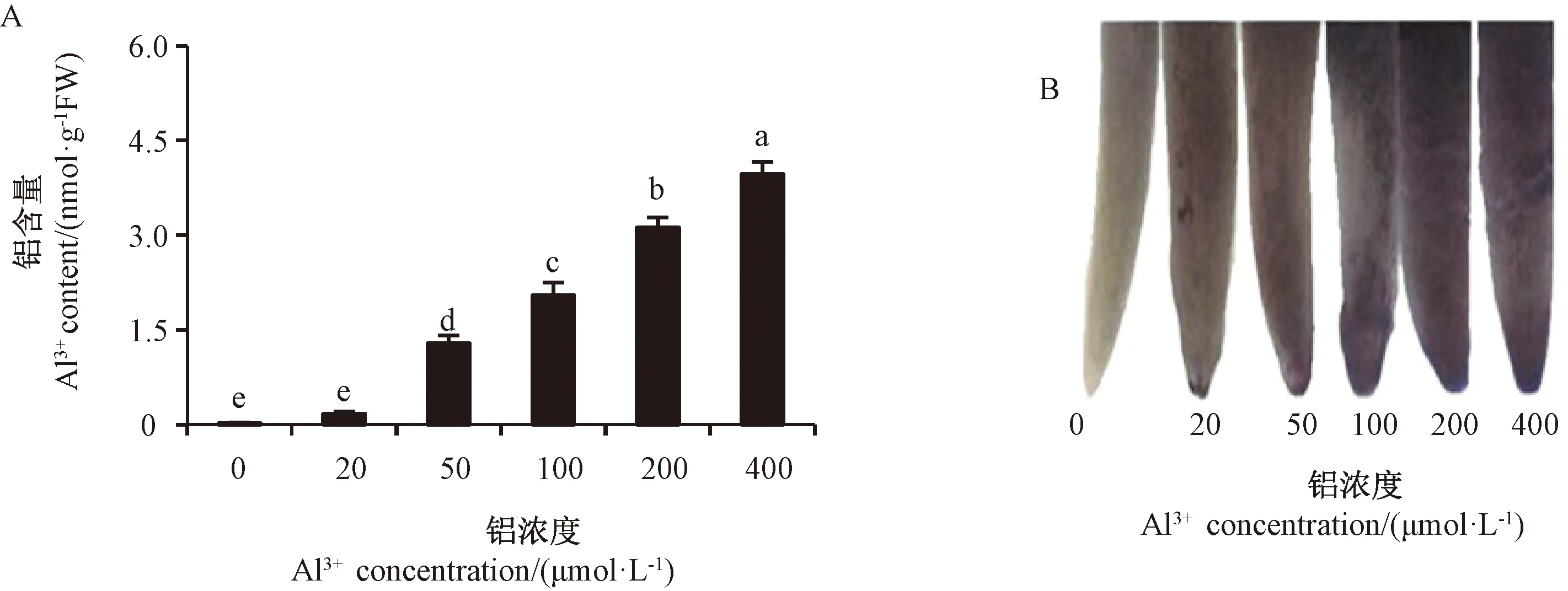
图2 铝胁迫处理水稻根尖铝含量(A)及铬天青染色(B)Fig.2 The Al3+ content(A) and chromazurol staining(B) of rice root tips under Al3+ stress
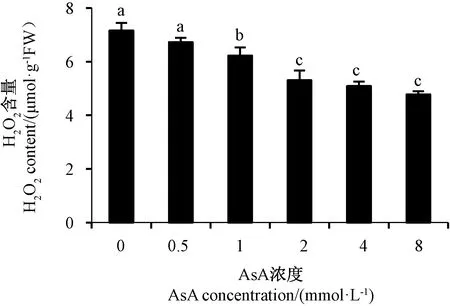
图3 外源AsA浓度对铝胁迫水稻根尖H2O2含量的影响Fig.3 Effects of exogenous AsA concentration on the content of H2O2 in rice root tips under Al3+ stress
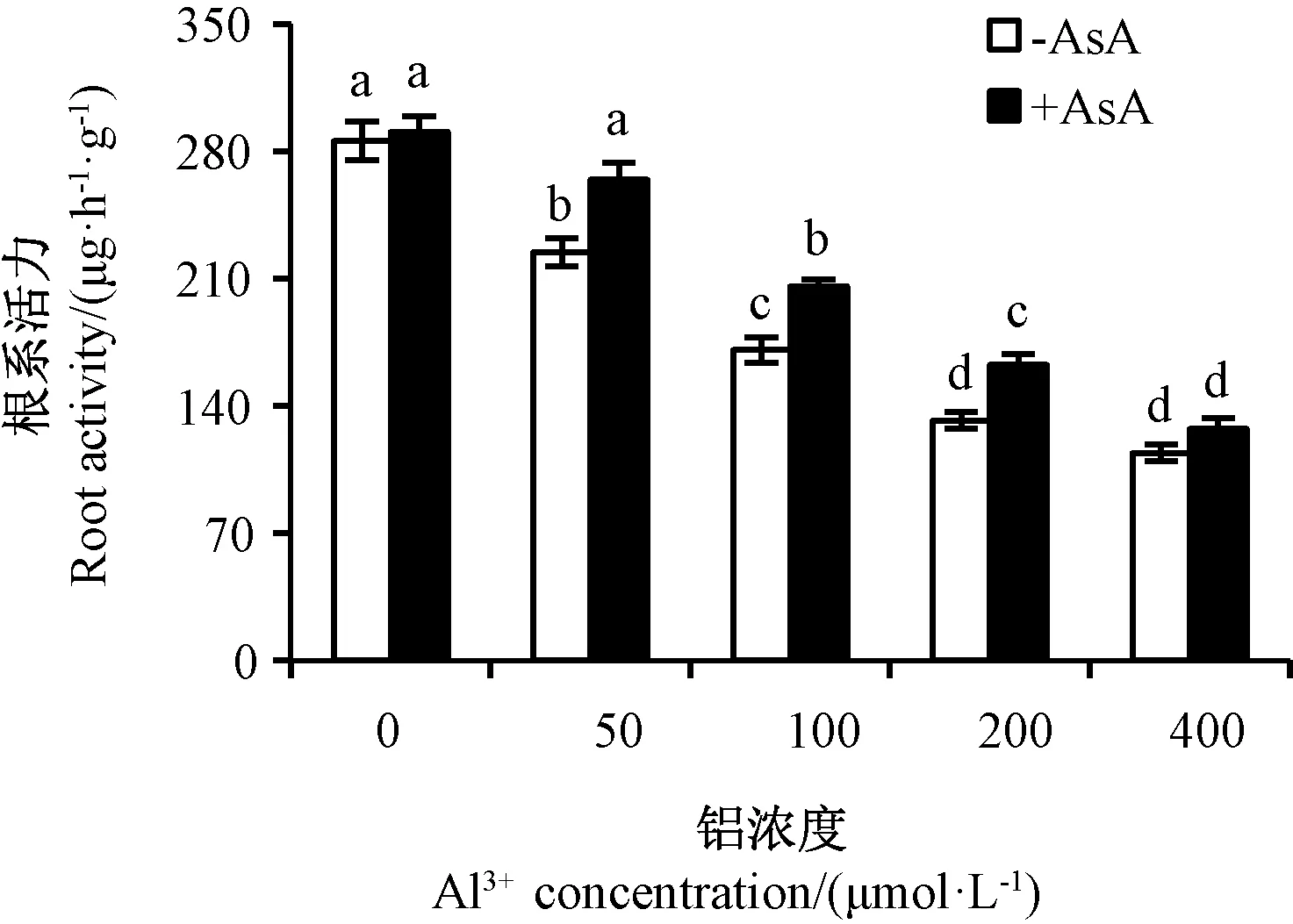
图4 外源AsA对铝胁迫水稻根系活力的影响Fig.4 Effects of exogenous AsA on root activity in rice under Al3+ stress
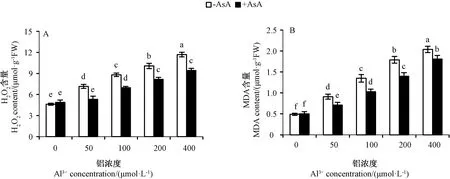
图5 外源AsA对铝胁迫水稻根尖H2O2(A) 与MDA(B)含量的影响Fig.5 Effects of exogenous AsA on H2O2 (A)and MDA (B)content in rice root tips under Al3+ stress

图6 外源AsA对铝胁迫水稻根尖可溶性蛋白质(A)、可溶性糖(B)及游离脯氨酸含量(C)的影响Fig.6 Effects of exogenous AsA on the contents of the souble protein(A), soluble sugar(B) and free proline(C)in rice root tips under Al3+ stress
2.5 外源AsA对铝胁迫水稻根尖可溶性蛋白质、可溶性糖及脯氨酸含量的影响
随着铝胁迫浓度增加,水稻根尖可溶性蛋白质含量显著降低(图6-A),可溶性糖和游离脯氨酸含量(图6-B、C)显著增加。50 μmol·L-1铝胁迫处理组根尖的可溶性蛋白质、可溶性糖及脯氨酸含量分别为CK的0.65、1.61和1.65倍;外源AsA+50 μmol·L-1铝胁迫处理组根尖的可溶性蛋白质、可溶性糖及脯氨酸含量分别为CK的0.75、1.87和2.29倍,是单一铝胁迫处理组的1.15、1.16和1.39倍;400 μmol·L-1铝胁迫处理组根尖的可溶性蛋白质、可溶性糖及脯氨酸含量分别为CK的0.32、2.02和2.73倍;外源AsA+400 μmol·L-1铝胁迫处理组根尖的可溶性蛋白质、可溶性糖及脯氨酸含量分别为CK的0.37、2.12和2.96倍,是单一铝胁迫处理组的1.16、1.05和1.09倍。表明外源AsA可提高铝胁迫下根尖可溶性蛋白质、可溶性糖及脯氨酸等渗透物质的含量,有利于维持铝胁迫下的质膜渗透平衡。
2.6 外源AsA对铝胁迫水稻根尖SOD、POD、CAT和APX活性的影响
由图7可知,50 μmol·L-1铝胁迫处理组根尖的SOD、POD、CAT和APX活性分别是CK的1.77、1.81、1.76和1.73倍,外源AsA+50 μmol·L-1铝胁迫处理组的SOD、POD、CAT和APX活性分别提高至CK的2.24、2.20、2.28和2.13倍,是单一铝胁迫处理组的1.26、1.22、1.30和1.13倍;400 μmol·L-1铝胁迫处理组的SOD、POD、CAT和APX活性分别是CK的2.39、2.42、2.76和2.56倍,外源AsA+400 μmol·L-1铝胁迫处理组的SOD、POD、CAT和APX活性分别提高至CK的2.48、2.63、2.90和2.89倍,是单一铝胁迫处理组的1.04、1.09、1.05和1.13倍。铝胁迫能提高根尖抗氧化酶的活性,外源AsA能加强这种提升效果,清除更多的ROS,表明外源AsA可以提高根尖抗氧化酶的活性,以增强植株清除ROS的能力。
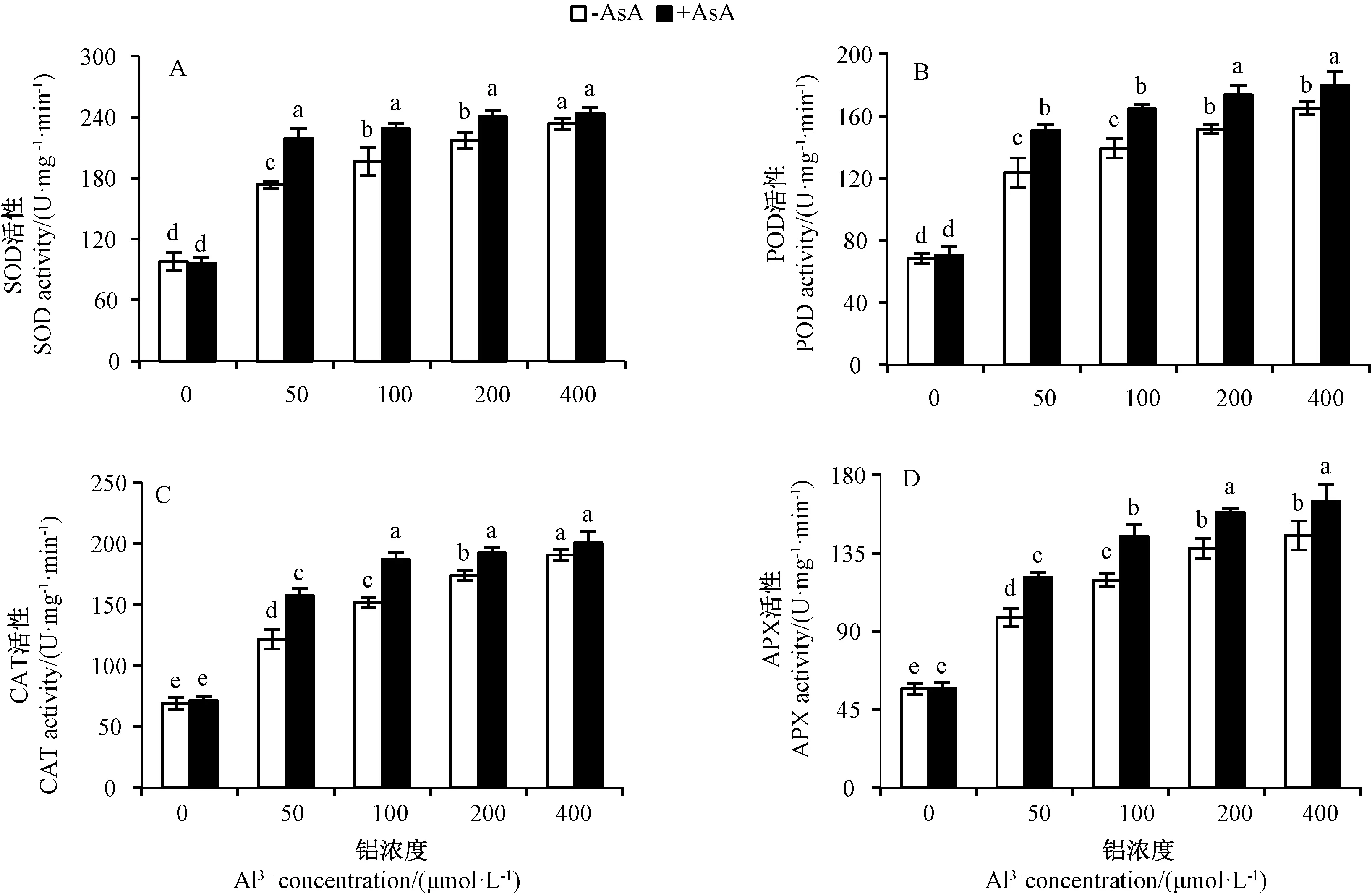
图7 外源AsA对铝胁迫水稻根尖SOD(A)、POD(B)、CAT(C)及APX(D)活性的影响Fig.7 Effects of exogenous AsA on the activities of SOD(A), POD(B), CAT(C) and APX(D) in rice root tips under Al3+ stress

图8 外源AsA对铝胁迫水稻根尖内源AsA含量的影响Fig.8 Effects of exogenous AsA on content of endogenous AsA in rice root tips under Al3+ stress
2.7 外源AsA对铝胁迫水稻根尖内源AsA含量的影响
AsA是植物体内重要的抗氧化物质,植物抵抗非生物胁迫的能力与AsA含量呈正相关关系[18]。由图8可知,根尖内源AsA含量随着铝胁迫浓度增加而降低,50 μmol·L-1铝胁迫处理组根尖的内源AsA含量为CK的0.93倍,外源AsA+50 μmol·L-1铝胁迫处理组根尖的内源AsA含量为CK的1.32倍,为单一铝胁迫处理组的1.42倍;400 μmol·L-1铝胁迫处理组根尖的内源AsA含量为CK的0.47倍,外源AsA+400 μmol·L-1铝胁迫处理组根尖的内源AsA含量为CK的0.54倍,为单一铝胁迫处理组的1.14倍。说明铝胁迫降低了水稻根尖的内源AsA含量,而外源AsA提高了水稻根尖的内源AsA含量。
3 讨论
植物根尖是受铝胁迫作用的最初部位,铝能够与作物根尖细胞结合,影响根尖细胞的分裂与伸长,导致根尖变短变粗,常用相对根伸长率及铬天青特异性染色来判断植物耐铝能力。本研究表明,水稻的相对根伸长率随着铝浓度的增加和处理时间的延长均降低,铬天青染色深度与根尖铝含量呈正相关关系,浓度≤50 μmol·L-1铝胁迫处理组根尖铬天青染色相对较浅,水稻根的生长虽然受到一定程度的抑制,但仍能维持生长;而浓度>50 μmol·L-1铝胁迫处理组根尖铝含量逐渐增加,铬天青染色加深,根形态变粗且有裂纹,相对根伸长率逐渐降低,表明铝胁迫已经逐渐破坏水稻根系结构,严重抑制了根的生长。水稻根尖累积了一定量的铝后,会产生毒害作用,导致根系活力下降,抑制水稻根的生长,这与黄玉婷等[19]关于铝胁迫抑制根生长的研究结果相似。
H2O2是植物氧化损伤的主要指标,MDA是质膜过氧化的产物,H2O2、MDA含量可以反映质膜过氧化水平及植物抗逆能力[20]。已有研究表明,铝胁迫会诱导植物根尖质膜过氧化,破坏细胞膜结构,导致植物大量积累H2O2等ROS[21-23]。本研究表明,铝胁迫导致根尖H2O2和MDA含量显著上升,水稻根系的氧化损伤程度随铝浓度增加而加剧,致使根系积累较多的H2O2。这与铝胁迫下玉米、水稻中H2O2和MDA含量的变化趋势相似[24-25],也反映出微摩尔级的铝即可对植物造成伤害[26]。此外,施用外源AsA能在一定程度上降低H2O2和MDA含量,这与Ashraf等[27]研究外源AsA降低盐胁迫下小麦体内ROS的结果一致,表明外源AsA可以提高清除ROS的能力,缓解铝胁迫对水稻质膜的过氧化伤害,有效地维持幼苗正常的生理生化反应,提高水稻的耐铝能力。
可溶性蛋白质和脯氨酸含量与细胞的渗透平衡和质膜结构的完整性具有一定的相关性,植物积累的可溶性蛋白质和脯氨酸越多,表示其抗逆能力越强[28]。本研究表明,根尖可溶性蛋白质含量随着铝胁迫浓度增加而降低,脯氨酸含量随着铝胁迫浓度增加而增加,可能是由于铝胁迫加剧了根尖细胞质膜过氧化程度,使蛋白质分解加快,合成受阻,含量降低,通过增加脯氨酸含量来维持质膜的结构完整及渗透平衡,这与韩德鹏等[29]研究铝胁迫降低了油菜叶片可溶性蛋白质含量,提高了脯氨酸含量的结果相似;施用外源AsA可提高可溶性蛋白质和脯氨酸含量,可能是外源AsA促进了蛋白质的水合作用,进而提高了可溶性蛋白质含量,提高脯氨酸含量可能有助于调节和维持细胞氧化还原势和渗透压,从而减少质膜的损伤。表明外源AsA能够提高水稻体内渗透调节物质的含量,维持细胞质膜的渗透平衡与结构完整,从而提高对质膜的保护作用,降低铝胁迫对水稻幼苗生长的不利影响。
在环境胁迫下,植株为了抵御自由基引发的氧化胁迫,会启动体内的抗氧化酶系统,通过提高SOD、POD、APX及CAT活性清除ROS,从而减轻逆境胁迫对植物的伤害程度[30]。本研究发现铝胁迫可提高水稻的抗氧化酶活性,表明铝胁迫在诱导氧化胁迫的同时,也诱导了抗氧化酶基因的表达,使抗氧化酶活性增加,清除更多的ROS,以缓解铝诱导的氧化损伤,这与吴雪霞等[31]报道的铝胁迫下柑橘中抗氧化酶活性增加的研究结果一致;施用外源AsA使铝胁迫水稻根尖SOD、POD、APX及CAT活性进一步增强,可能是AsA通过上调抗氧化酶相关基因的表达提高了抗氧化酶活性[32],该研究结果与Dolatabadian等[33]发现外源AsA提高干旱胁迫玉米的抗氧化酶活性的结果相似。本研究中,铝胁迫导致水稻内源AsA含量减少,说明AsA可能直接参与清除铝胁迫诱导的ROS或铝胁迫可能抑制水稻内源AsA的生物合成,这与Sharma等[34]关于铝胁迫降低水稻AsA含量的研究结果一致;而施用外源AsA可提高铝胁迫水稻的内源AsA含量,可能是外源AsA促进了内源AsA的生物合成和循环再生[35],这与Wang等[36]研究的外源AsA可提高水稻根系AsA含量的结论一致。可见外源AsA通过调节抗氧化酶活性和AsA含量来调控水稻铝胁迫的应答机制。但外源AsA对铝胁迫的缓解作用是通过调控相关抗氧化酶基因的表达起主要作用,还是直接上调内源AsA的合成以平衡铝诱导的ROS占主导地位,还有待进一步探究。
4 结论
本研究结果表明,铝胁迫诱导水稻幼苗产生氧化损伤,且氧化损伤程度与铝浓度呈正相关关系,外源AsA通过上调铝胁迫水稻根尖抗氧化酶活性及内源AsA含量,增强ROS的清除能力,显著降低了膜脂过氧化产物的含量,并提高了可溶性蛋白质、脯氨酸等渗透调节物质的含量,使其保持在较稳定的高水平状态,维持稳定的细胞膜结构及渗透平衡,可有效缓解铝胁迫对幼苗质膜的毒害作用,增强水稻的抗氧化能力。本研究结果为外源AsA在改善酸铝条件下水稻生长方面的应用提供了理论依据。
