肺结节病的诊治进展
2020-12-01张倩黄慧徐作军
张倩 黄慧 徐作军
结节病是一种病因未明的全身性肉芽肿疾病,通常累及多个系统或器官,临床以呼吸系统受累最为常见,常表现为双侧肺门淋巴结肿大和肺内浸润。多数结节病患者预后较好,甚至可自行缓解。结节病的死亡率约为7.6%,其中半数是由于肺纤维化[伴或不伴肺动脉高压(PH)]进展致死,其次是心脏结节病、中枢神经系统受累及肝脏受累。目前研究认为,结节病的发病机制与患者遗传易感性及环境因素的共同作用相关。约20%~70%的结节病患者需要系统性治疗,包括糖皮质激素及免疫抑制剂等[1]。目前,结节病的病因和诊断方法尚无定论,本文就近年来肺结节病的诊治进展作一介绍。
一、结节病的诊断
目前临床诊断结节病大多基于以下3项标准:有特征性临床表现,受累部位病理检查结果提示非干酪样坏死性上皮样细胞性肉芽肿性炎,且需排除其他已知原因的肉芽肿性疾病。
1.结节病的特征性临床表现
30%~53%的结节病患者可出现呼吸系统症状,27%~53%可出现咳嗽,18%~51%可出现呼吸困难,9%~23%可出现胸痛[2-3]。多数结节病患者表现为亚急性或慢性特征,少数患者急性起病,表现为双侧肺门淋巴结肿大、关节炎及结节性红斑,伴发热和肌痛,也称之为Löfgren综合征[4]。结节病患者可无症状,也可出现疾病进展及疾病复发。当疾病进展时,可出现肺功能不全、肺纤维化甚至心脏受累导致死亡,如心律失常导致的心脏骤停和(或)心肌炎引起充血性心力衰竭。部分临床特征具有结节病高度特异性,具有诊断意义,包括Löfgren综合征、狼疮、Heerfordt综合征。其他与结节病密切相关的临床特征还包括“无B症状”(出现发热、盗汗及体重减轻)的双侧肺门淋巴结肿大。
高度提示结节病诊断的影像学特征表现包括:胸部X线、CT或正电子发射型计算机断层显像(PET)检查提示双侧肺门肿大;淋巴管周围结节;中枢神经系统MRI扫描出现钆增强;X线、CT或MRI检查提示溶骨、囊肿及穿孔病变,骨小梁出现;镓(67Ga)扫描和PET检查提示腮腺摄取增多。此外,肺上叶或弥漫性浸润影,支气管周围增厚,2个及以上的胸外淋巴结增大,MRI、PET或67Ga扫描提示心脏炎性活动增加,CT、PET或MRI检查提示肝脏或脾脏增大或出现结节,67Ga扫描、PET或MRI检查提示骨炎性改变也提示结节病诊断可能。而第七对颅神经麻痹、治疗反应性肾衰竭、治疗反应性心肌病或房室传导阻滞及无明显诱因的自发性或触发性室速也提示结节病可能。
高度提示结节病的体征包括:狼疮、葡萄膜炎、视神经炎及结节性红斑;提示可能结节病诊断的体征包括:紫红色皮损、皮下结节、巩膜炎、视网膜炎、泪腺肿胀、喉镜直接活检肉芽肿性病变、腮腺对称性肿大及肝脾肿大[5]。其他高度提示结节病的检查结果包括:高钙血症或高钙尿症伴维生素D代谢异常。可能提示结节病的诊断包括:左心室射血分数降低、血管紧张素转化酶水平增高、肾结石(钙成分为主)、支气管肺泡灌洗液(BLAF)的淋巴细胞增多或CD4+/CD8+T淋巴细胞比值增高、碱性磷酸酶(ALP)高于3倍正常参考值上限及青年或中年时期出现新发的三度房室传导阻滞。
(1)肺结节病
结节病的影像学表现目前主要依据1950年提出的Scadding胸部影像学评分标准[6],见表1。但胸部X线检查对结节病患者肺内受累情况的诊断价值有限,随着诊疗技术的提高,建议对胸部X线检查结果异常的结节病患者进行CT检查。结节病患者胸部CT典型特征包括:双侧肺门和(或)纵隔淋巴结肿大,支气管血管束周围、胸膜下和(或)小叶间分布的实性结节,肺内网状结节影,中上肺野分布为主的肺实变渗出影。而部分结节病的非典型胸部CT表现包括:单侧肺门、孤立性前或后纵隔、心缘旁淋巴结肿大,孤立性空洞影,单纯磨玻璃结影,马赛克征,胸膜病变(如胸膜增厚、胸腔积液、气胸),合并肺曲霉球,大结节,星云征等[7-9]。结节病患者的肺功能结果无明显一致性,可以出现正常、限制性或阻塞性通气功能障碍。结节病患者的弥散功能降低与肺受累程度一致,而当其出现非等比例降低时,则需排除是否有PH形成[10]。

表1 结节病Scadding胸部影像学评分标准[6]
结节病相关肺动脉高压(SAPH)是增加结节病病死率的独立危险因素。约半数出现持续性呼吸困难的结节病患者被诊断出SAPH。其他SAPH的临床特征包括劳累性胸痛和(或)晕厥、第二心音(P2)或第四心音(S4)亢进、6分钟步行试验距离减少、运动时血氧饱和度降低、肺功能一氧化碳弥散量(DLCO)降低、肺动脉直径相比升主动脉直径增加(CT扫描)、脑钠素升高及肺纤维化病变。但临床症状不总是可靠,通常推荐完成经胸超声心动图(TTE)检查。有研究指出,TTE可检测出29%(95%CI20%~39%)的结节病患者出现PH,其中78%为真阳性(被右心导管检查证实),22%为假阳性[11]。
(2)其他器官及系统结节病受累
结节病肺外器官受累以皮肤最常见,可出现冻疮样皮疹、皮下结节、结节红斑等。其次为肝脏或胃肠道受累,可出现肝肿大、肝内结节、ALP/γ-谷氨酰转肽酶(γ-GT)升高为主的肝功能损伤、肝硬化等;结节病眼部受累可出现葡萄膜炎、视神经炎、角膜羊脂状沉积物等;结节病肾脏受累可出现高钙血症、高尿钙、肾结石等;结节病神经系统受累以中枢神经系统为著,可累及脑膜、脊髓、颅神经(第Ⅶ对、视神经、第Ⅴ对)和下丘脑垂体[性腺功能不全导致广泛垂体功能减退和(或)尿崩症];结节病心脏受累可出现Mobitz Ⅱ或Ⅲ度房室传导阻滞、室性心律失常;结节病肌肉骨骼系统受累可出现多关节炎等[12]。
2.结节病的病理特征
典型的肺结节病肉芽肿表现为致密非干酪性肉芽肿团块,内部由类上皮细胞和多核巨细胞构成,外缘围绕T淋巴细胞,是结节病确诊的重要依据。结节病诊断需排除“感染”因素导致的肉芽肿,可通过微生物染色及培养结果判断。肺结节病肉芽肿常见于支气管粘膜下,沿气管血管束、淋巴管内沿小叶间隔和脏层胸膜分布。肺结节病肉芽肿可有局灶性坏死性改变,一般不出现广泛分布[13]。胸部淋巴结肿大患者需进行组织诊断时,纵隔镜检查通常可被经支气管针吸活检术(TBNA)以及经支气管肺活检和支气管内镜超声引导下穿刺活检(EBUS-TBNA)替代。
3.结节病的鉴别诊断
结节病的鉴别诊断较为广泛,可大致分为感染性和非感染性肉芽肿性疾病。需鉴别的感染性疾病包括:(1)细菌性感染,如结核分枝杆菌、非结核分枝杆菌(鸟分枝杆菌复合菌组病、堪萨斯分枝杆菌)、吸入性肺炎、布鲁氏菌[14];(2)真菌感染,如曲霉、组织胞浆菌等;(3)病毒感染,如带状疱疹病毒;(4)寄生虫,如弓形虫、血吸虫[15]。需鉴别的非感染性疾病包括:(1)恶性肿瘤,如淋巴瘤、类肉芽肿样肿瘤、淋巴结肉芽肿、生殖细胞肿瘤;(2)自身免疫性疾病或免疫失能疾病,如抗中性粒细胞抗体(ANCA)相关性血管炎[包括肉芽肿伴多血管炎(GPA)、显微镜下多血管炎(MPA)和嗜酸性肉芽肿伴多血管炎(EGPA)]、与普通变异型免疫缺陷病(CVID)相关的肉芽肿-淋巴细胞间质性肺疾病(GLILD)、风湿小结、朗格汉斯细胞组织细胞增生症、IgG4相关性疾病(IgG4-RD)、炎症性肠病等[16-17]。
此外,由于环境暴露导致的疾病也需注意鉴别,如过敏性肺炎、热浴缸肺、尘肺(如吸入含铍、钛、铝、锆、钴的粉尘)、药物诱导的肉芽肿性疾病[如进行干扰素(IFN)、检查点抑制剂、抗肿瘤坏死因子(TNF)药物治疗和(或)生物治疗]、外源性物质所致肉芽肿(包括滑石粉吸入或注射及纹身等)、脂肪变性(脂肪肉芽肿)。而特发性疾病鉴别主要包括坏死性结节样肉芽肿、坏死性淋巴结炎、组织细胞坏死性淋巴结炎、不明意义性肉芽肿病变、支气管中央型肉芽肿病[18]。
结节病的具体诊断流程见图1。
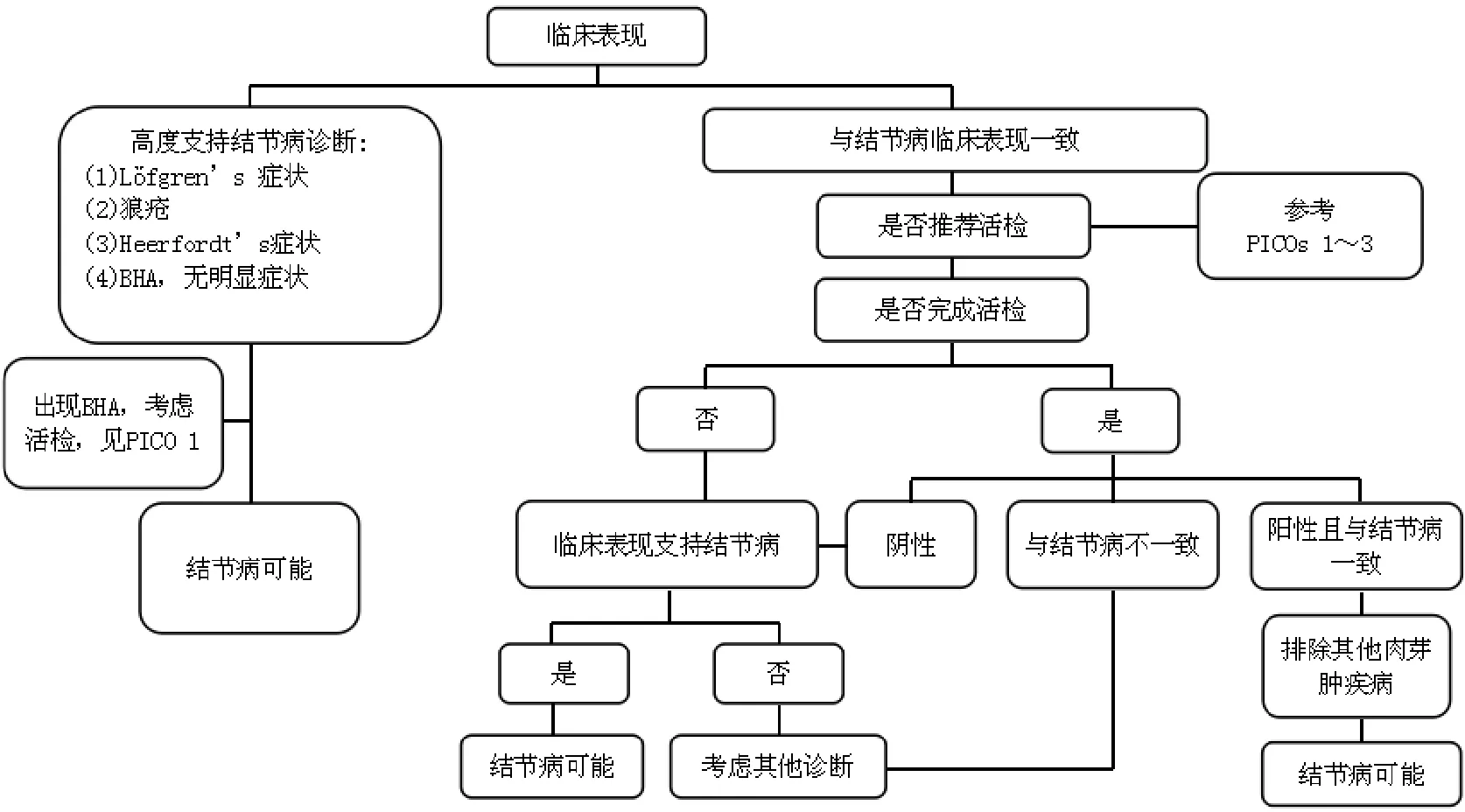
注:BHA:双肺门淋巴结肿大;PICO:问题、干预比较和结局问题模式图1 结节病的诊断流程[13]
二、结节病的处理
1.治疗药物
结节病的治疗需根据疾病是否影响患者的生存或器官功能而定。目前,系统性糖皮质激素治疗仍是肺内及肺外结节病的首选治疗方式。糖皮质激素可抑制巨噬细胞及淋巴细胞的活化,并可调控部分参与肉芽肿浸润的细胞因子,但并不改变疾病进程,长期使用可影响患者的安全性和耐受性。
细胞毒性药物作为结节病的二线治疗药物,当糖皮质激素治疗无效、疾病进展或患者不耐受时可考虑使用,主要包括甲氨蝶呤、硫唑嘌呤、来氟米特及霉酚酸酯[19-20]。
甲氨蝶呤(MTX)具有抗炎及免疫抑制作用,当患者出现肺部、皮肤及中枢神经系统受累时推荐使用。通常起始剂量为每周5.0~7.5 mg口服或肌肉注射,每周逐渐递减,至少每半年复查一次。MTX治疗可出现肝毒性、感染及增加骨髓抑制风险,为降低骨髓抑制风险,可补充叶酸每周5.0 mg。硫唑嘌呤由于药物不良反应较多,较少应用于结节病的二线治疗。而吗替麦考酚酯的药物不良反应较甲氨蝶呤及硫唑嘌呤更少,通常治疗起始剂量为500 mg每日两次,之后可增加剂量至750~1 500 mg每日两次[21]。
生物制剂等其他药物作为结节病的三线治疗药物,主要为拮抗TNF-α靶点的单克隆抗体,可用于治疗已使用糖皮质激素及一种二线免疫抑制剂治疗的活动性或进展性结节病患者,代表药物包括英夫利昔单抗、利妥昔单抗和阿达木单抗等[22]。
2.糖皮质激素治疗的适应证及剂量
糖皮质激素是肺结节病的一线治疗药物。肺结节病患者当出现如下症状时需考虑激素治疗:呼吸功能降低(如呼吸困难、咳嗽、胸痛等);肺功能严重受损[包括肺总量(TLC)降低≥10%,和(或)用力肺活量(FVC)降低≥15%,和(或)DLCO3~6个月内降低≥20%,或出现胸部影像学异常表现(如间质异常表现加重、肺空洞增大或肺纤维化蜂窝影加重)][23]。部分出现肺外结节病受累的患者需要糖皮质激素治疗,包括眼部、心脏、神经系统、肾脏受累和(或)出现高钙血症。一般推荐口服泼尼松(或同等剂量的其他激素)起始剂量0.3~0.5 mg/kg(20~40 mg/d),具体剂量视疾病严重程度而定。通常起始剂量维持使用4~6周,然后对患者进行重新评估。若患者的临床表现、肺功能及影像学特征稳定或改善,可每1~3个月减量5~10 mg,总疗程6~9个月。由于多数患者1年后糖皮质激素停药后出现复发,约30%的患者需长程维持治疗[24-25]。
20%~70%的结节病患者需要系统性治疗,而是否需要立即治疗或随诊时开始治疗取决于是否出现了以下3个因素:严重的功能受损或主要脏器不可逆损伤、死亡风险及是否出现功能丧失或全身症状[26-27]。结节病患者的用药指征包括出现结节病心脏、神经系统、泌尿系统受累、眼部结节病局部治疗无明显效果及高钙血症引起症状的情况。但目前对于治疗是否可以改变结节病的预后,尤其是肺纤维化进程,仍无定论[28]。
3.临床常见处理问题的推荐意见
近年来,随着临床研究增多,学者们对结节病的诊断及监测有了更多认识[13]。对于出现高度可疑的肺结节病临床表现(如Löfgren综合征、狼疮、Heerfordt’s综合征等)或出现双侧肺门淋巴结肿大的患者,建议对其密切随访,不建议行淋巴结活检[29-30];并且推荐支气管内镜引导下的淋巴结活检替代纵隔镜活检作为起始纵隔及肺门淋巴结活检方法[31-32]。
在结节病肺外器官受累的筛查方面,可通过入院时体检以筛查眼结节病、血清肌酐指标筛查肾脏结节病、血清学ALP水平筛查结节病肝脏受累、心电图(ECG)筛查结节病心脏受累、血钙水平筛查异常钙代谢、全血细胞检测筛查血液系统异常等。建议在维生素D替代治疗前行25-及1,25-羟基维生素D水平检测[33-37]。
对可疑结节病肺外受累的诊断评估,当患者出现结节病心脏外受累及可疑心脏受累时,建议行心脏MRI检查。当无法完成MRI检查时,建议行PET而非TTE检查。对于出现可疑PH表现的结节病患者,建议完成TTE检查[38]。对于怀疑PH且有TTE证实的结节病患者,建议行右心导管检查以明确SAPH诊断;而对于无TTE证据的结节病患者,应根据具体情况完成右心导管检查[39]。2020年结节病国际诊疗指南提出,约23%的结节病患者会在基线评估的3年内出现新的疾病表现,且通常无临床症状,建议每年对患者进行钙、肌酐和ALP筛查。但不建议针对眼或心脏结节病进行常规检查,除非患者出现上述与疾病相关的临床表现。见表2。

表2 基线指标正常时监测结节病肺外器官受累的建议
三、结节病患者的预后及随访
多数结节病患者的预后较好,大部分患者无需系统性治疗即可自愈。自愈的结节病患者复发较少,而糖皮质激素治疗缓解的结节病患者复发较多,但3年后复发罕见。20%的结节病患者因不可逆的纤维化(主要为肺纤维化)可出现永久性症状,约有12%的Ⅳ期结节病患者需要长程氧疗。建议结节病患者每3~6个月进行复查,每6个月复查肺功能、心电图及血常规,治疗停止后需随访至少3年[12,26]。有研究对结节病患者随访超过5年后发现,仍有40%的患者需要接受抗结节病治疗,而某些结节病患者的不良预后风险更高,包括症状加重、失能甚至死亡[40]。应对结节病患者进行纵向监测,以便制定不良反应较小的长期治疗策略,如糖皮质激素减量治疗[41]。
综上所述,肺结节病的诊断需出现特征性临床表现、影像学特征且活检病理学提示非坏死性上皮细胞样肉芽肿,并需排除其他已知原因的肉芽肿性疾病,鉴别诊断尤为重要。而是否需要进行活检应视患者临床表现而定,如出现高度支持结节病诊断的临床特征(Löfgren综合征等),可直接考虑结节病可能。结节病患者预后不同,从无症状到出现疾病的进展,严重者可出现后遗症甚至危及生命。目前,结节病的诊断和治疗仍是临床研究的重点,糖皮质激素仍是结节病治疗的主要药物。此外,对结节病肺外器官及系统受累的监测也十分重要,而监测的方式和时间应根据患者的临床表现而定。目前,关于中国人群结节病的前瞻性队列研究较少,尚缺乏特异性诊断方法、反映预后的生物标志物及合适的治疗策略,未来仍需进一步研究和探讨。
