结直肠癌中K-RAS基因突变与p53蛋白表达的临床意义及相关性
2020-12-01吴雪芳胡建军杨迎春龙艳丽
吴雪芳,李 霜,胡建军,杨迎春,龙艳丽,王 剑,易 韦
结直肠癌是一种常见的恶性肿瘤,其发生是一个多基因、多因素、多阶段参与的过程,涉及癌基因(K-RAS等)的激活和抑癌基因(TP53、APC等)的失活。K-RAS基因突变是结直肠癌形成过程中常见的基因改变,是结直肠癌发生、发展过程中的重要启动和促进因素[1]。TP53基因是癌症发生、发展的关键基因,其在人类癌症中突变率最高。近年有学者发现p53蛋白表达与TP53基因状态有显著相关性[2]。免疫组化检测相对基因检测费用低、耗时短、效果佳,因此,临床上常用免疫组化法检测p53蛋白表达来反应TP53基因突变状态。K-RAS和TP53基因作为结直肠癌的两种主要突变基因,迄今为止这些基因改变的临床意义仍有争议,两者在结直肠癌发生过程中的关系尚不清楚。目前关于结直肠癌组织中K-RAS基因突变状态与p53蛋白表达之间关系的研究尚未得到广泛开展和报道。本实验初步探讨了结直肠癌组织中K-RAS基因突变状态和p53蛋白表达及其与临床病理特征的关系,以及两者表达的相关性及与结直肠癌患者预后的关系。
1 材料与方法
1.1 临床资料选取2014年12月~2019年4月贵州省人民医院手术切除并经病理确诊的82例结直肠癌石蜡标本,其中男性54例,女性28例,年龄32~89岁,中位年龄59岁。患者术前均未行放、化疗及生物治疗。所有标本均经两位病理医师分别诊断并行组织学分化程度评估,其中包括高分化10例,中分化54例,低分化18例。根据AJCC第七版指南进行临床分期:Ⅰ期2例,Ⅱ期10例,Ⅲ期33例,Ⅳ期37例。
1.2 主要试剂石蜡包埋组织核酸提取试剂盒和人类K-RAS基因突变检测试剂盒(荧光PCR法)均购自福建厦门艾德生物公司。免疫组化所用浓缩型鼠抗人p53单克隆抗体(克隆号DO-7)、SP染色试剂盒及DAB显色试剂盒均购自北京中杉金桥生物公司。
1.3 方法
1.3.1基因检测 将10%中性福尔马林固定、石蜡包埋的结直肠癌手术切除标本组织5 μm厚连续切片,每例组织切3~5张,保证肿瘤细胞含量>60%。根据艾德核酸提取试剂盒说明书提取石蜡切片中的DNA。采用Nanodrop 2000测定DNA浓度,OD260/OD280应介于1.8~2.0之间。根据艾德人类K-RAS基因突变检测试剂盒(荧光PCR法)检测K-RAS基因突变情况。
1.3.2免疫组化 免疫组化染色采用SP法,操作步骤严格按试剂盒说明书进行,p53抗体(稀释度1 ∶100)孵育前经抗原高压热修复,用已知阳性的癌组织作为阳性对照,PBS代替一抗作为空白对照。
1.4 结果判读所有病理切片均由两位资深病理诊断医师判读。p53蛋白表达主要定位于细胞核,以胞核中出现棕褐色颗粒为阳性,按染色强度和阳性细胞数综合评分:(1)染色强度:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;(2)阳性细胞数:无阳性细胞为0分,阳性细胞数<50%为1分,≥50%为2分。将两项得分结果相乘:0分为阴性,1~3分为弱阳性,4~6分为强阳性。K-RAS基因结果判读参照艾德人类K-RAS基因突变检测试剂盒说明书的判断方法进行。
1.5 统计学分析采用SPSS 25.0软件进行统计学分析。采用χ2检验分析K-RAS基因状态、p53蛋白表达水平与临床病理特征间的关系以及K-RAS基因状态与p53蛋白表达的相关性。生存分析采用Kaplan-Meier生存曲线法、Log-rank检验及多因素Cox回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 K-RAS基因突变和p53蛋白表达与结直肠癌临床病理特征的关系82例结直肠癌组织中K-RAS基因表达包括42例野生型K-RAS(51.2%)和40例突变型K-RAS(48.8%)。分析结直肠癌组织中K-RAS基因突变状态与各临床病理特征的关系,结果显示与患者年龄、性别、临床分期、分化程度、淋巴结转移均无关(P均>0.05)。p53蛋白表达与结直肠癌患者年龄、性别、临床分期、分化程度均无关(P均>0.05),与淋巴结转移相关(χ2=6.237,P=0.044)。p53多个样本率间的多重比较结果显示,p53强阳性组的淋巴结转移率(84.6%,44/52)高于弱阳性组(44.4%,4/9)(χ2=5.182,P=0.023);p53强阳性组(84.6%,44/52)与阴性组(81.0%,17/21)的淋巴结转移率差异无显著性(χ2=0.001,P=0.973);p53弱阳性组(44.4%,4/9)与阴性组(81.0%,17/21)的淋巴结转移率差异无显著性(χ2=2.449,P=0.118)(表1,图1)。
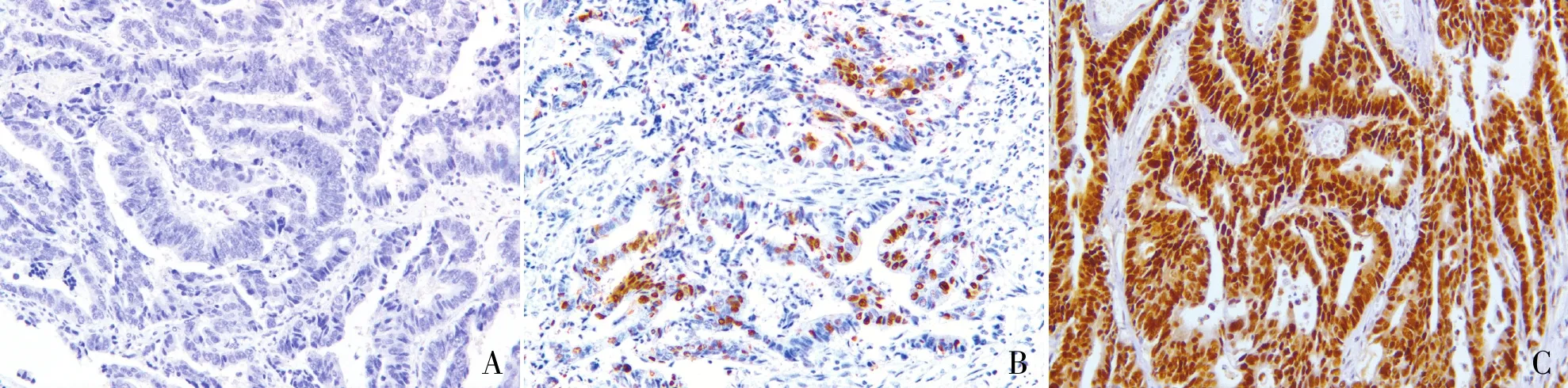
ABC
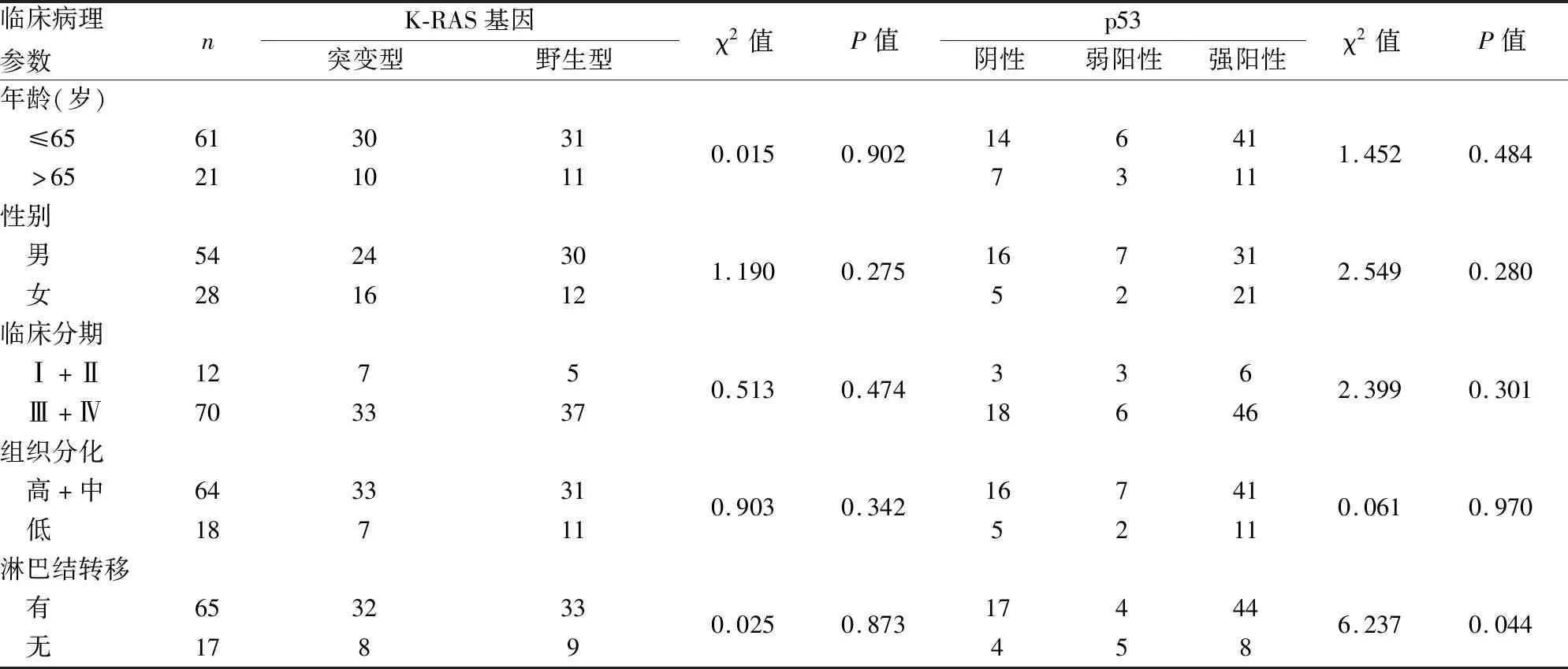
表1 K-RAS基因突变和p53蛋白表达与结直肠癌临床病理特征的关系
2.2 结直肠癌组织中K-RAS基因突变与p53蛋白表达的相关性分析在结直肠癌组织中,K-RAS基因类型与p53蛋白表达无相关性(χ2=1.186,P=0.553,表2)。

表2 结直肠癌组织中K-RAS基因类型与p53蛋白表达的关系
2.3 K-RAS基因突变状态、p53蛋白表达与结直肠癌患者预后的关系随访截至2019年9月,66例有随访资料,随访率为80.5%,Kaplan-Meier生存分析显示,随访6~53个月,1年生存率为84.3%,2年生存率为78.8%,3年生存率为60.8%。Kaplan-Meier生存分析结果显示,临床分期、组织分化程度、K-RAS基因与预后相关(P<0.05)。Ⅲ+Ⅳ期患者生存时间低于Ⅰ+Ⅱ期患者,两者之间差异有统计学意义(χ2=3.897,P=0.048);低分化组生存时间低于高+中分化组(χ2=4.046,P=0.044);K-RAS基因突变型患者预后差于野生型患者(χ2=6.372,P=0.012)。p53蛋白表达水平与患者预后无关(P>0.05)。将患者年龄、性别、组织分化程度、临床分期、淋巴结转移、K-RAS基因和p53蛋白表达进行Cox回归模型多因素生存分析,结果显示,临床分期、K-RAS基因是影响结直肠癌患者术后预后的独立因素(HR=2.770,P=0.023;HR=0.276,P=0.029)(表3,图2)。
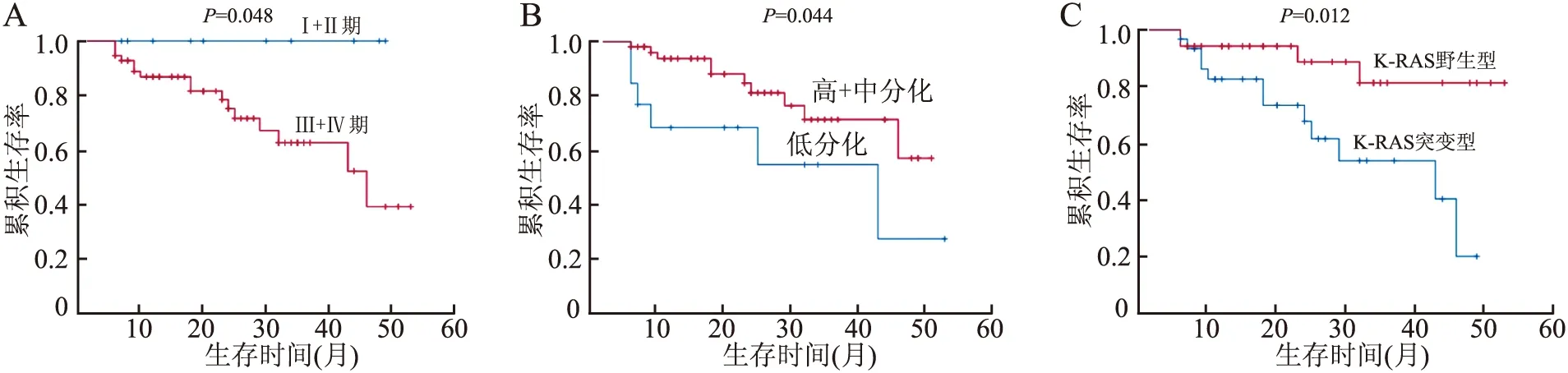
图2 结直肠癌患者生存率与临床分期(A)、组织分化程度(B)和K-RAS基因状态(C)的关系
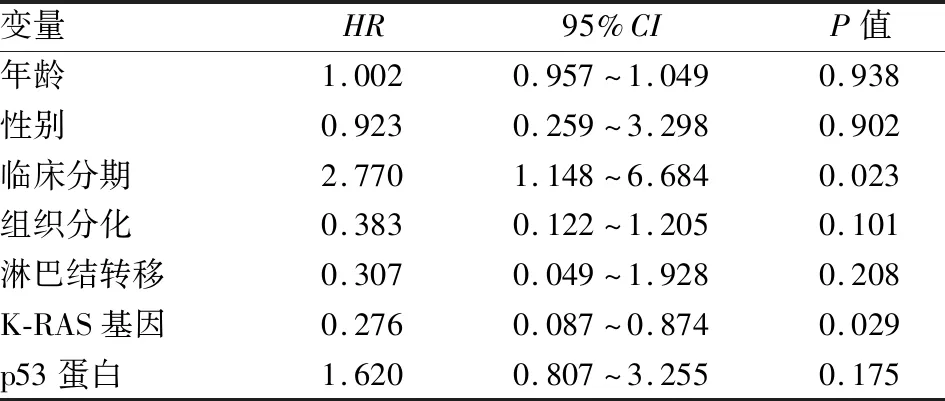
表3 结直肠癌患者多因素Cox回归分析
3 讨论
K-RAS是一种原癌基因,在细胞生长和分化机制中发挥控制作用,某些致癌物通过点突变将其转化为活性致癌基因。K-RAS基因突变发生于外显子2、3和4,外显子2是K-RAS基因突变的常见突变位点。K-RAS突变基因是结直肠癌常见的致癌基因,亚洲人突变的发生率为29%~62.9%[3],本组K-RAS基因突变率为48.8%,在文献报道组范围内。Malhotra等[4]报道K-RAS突变与患者年龄和组织学分化程度有关,丁莉等[5]报道K-RAS突变与淋巴结转移有关,但本实验未发现K-RAS突变与患者年龄、性别、临床分期、组织分化程度及淋巴结转移有相关性,这与部分学者的研究结果较一致[6-7],该结果可能受多种因素的影响,如突变检测技术的敏感性和特异性、患者样本量或种群不同等。
野生型TP53基因编码一种核蛋白,在正常细胞中p53蛋白维持在一个低水平,通过调节基因转录以应对癌基因信号激活及DNA损伤等不利因素。当TP53基因突变后,其编码的p53蛋白半衰期长,稳定性强,可在核内不断积累,从而失去对细胞的监视作用,反之在细胞恶变中起癌基因的作用。在结直肠癌患者发生TP53突变后,50%~75%的病例呈阳性[8],因此大部分学者研究p53蛋白表达时多采用两层分组模式(阴性组、阳性组)。Oh等[2]为探讨结直肠癌患者p53蛋白表达与TP53基因状态的关系,将p53免疫组化结果和靶向外显子测序数据进行了对比,发现p53阴性患者中有53%发生了错义突变或无义突变,p53高表达(≥50%肿瘤细胞阳性)患者约80%发生错义突变,而p53低表达(<50%肿瘤细胞阳性)患者70%以上未发生TP53基因突变,提示p53低表达者更有可能为野生型TP53,同时提示采用两层分组模式有一定的缺陷性。因此,本实验将p53表达分为阴性组、弱阳性组、强阳性组,虽然按p53蛋白表达程度来反映TP53基因状态具有一定的异质性及局限性,但参考Oh等[2]报道的p53蛋白表达与TP53突变状态间存在显著相关性,Ines等[6]报道免疫组化法检测p53基因突变的准确性为71%,敏感性为33.8%,特异性为91%,提示本实验的分组模式具有较好的可行性,本实验最初也采用了两层分组模式(阴性组、阳性组),未发现p53表达与结直肠癌病理临床特征的关系,而采用三层分组模式(阴性组、弱阳性组、强阳性组)时,发现p53强阳性组相比弱阳性组更易发生淋巴结转移,提示其侵袭转移能力增强。综合分析p53蛋白判读采用三层分组模式优于两层分组模式,可较好的实践于临床病理诊断指标的判读中,对评估患者预后有一定的帮助。
K-RAS基因和TP53基因同时突变者很少见,很少发生在同一肿瘤。文献报道仅4%结直肠癌患者同时发生两种基因突变[6]。本实验对结直肠癌组织中K-RAS基因突变状态与p53蛋白表达进行相关性分析,未发现K-RAS基因与p53蛋白表达有相关性。Malhotra等[4]证实了在结直肠癌中K-RAS和p53突变的共存极为罕见,提示可能在结直肠癌中K-RAS和TP53突变发生在不同通路,且不属于一个共同途径积累的遗传改变。Rachmawati等[9]对623例印度尼西亚结直肠癌患者K-RAS与p53蛋白免疫组化结果的相关性分析发现,两者之间存在轻度正相关,与本实验结果不一致。该结果可能受样本量、种群不同等多因素作用,在后续的实验中可增加样本量等优化设计以进一步探究。
本实验对66例结直肠癌患者进行了生存分析,发现Ⅲ+Ⅳ期患者的生存率低于Ⅰ+Ⅱ期患者,肿瘤低分化组患者的生存率低于高+中分化组,K-RAS突变型组的生存率低于野生型组,提示临床分期晚、组织分化程度低、K-RAS基因突变是影响结直肠癌患者生存时间的风险因素[6,10]。文献报道TP53突变是结直肠癌的预后不良标志[11],但Ines等[6]研究报道TP53基因突变和p53蛋白过表达对患者生存均无影响,本实验亦未发现p53蛋白与患者不良预后有关。推测可能是因TP53基因是一个关键基因,调控多种基因的转录表达、作用及机制较为多样复杂所致。进一步多因素分析显示,临床分期和K-RAS基因是影响结直肠癌患者预后的独立因素,提示两者的检测对结直肠癌患者的预后评估有一定的意义。
综上所述,K-RAS、p53可能参与结直肠癌的发生、发展进程,K-RAS、p53可能是两个独立的因素,p53蛋白表达与淋巴结转移有关,两者的检测对评估结直肠癌的生物学行为、预后有一定的意义。
