乙醇提取-丙酮沉淀法提取分离茶皂素的工艺研究
2020-12-01张耀洲谷清义
张耀洲, 谷清义, 陈 琼
(信阳农林学院 生物与制药工程学院,河南 信阳 464000)
茶皂素又名茶皂苷,是山茶科植物中含有的一类糖苷类物质,是由糖体、皂苷元(配基)和有机酸三部分形成的结构复杂的五环三萜混合物[1]。由于其独特的结构,茶皂素不仅具有天然优良的表面活性作用,还具有特殊的生物活性如溶血、鱼毒、抗渗、消炎、抗菌、杀虫、灭螺、抗高血压和保护肠胃的作用等[2]。此外,茶皂素在自然界中能自动降解,对环境友好,对人体安全[3-4]。因此茶皂素在工业、农业、医药等领域有着广泛的用途,市场需求量大。茶皂素的提取方法常见有3种,即水提法[5]、醇提法[6]以及在前2种方法基础上的改进提取法,如微波辅助提取法[7]、超声波辅助提取法[8]等。其中醇提法以其提取速度快、后处理方便、产品纯度较高等优点而成为茶皂素提取的常规方法,常用溶剂为甲醇水溶液[9]、乙醇水溶液[10]、正丙醇[11]、正丁醇[12]等。由于溶剂毒性、环保及成本等原因,目前提取工艺多采用体积分数为50%~85%乙醇作为提取溶剂。但乙醇提取所得茶皂素纯度不够高,还需要进一步的纯化才能得到高品质的茶皂素。丙酮沉淀法由于沉淀速度快、操作简便,适宜工业化生产而受到广泛关注[13]。现在市售的茶皂素一般色泽较深、有特殊的气味、纯度较低,限制了茶皂素的进一步开发利用。我国是茶皂素主产区,油茶籽提取茶油后剩余的残渣部分即油茶饼粕中含茶皂素的量达12%~18%[14]。目前国家正在大力扶持和发展油茶产业,我国油茶种植总规模已达446.67万公顷[15]。因此若能探索出一条新型、快速、高效、环保的高纯度茶皂素提取纯化工艺并运用到工业化生产过程中,对于提高我国茶皂素生产水平、提高茶皂素在国际上的竞争力具有非常重要的意义,并且对于发展山区经济,延伸油茶产业链具有巨大的经济效益和社会效益。杨鹤群等[16]对无患子皂素的乙醇提取-丙酮沉淀方法进行了探讨,研究发现该方法得到的无患子皂素品质较高,纯度达到90.5%,疏松洁白,颗粒较细。本研究以来源丰富的油茶饼粕为原料,以茶皂素的得率和纯度为双指标,对适宜工业化生产的乙醇提取-丙酮沉淀方法进行深入研究,以期为高纯度茶皂素的工业化生产提供参考。
1 材料与方法
1.1 材料、试剂与仪器
油茶饼粕,光山县诚信实业开发有限责任公司,经检测,主要成分为:粗脂肪8.83%(索氏抽提法,参照GB/T 10359—2008)、粗纤维14.11%(减重法,参照SN 14023—1990)、茶皂素13.75%(香草醛-浓硫酸比色法)、茶多糖28.36%(苯酚-硫酸法)、粗蛋白12.78%(凯氏定氮法,参照SN 14019—1990)。茶皂素对照品(纯度98%),上海九鼎化学科技有限公司。香草醛、石油醚(沸程60~90 ℃)、浓硫酸、体积分数95%乙醇、无水乙醇、丙酮、乙酸乙酯均为分析纯。
TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;AB135-S电子天平;101AS-2电热恒温干燥箱;HH- 4数显恒温水浴锅;RE-52A旋转蒸发器;SHB-III循环水式真空泵。
1.2 茶皂素的提取工艺
1.2.1油茶饼粕的预处理 取一定量的油茶饼粕,粉碎过筛,取粒径≤0.38 mm部分,105 ℃鼓风干燥5 h。以石油醚(沸程60~90 ℃)为溶剂,90 ℃水浴索氏提取6~8 h至提取液无色。将脱脂后的油茶饼粕自然风干,然后60 ℃鼓风干燥1 h,备用。
1.2.2茶皂素的提取 称取一定量预处理过的油茶饼粕,加入一定量不同体积分数(50%~99.8%)的乙醇溶液,液料比(5 ∶1~20 ∶1,mL ∶g,下同),在一定的温度(30~80 ℃)下浸提一定时间(2~8 h),趁热过滤,滤液浓缩至干,105 ℃鼓风干燥至质量恒定得黄色固体粗茶皂素,备用。
1.3 茶皂素的纯化工艺
预处理过的油茶饼粕100.0 g,提取溶剂为95%乙醇,液料比为9 ∶1,提取温度为70 ℃,提取时间为4 h,提取次数为2次,所得提取液记录总体积后用于纯化研究。
1.3.1提取液浓缩程度考察 取3份100 mL提取液,分别浓缩至小体积但未有固体析出(15 mL)、刚好有固体析出(约8 mL)、稠膏(含水量22%),加入25 mL丙酮,磁力搅拌1 h,过滤,滤饼经10 mL丙酮洗涤,105 ℃鼓风干燥至质量恒定后,测茶皂素纯度和得率。
1.3.2丙酮用量考察 取5份100 mL提取液浓缩,在刚好有固体析出的浓缩液(约8 mL)中分别加入8、16、24、32、40 mL丙酮,磁力搅拌1 h,过滤,滤饼经10 mL丙酮洗涤,105 ℃鼓风干燥至质量恒定后,测茶皂素纯度和得率。
1.4 打浆纯化
按优选的提取及纯化工艺条件制得的粗茶皂素用不同溶剂在液料比20 ∶1、40 ℃下快速搅拌4 h,趁热过滤,105 ℃鼓风干燥至质量恒定得精制茶皂素,测定茶皂素纯度和回收率。
1.5 茶皂素含量的测定及纯度、得率计算
1.5.1茶皂素含量测定 采用香草醛-浓硫酸比色法[17]测定茶皂素的含量。精密称取干燥至质量恒定的纯度98%茶皂素对照品25.51 mg,置于25 mL量瓶中,用体积分数80%的乙醇溶解并稀释至刻度,摇匀,即得茶皂素质量浓度为1 g/L对照品溶液。精密称取香草醛0.8 g,置10 mL量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,即得80 g/L香草醛溶液。精密量取茶皂素对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL置于10 mL具塞刻度试管中,加水定容至1.0 mL。准确加入80 g/L香草醛溶液0.5 mL,摇匀,于冰水浴中加入体积分数77%的硫酸溶液4 mL,摇匀后于60 ℃水浴加热15 min,然后置于冰水浴中冷却10 min,取出恢复至室温后于453 nm处以空白溶液为参比测定其吸光度(A)。以吸光度(A)为纵坐标,茶皂素质量浓度(C,g/L)为横坐标进行线性回归,其回归方程为A=0.507 1C-0.002 1(R2=0.998 7)。精密称取一定量的粗茶皂素,用体积分数80%的乙醇溶解并定容至25 mL。取经稀释至适当浓度的样品溶液1.0 mL,置于10 mL具塞刻度试管中,按上述方法测定吸光度,根据线性回归方程计算所测样品溶液的质量浓度,即茶皂素的含量。
1.5.2茶皂素的纯度和得率计算 根据式(1)和式(2)计算样品纯度和得率。
(1)
(2)
式中:X—茶皂素纯度,%;C—茶皂素质量浓度,g/L;V—样品溶液的体积, mL;N—样品溶液的稀释倍数;m1—测定所取样品的质量,mg;Y—茶皂素得率,%;m2—提取所得粗茶皂素质量,mg;m3—预处理过的油茶饼粕质量,mg。
2 结果与分析
2.1 提取条件对茶皂素纯度及得率的影响
2.1.1乙醇体积分数 在预处理过的油茶饼粕5.0 g、液料比8 ∶1、水浴85 ℃加热回流提取3 h、提取次数1次条件下,考察不同体积分数的乙醇作为提取溶剂对茶皂素纯度和得率的影响,结果见图1(a)所示。
由图1(a)可以看出,茶皂素的得率随着乙醇体积分数的增加而增加,当乙醇体积分数超过80%以后,得率反而降低。而所得粗茶皂素的纯度随着乙醇体积分数的增加而增加,特别是用高体积分数(95%以上)的乙醇提取后茶皂素的纯度迅速增加,其原因可能为油茶饼粕中富含水溶性的茶蛋白、茶多糖在高体积分数的乙醇中溶出减少。试验过程中发现,低体积分数乙醇的提取液在减压抽滤和旋转浓缩后期会产生大量泡沫,不便于操作,原因可能为低体积分数的乙醇中含水量大,导致表面活性剂茶皂素溶解所致。尽管体积分数80%的乙醇作为提取剂时茶皂素得率要比高体积分数的乙醇高,但其所得粗茶皂素纯度要低很多,这样势必会增加后续纯化的难度。因此,从获得高品质茶皂素难易程度看,高体积分数乙醇作为提取剂更适合。而无水乙醇(体积分数99.8%)提取虽然所得粗茶皂素纯度更高,但考虑到茶皂素的得率较低以及无水乙醇的价格原因,本试验选取体积分数95%的乙醇作为提取溶剂进行试验。若能对无水乙醇进行很好地回收利用,控制在较低成本水平,如通过增加提取次数、时间等方式提高茶皂素得率,无水乙醇也有可能成为一种良好的提取溶剂,这有待下一步研究。
2.1.2液料比 在预处理过的油茶饼粕5.0 g、提取溶剂为体积分数95%乙醇、水浴85 ℃加热回流提取3 h、提取次数为1次条件下,考察不同液料比对茶皂素纯度和得率的影响,结果见图1(b)。由图可以看出,茶皂素的得率随着液料比的增加而增加,但纯度变化不大。当液料比在5 ∶1~9 ∶1之间时,茶皂素得率及杂质溶出量增幅均明显,达到9 ∶1以后,茶皂素的得率及杂质溶出量增幅均趋于平缓。这说明随着液料比的增加,传质推动力加大,茶皂素溶出增多,当液料比为9 ∶1时绝大部分茶皂素能被提取出来,再增加浸提溶剂的体积,茶皂素溶出有限,而且后续浓缩量增加。考虑到成本及后处理工作量因素,选择液料比9 ∶1较为合适。
2.1.3提取温度 在预处理过的油茶饼粕5.0 g、提取溶剂为体积分数95%乙醇、液料比为9 ∶1、提取时间为3 h、提取次数为1次的条件下,考察不同提取温度对茶皂素纯度和得率的影响,结果见图1(c)。由图可以看出,当温度在30~70 ℃之间,茶皂素的纯度及得率随着提取温度的升高而迅速增加。当温度达到78 ℃(乙醇沸点)时,茶皂素得率增加有限,而纯度略有下降。原因可能为茶皂素的溶解度受温度影响比较显著,随着温度升高,茶皂素的溶解度增大;但温度过高,在茶皂素助溶作用下多糖、蛋白质等杂质溶出也相应增多,从而导致纯度略有下降。另外趁热抽滤操作时,沸腾状态下乙醇挥发损失大,生产上也不便于操作。综合考虑,选择浸提温度70 ℃较为合适。
2.1.4提取时间 在预处理过的油茶饼粕5.0 g、提取溶剂为体积分数95%乙醇、液料比为9 ∶1、提取温度为70 ℃、提取次数为1次的条件下,考察不同提取时间对茶皂素纯度和得率的影响,结果见图1(d)。由图可以看出,当浸提时间在2~4 h之间,茶皂素的纯度及得率均随着浸提时间的延长而显著增加;当浸提超过4 h时,茶皂素得率及纯度增加有限。原因可能为随着浸提时间的延长,浸提物浓度增加,传质动力减弱,茶皂素及杂质浸出速度减慢,最后达到平衡。说明浸提4 h已基本接近溶出平衡状态,再延长浸提时间对提高茶皂素得率及纯度作用不明显,而且会增加能耗,降低生产效率。综合考虑,选择浸提时间4 h较为合适。
2.1.5提取次数 在预处理过的油茶饼粕10.0 g、提取溶剂为体积分数95%乙醇、液料比为9 ∶1、提取温度为70 ℃、提取时间为4 h、每次提取完后的油茶饼粕再按上述条件进行提取,考察不同提取次数对茶皂素纯度和得率的影响,结果见图1(e)。由图可以看出,4次提取的茶皂素在纯度上没有显著差别,一次提取能把大部分茶皂素从油茶饼粕中提取出来,经过3次提取后,油茶饼粕中残余的茶皂素已很少。考虑到生产成本及劳动强度等因素,提取2次较为合适。
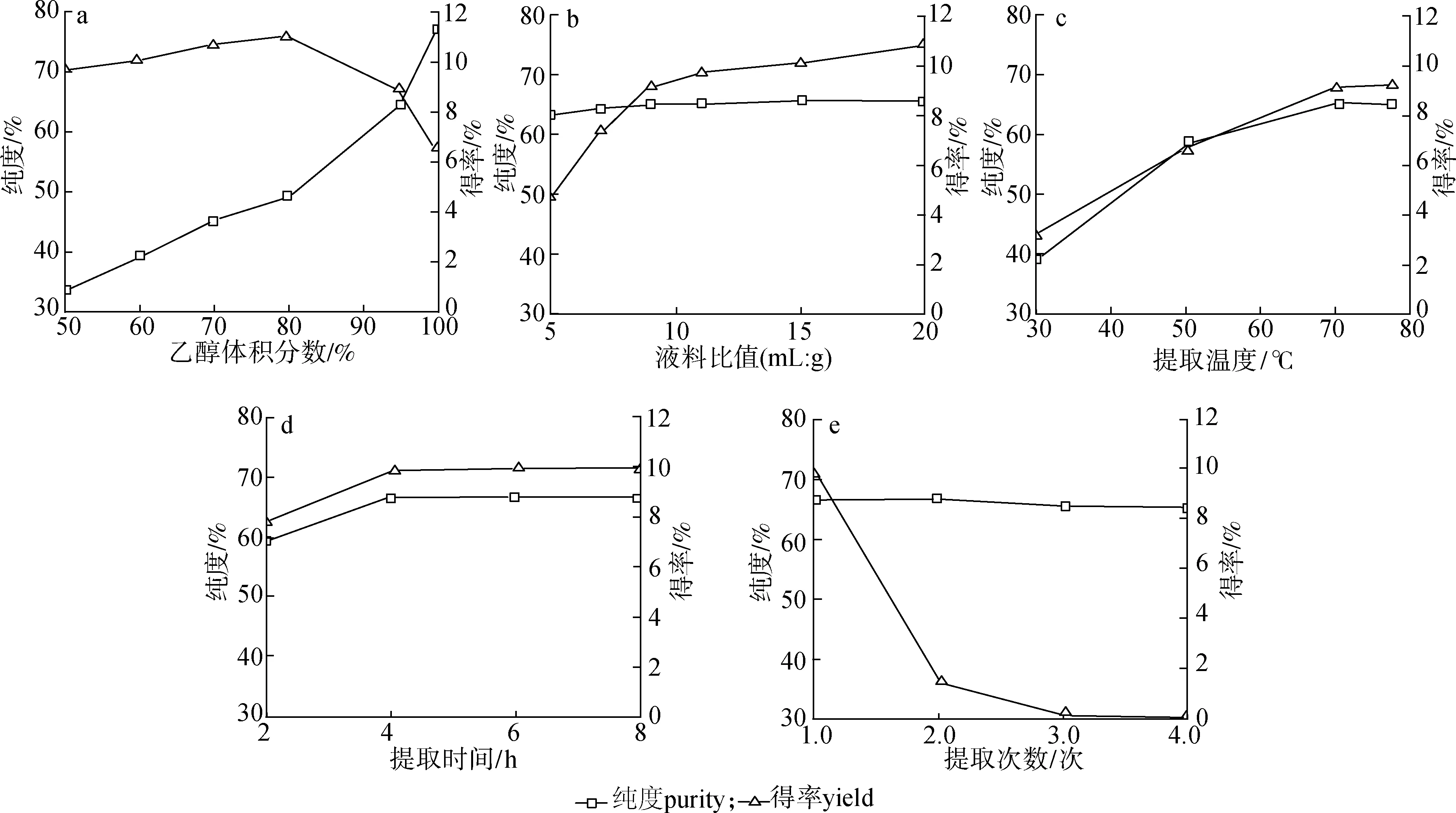
a.乙醇体积分数ethanol volume fraction; b.液料比liquid to solid ratio; c.提取温度extraction temperature;
2.2 茶皂素的纯化工艺优化
2.2.1提取液浓缩程度 提取液浓缩程度即丙酮加入时机对茶皂素纯度、得率的影响结果如下:在浓缩至小体积但未有固体析出(15 mL)时加入丙酮,茶皂素纯度最高(85.62%),但得率较低(8.67%);在稠膏(含水量22%)时加入丙酮,茶皂素得率最高(10.73%),但纯度最低(76.20%);在刚好有固体析出(约8 mL)时加入丙酮,茶皂素纯度、得率都较高(分别为84.88%、9.82%)。原因可能为稠膏中加入丙酮后形成一团,不易分散,黄酮、多酚等杂质未能充分溶解到丙酮中造成茶皂素纯度相对降低,而浓缩液中未析出固体时加入丙酮,体系存在含水乙醇,使得部分茶皂素溶于丙酮中造成得率相对降低。另外,“刚好有固体析出”这一指标,现象明显,便于控制,所以选择刚好有固体析出时加入丙酮。

图2 丙酮用量对茶皂素纯度及得率的影响Fig.2 Effects of acetone amount on the purity and yield of tea saponin
2.2.2丙酮用量 丙酮用量对茶皂素纯度、得率的影响见图2。
由图2可以看出,随着丙酮用量的增加,茶皂素的纯度小幅度增加,得率先显著增加后趋于稳定。当丙酮达到浓缩液体积3倍(24 mL)后,得率增幅趋于平缓,说明3倍浓缩液体积量的丙酮基本可使绝大部分茶皂素沉淀,原因可能为此条件下形成的溶剂极性正好适合茶皂素沉淀。试验中发现,丙酮用量为浓缩液体积4倍时,沉淀物固化最好,更容易分散,故选择丙酮的加入量为浓缩液体积的4倍量。
2.2.3验证性实验 按优选的提取及纯化工艺条件进行验证性实验,即预处理过的油茶饼粕5.0 g,在液料比为9 ∶1,乙醇体积分数为95%,70 ℃下提取2次,每次4 h,趁热过滤,滤液合并,减压浓缩至刚好有固体析出时,加入4倍浓缩液体积量的丙酮,收集沉淀即得粗产品。3次试验得率分别为9.82%、9.78%、9.85%(平均值9.82%),相应纯度为85.28%、84.67%、85.56%(平均值85.17%),相对标准偏差(RSD)分别为0.36%和0.53%。
2.3 不同溶剂打浆对粗产品纯化效果的比较
丙酮沉淀法得到的粗产品纯度仍不高,且颗粒较大不规则,颜色呈黄色,其品质仍然有待提高。因此试验以纯度为85.11%的粗茶皂素为对象,按1.4节操作,用不同溶剂打浆纯化,结果见表1。

表1 不同溶剂打浆对茶皂素纯度及回收率的影响 Table 1 Effects of different solvent reslurrying on the purity and yield of tea saponin
由表1可以看出,乙酸乙酯基本没有纯化效果,但能使产品的成粉性得到明显改善。无水乙醇虽能使产品纯度提高,但回收率太低,而且产品易吸潮,颜色改变。粗产品在体积分数95%的乙醇中溶解,得不到产品。相比较而言,丙酮纯化效果最好,但纯度提高有限,打浆滤液在放置过程中有固体物质析出,经薄层色谱法(TLC法)和苯酚-硫酸法检测,固体物质主要为多糖。总体而言,几种溶剂打浆纯化效果均不理想,所以本试验未做进一步研究。
3 结 论
3.1采用乙醇提取-丙酮沉淀方法从油茶饼粕中提取茶皂素,以茶皂素的得率和纯度为指标,考察了提取条件对提取效果的影响,以及提取液浓缩程度、丙酮用量对纯化效果的影响,确定的较佳工艺条件为:预处理过的油茶饼粕5.0 g,液料比为9 ∶1(mL ∶g),体积分数95%的乙醇为提取溶剂,提取温度为70 ℃,提取时间4 h,提取次数为2次,丙酮加入时机为浓缩至刚好有固体析出时,丙酮用量为4倍浓缩液体积量。按此工艺条件进行验证实验,得到的茶皂素纯度为85.17%,得率为9.82%。
3.2在乙醇提取-丙酮沉淀法提取纯化茶皂素的基础上,探讨了不同溶剂打浆对产品纯化效果的影响,结果发现:打浆纯化所用溶剂丙酮、乙酸乙酯、无水乙醇和体积分数95%的乙醇纯化效果均不理想。其他单一溶剂或混合溶剂能否用于打浆纯化,或能否选用适合工业化生产的大孔树脂吸附纯化有待进一步研究。
