渭源县黄芪根腐病病原菌的分离与鉴定
2020-11-30陈健孙旭春赵庆芳
陈健 孙旭春 赵庆芳

摘要:对从甘肃省渭源县采集到的黄芪根腐病病株进行了病原菌的分离、纯化和致病性检测,并对致病菌形态学进行了观察,结合核糖体DNA(rDNA) ITS序列分析的分子生物学鉴定,以明确引起黄芪根腐病的致病病原菌。结果表明:黄芪根腐病致病菌为半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)瘤座孢目(Tuberculariales)瘤座孢科(Tuberculariaceae)镰刀菌属(Fusarium)的4个种。共分离出16个菌株,经检测有5个菌株具有致病性,均属镰刀菌,其中尖孢镰刀菌(Fusarium oxysporun)1株(9号菌株),腐皮镰刀菌(Fusarium solani)2种(12号菌株和16号菌株,其中16号菌株可能为腐皮镰刀菌的变种),锐顶镰刀菌(Fusarium acuminatum)1株(15号菌株),待定镰刀菌1株(14号菌株,與三线镰刀菌的同源性仅为88%)。
关键词:黄芪;根腐病;致病菌鉴定;ITS序列分析;渭源县
中图分类号:S512.1 文献标志码:A 文章编号:1001-1463(2020)10-0021-07
doi:10.3969/j.issn.1001-1463.2020.10.005
Abstract:The root rot strains of Astragalus membranaceus root rot symptom collected from Weiyuan County, Gansu Province were isolated, purified and tested for pathogenicity, and by morphological identification and identification of pathogenic bacteria with molecular identification of ribosomal DNA(rDNA) ITS sequence analysis, so as to identify pathogenic bacteria of causing Astragalus membranaceus root rot. The results show that the pathogen of root rot of astragalus membranaceus was four species of Deuteromycotina, Hyphomycetes, Tubercuariles, Tuberculariaceae, Fusarium, a total of 16 strains were isolated, and 5 strains were detected to be pathogenic, all of which were fusarium, of which 1 strain(strain 9) was Fusarium oxysporum, 2 strains of (strains 12 and strains 16 of which may be a variant of Fusarium solani) were Fusarium solani, 1 strain(strain 15) was Fusarium acuminatum, 1 strain(strain 14, only 88% homologous to Fusarium trichomonas) was determined Fusarium.
Key words:Astragalus membranaceus;Root rot;Pathogenic bacteria identification;ITS sequences analysis;Weiyuan County
黄芪(Astragalus membranaceus)为豆科多年生草本植物,以根入药,是药用价值很高的中药材[1 - 3 ]。近年来随着市场需求量的持续增加,黄芪种植面积不断扩大,使得轮作周期缩短,重茬和迎茬面积增加,导致黄芪根腐病危害逐年加重,严重影响其产量和质量。
黄芪根腐病属于土传病害,是土壤中的病原菌和病原线虫共同作用的结果,镰刀菌是引起黄芪根腐病的主要致病菌[4 - 6 ],目前对黄芪根腐病致病菌的分类鉴定主要集中在形态方面,而利用ITS序列分析对引起黄芪根腐病的致病菌进行分子生物学方面的鉴定目前还尚未见报道。核糖体DNA(rDNA)-ITS序列在真菌的种间存在着丰富的变异,而在种内不同菌株间却高度保守,所以ITS序列分析能实质性地反映出属间、种间以及菌株间的碱基对差异。此外ITS序列片段较小、易于分析,目前已被广泛应用于真菌属内不同种间或近似属间的系统发育研究中[7 ]。我们对从甘肃省定西市渭源县黄芪大田采集到的黄芪根腐病病株进行病原菌的分离、纯化和致病性检测,以确定引起黄芪根腐病的致病菌,并通过形态学鉴定,结合核糖体DNA(rDNA)-ITS序列分析的分子生物学鉴定,以明确引起黄芪根腐病的致病病原菌的分类地位。
1 材料与方法
1.1 病样采集
从甘肃省定西市渭源县会川镇黄芪种植地采集黄芪根腐病带病植株。采集地为平川地,选取5块种植地,每块地采集3个病株。选根腐病发生比较严重的黄芪植株为供试样本。
1.2 病原菌分离纯化
采用组织分离法分离黄芪根腐病病原 菌[8 ]。将初步分离所得菌株配制成孢子悬浮液(孢子浓度为10×40倍镜下每视野约为5~10个孢子),取1 mL混匀至PDA培养基中在25 ℃下培养。培养基上长出单个菌落时观察每个菌落形态并在显微镜下观察菌丝的结构。如果发现培养基上每个菌落的特征一致则确定该菌株为纯种,并转接试管斜面4 ℃保存;如果观察发现培养基上菌落的特征不一致,需再次纯化,直至培养基上菌落特征一致。
1.3 病原菌致病性检测
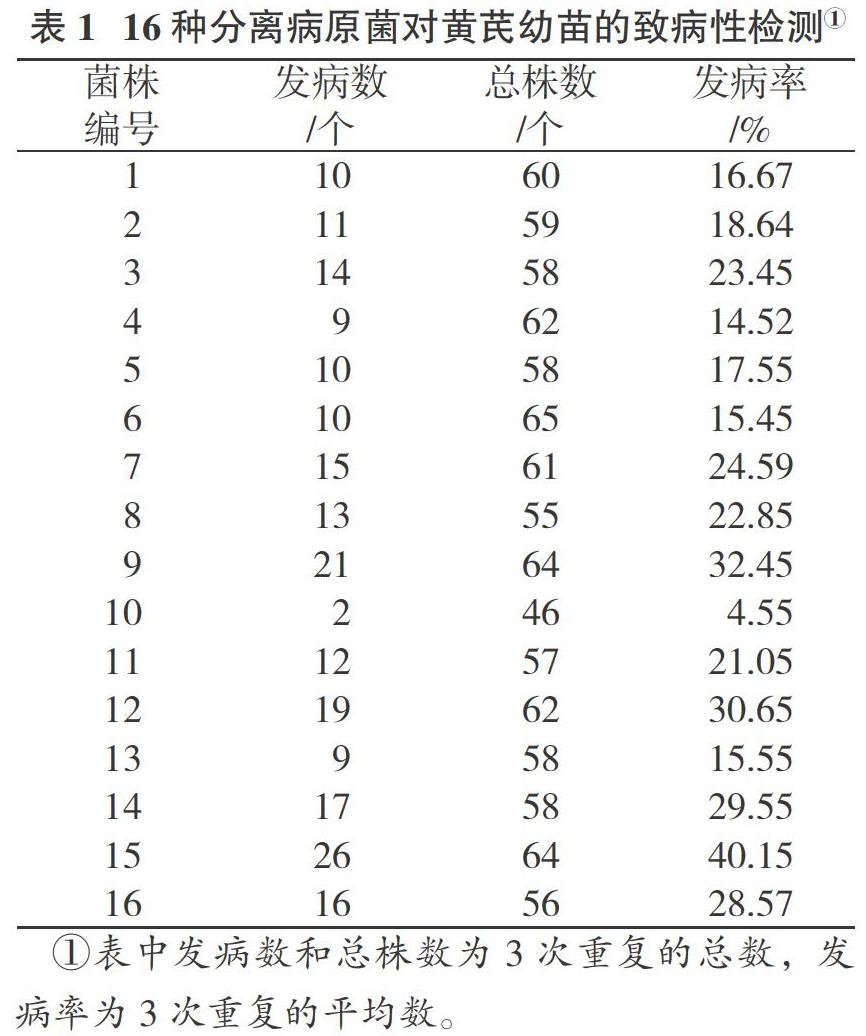
黄芪种子经催芽消毒后种植于盆内,待子叶完全舒展、长出4~6片真叶时采用根部切伤接种法[8 ]。将病原菌孢子悬浮液(孢子浓度10×40倍镜下每视野约为50~60个孢子) 2 mL滴加到植株附近土壤中,每盆选取两处空隙共加入4 mL孢子悬浮液,黑暗培养24 h,然后正常光照培养。每个菌株接种3盆,以无菌水处理作为对照,观察对黄芪幼苗的致病情况。以幼苗根部腐烂、地上部分枯死为标准判定该幼苗发病,计算幼苗发病率(%)和病情指数(DI)。
发病率=(发病株数/调查株数)×100%
病情指数=[∑(V·f)/(m·N)]×100%
其中,V为该严重度的级值,f为该级病株数,m为最高级值,N为调查发病总株数。根腐病分级标准:0级,没有病害症状;1级,1%~25%植株受到损害;2级,26%~50%植株受到损害;3级,51%~75%植株受到损害;4级,76%~100%植株受到损害。
1.4 致病菌的形态鉴定
根据《真菌鉴定手册》所描述的无性器官形态特征及培养性状对致病菌菌落、菌丝体、孢子体等进行形态鉴定,鉴定到种[9 ]。
1.5 致病菌的分子生物学鉴定
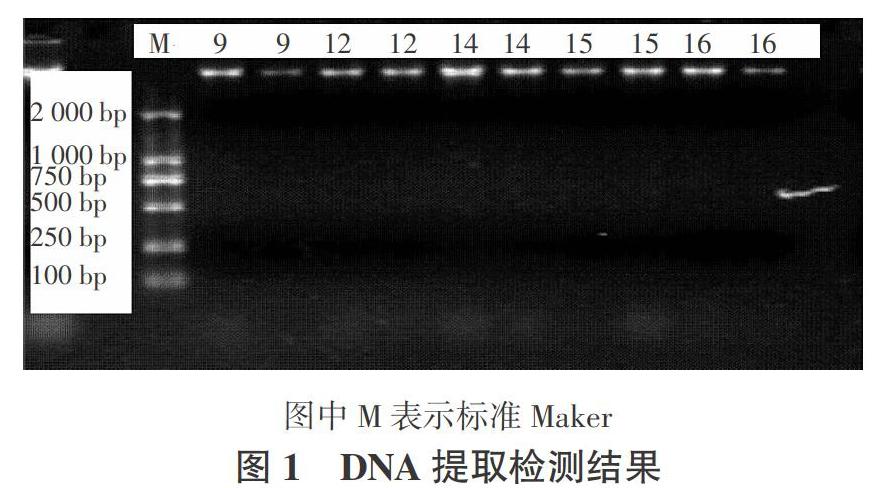
1.5.1 致病菌总DNA的提取 将活化的致病菌接入100 mL真菌液体培养基I中,恒温培养5~7 d,真空抽滤得到干燥菌丝体。采用改良的真菌DNA提取方法提取黄芪根腐病致病菌总DNA[10 ]。以DS2000为DNA Marker,在含0.5 μg/mL EB的1.2%的琼脂糖凝胶上电泳60 min(120 V),电泳缓冲液为0.5×TBE溶液,检测DNA质量。在凝胶图像分析系统中照相。
1.5.2 致病菌核糖体DNA(rDNA)- ITS片段的PCR扩增 采用真菌核糖体基因转录间隔区ITS通用引物ITSl和ITS4[11 ],对提取DNA中ITS和5.8S rDNA(ITS包括18S rDNA和5.8S rDNA之间的转录间隔区ITSl与5.8S rDNA和28S rDNA之间的转录间隔区ITS2)进行PCR扩增。PCR扩增体系为25μL:水13.5 μL,10×Buffer 2.5 μL,Mg2+(25 mM)1.5 μL,dNTP(各2 mM)2 μL,Taq(5 U/μL)0.5 μL,模板DNA 2 μL,上下游引物 (20 μM) 各1.5 μL。PCR扩增程序:94 ℃预热5 min,94 ℃变性30 s,53 ℃退火40 s,72 ℃延伸1 min,30个循环后于72 ℃延伸10 mins,温度降至10 ℃反应完毕。反应结束后,取5 μL反应物在含0.5 μg/mL EB的1.2%的琼脂糖凝胶上电泳60 min(120 v),以DS 2000为DNA Marker,电泳缓冲液为0.5×TBE溶液,检测PCR产物大小。在凝胶图像分析系统中照相。
1.5.3 PCR扩增产物的纯化 采用SanPrep柱式PCR产物纯化试剂盒(上海生工生物工程技术服务有限公司)对扩增产物进行纯化。
1.5.4 ITS片段的测序及序列分析 将经过纯化的PCR产物送到上海生工生物工程技术服务有限公司,做双向测序。将所测ITS序列用Seqman软件(DNAsrar)拼接。采用Clustal X 1.83軟件将拼接后的ITS序列与GenBank中检索已知的标准菌株的ITS序列片段多序列比对,进行同源性比较,使用MEGA(Version 4.0)软件分析,采用最小进化法 (Minimum Evolution theord,ME)构建系统发育树,进一步确定致病菌的类别和分类地位。
2 结果与分析
2.1 分离结果
从黄芪根腐病患病植株中得到36株分离物,通过观察菌落特征、菌落形态、菌丝颜色、菌丝分泌的色素在PDA培养基上形成的颜色及显微镜下孢子体结构和大小,确定有16种分离物,初步确定为半知菌纲丛梗孢目瘤座孢科镰刀菌属真菌。
2.2 致病性检测
致病性检测结果(表1)表明,9号菌株、12号菌株、14号菌株、15号菌株、16号菌株均具有致病性(发病率超过25%,病情指数在16以上),黄芪幼苗的发病率分别为32.45%、30.65%、29.55%、40.15%、28.57%,病情指数均在16以上。其中15号菌株发病率最高,为40.15%,病情指数为20.31。发病黄芪症状与田间植株自然发病症状一致,从发病黄芪幼苗和土壤中进行病原菌地再分离,均能得到引起黄芪幼苗发病的病原菌,确定该5个菌株为黄芪根腐病致病菌。
2.3 形态鉴定
经形态学鉴定,9号菌株菌落白色絮状,菌丝较长,致密,中间或边缘有明显的隆起,菌落背面米白色。分生孢子梗无色,顶生卵形、镰刀形分生孢子。大型分生孢子镰刀形或纺锤形,稍弯曲,两端渐窄,具钩状,具1~5隔膜,多为3隔膜;厚垣孢子顶生,椭圆形或球形,平滑。初步确定为尖孢镰刀菌(Fusarium. oxysporum)。12号菌株菌落土灰色至淡粉色,由内向外出现环状颜色变化,中间有微黄色的斑点,无隆起,生长较均匀,菌落背面淡黄色和乳黄色;分生孢子梗单瓶梗状,伸长不分枝;大型分生孢子纺锤形、香肠型,短而胖,稍弯曲,两端较钝,有3~5个隔膜,多数为3隔;小型分生孢子椭圆形、肾形,单细胞无色;厚垣孢子间生,球形,表面光滑。初步确定为腐皮镰刀菌(Fusarium. solani)。14号菌株菌落乳白色、白色,菌丝较短,短绒状,气生菌丝不发达,中间有明显的隆起;菌落背面为浅黄色。分生孢子梗螺旋式伸长、不分枝。大型分生孢子两端尖削或顶端尖,纺锤形至镰刀形弯曲或端直,具2~5隔,多数为3隔。小型分生孢子数量少,梭形至肾脏形,单胞,无隔膜,厚垣孢子椭圆形,表面光滑,间生于菌丝中间。由于无明显的结构特征,从形态学只能初步确定为镰刀菌属中的1种。15号菌株菌落白色至淡黄色,菌丝较厚,致密,绒状;菌落背面为橘黄色,有明显的菌圈;分生孢子梗螺旋状,单瓶梗;小型分生孢子数量少,呈梭形、长椭圆形、肾形或卵形,单细胞,有1~2个隔;大型分生孢子细镰刀形,弯曲度大,向两端渐趋尖削,具3~5隔,多数为3隔;厚垣孢子串生与菌丝中间。初步确定为锐顶镰刀菌。16号菌株分生孢子梗伸长,单瓶梗状,较长;大型分生孢子数量多,纺锤形或镰刀形,稍弯曲,两端较钝圆,有3~5个隔,多数为3隔;小型分生孢子数量多,长椭圆形、卵形,单细胞,无分隔;厚垣孢间生,单生,椭圆形或圆形,表面光滑;菌落白色,菌丝较稀薄,平铺,菌丝较长,生长较均匀;菌落背面中间为淡黄色,边缘为乳白色。其形态特征跟12号菌株相似,菌落形状和颜色有差别,较难判定,可能为腐皮镰刀菌(Fusarium. solani)的变种。
2.4 ITS序列分析
2.4.1 致病菌DNA提取及检测结果 如图1所示,5种致病菌的DNA提取结果经琼脂糖凝胶电泳检测后未出现拖尾等现象,浓度跟标准Maker浓度相比无显著差异。DNA质量和浓度均可满足下一步试验。
2.4.2 致病菌ITS片段的扩增 采用真菌核糖体ITS区通用引物ITS1和ITS4对5种致病菌的ITS片段进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,结果如图2。从图2可以看出,5个菌株扩增后均产生稳定的条带,条带均在500~750 bp。
2.4.3 ITS序列分析 对PCR产物进行纯化后,将纯化产物送至上海生工生物工程有限公司进行ITS序列双向测序,双向测序结果经SeqMan软件拼接并输出全序列,9号菌株、12号菌株、14号菌株、15号菌株和16号菌株的rDNA-ITS序列长度分别为486 bp、 502 bp、510 bp、516 bp、536 bp。经DNAMAN软件多序列分析,对5个菌株核糖体DNA ITS片段序列的拼接结果在Genbank 中进行同源性比较,其中与9号菌株同源性最高的ITS序列菌株全部为尖孢镰刀菌,其同源性均为100%,可以确定9号菌株为尖孢镰刀菌;15号菌株核糖体DNA- ITS序列与Genbank中锐顶镰刀菌的同源性均为99%,仅有1个碱基的差异,可以确定15号菌株为锐顶镰刀菌;12号菌株和16号菌株与其同源性最高的ITS序列菌株全部为腐皮镰刀菌(茄腐镰刀菌),与它们的同源性为99%,仅有1个碱基的差异,后经DNAMAN软件比对,发现12号菌株和16号菌株的同源性为85.89%。确定12号菌株和16号菌株同为腐皮镰刀菌(茄腐镰刀菌),由于其形态特征有差异,初步认为16号菌株可能是腐皮镰刀菌的一个变种。与14号菌株同源性高的ITS序列菌株均为三线镰刀菌,但其同源性最高为88%,无法确定到种。
使用多序列比对分析软件Clustal X软件(Version 1.83)将5个菌株的rDNA-ITS序列与从Genbank中下载的尖孢镰刀菌、腐皮镰孢菌、锐顶镰孢菌、三线镰刀菌等标准菌株的rDNA-ITS序列进行序列的联配比较(Alignment),序列最后以Clustal格式输出。选择丝孢纲瘤座孢目瘤座孢科拟黑粉菌属(Ustilaginoidea)作为外类群,使用MEGA(Version 4.0)软件进行分析,采用最小进化法(Minimum Evolution theord,ME)构建系统发育树,应用自展(Bootstrap)分析法进行检验,共循环1 000次 (图3) 。
由图3可以看出,9号菌株与5株尖孢镰刀菌(F. oxysporum)的亲缘关系最近,聚为一小分支,其Bootstrap的支持率为99%;12号菌株与10株腐皮镰孢菌(茄腐镰孢菌)(F. solani)親缘关系最近,Bootstrap的支持率为99%。此外,ITS系统发育树表明,16号菌株与12号菌株的关系较近,它们聚为一组,处于同一个分支下,其Bootstrap的支持率为99%;15号菌株与5株锐顶镰刀菌(F. acuminatum)的ITS序列无明显差异,聚为一小分支,Bootstrap的支持率为99%,同时发现它与三线镰刀菌(F. tricinctum)的亲缘关系也比较近,处于同一分支下,其Bootstrap的支持率也为99%。14号菌株同源性高的ITS序列菌株均为三线镰刀菌,但其同源性最高仅为88%,在构建的系统发育树上,14号菌株与处于锐顶镰刀菌(F. acuminatum)和三线镰刀菌(F. tricinctum)的分支亲缘关系最近,聚为一小分支,Bootstrap的支持率仅为54%。由可以认为,9号菌株为尖孢镰刀菌,12号菌株和16号菌株为腐皮镰刀菌,15号菌株为锐顶镰刀菌,14号菌株与锐顶镰刀菌和三线镰刀菌的亲缘关系都比较近,具体属于哪一类镰刀菌,需做进一步鉴定。
3 结论与讨论
很多病原菌能够引起植物根腐病,已报道的有镰刀菌、丝核菌、腐霉等。在镰刀菌属(Fusarium)真菌中,有许多是危害经济作物的重要病原菌,它们是植物维管束系统的寄生菌,在适宜的环境条件下,不但破坏作物的输导组织维管束,还在菌体生长发育代谢过程中产生毒素危害作物,造成作物萎蔫死亡,影响产量和品质,严重时可导致产量显著下降[12 ]。梁巧兰等[13 ]报道,尖孢镰刀菌和茄腐镰刀菌是引起观赏百合根腐病的主要致病菌。李敏权等[14 ]对甘肃中部干旱地区苜蓿根腐病进行了分离鉴定,确认在该地区苜蓿根腐病的病原菌为尖孢镰刀菌、锐顶镰刀菌和半裸镰刀菌。本试验研究通过采集带病的黄芪根腐病植株,依据组织分离法对黄芪根腐病的病原菌进行了分离、纯化,分离得到的病原菌通过回接的致病性检测,14 d后出现发病症状,症状与田间症状相同,而对照组不发病。根据致病菌的形态特征和培养性状的观察结果,再结合核糖体DNA(rDNA)ITS序列测定的结果,将致病菌鉴定为半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)瘤座孢目(Tuberculariales)瘤座孢科(Tuberculariaceae)镰刀菌属(Fusarium)的尖孢镰刀菌(F. oxysporum)、 腐皮镰孢菌(F. solani)和锐顶镰孢菌(F. acuminatum)。其中锐顶镰孢菌的致病力最强,接种后发病率最高为40.15%;尖镰孢菌的致病力较弱,接种后发病率为32.45%;腐皮镰孢菌的致病力最弱,接种后发病率为28.57%~30.65%。邓成贵[4 ]、王立新等[15 ]研究发现,黄芪根腐病病原菌经分离、致病性测定和形态学鉴定初步确定为腐皮镰刀菌和尖孢镰刀菌,本研究从分子生物学水平进一步鉴定出引起黄芪根腐病的致病菌为腐皮镰刀菌、尖孢镰刀菌和锐顶镰刀菌。
为了进一步验证分离出的致病菌,我们对形态上已初步确定的5种致病菌的核糖体DNA-ITS序列进行了分析,发现9号菌株的致病菌尖孢镰刀菌(F. oxysporum)和12号菌株、16号菌株的腐皮镰刀菌(F. solani)与GenBank中的F. oxysporum和F. solani、F. acuminatum同源性都很高,同源性分别为100%和99%,系统发育树上Bootstrap的支持率为99%。由于形态学上有差异,16号菌株的致病菌可能为腐皮镰刀菌的变种,需做进一步鉴定。15号菌株的致病菌与GenBank中F. acuminatum的同源性也在99%以上,在系统发育树与锐顶镰刀菌(F. acuminatum)的亲缘关系也比较近,其Bootstrap的支持率也为99%,可确定15号菌株为锐顶镰刀菌。Renske Landeweert等[16 ]认为,通过ITS区域比对,序列相似性大于99%,可鉴别为相同种;序列相似性大于95%且小于99%,可鉴别为相同属;序列相似性小于95%,可鉴别为相同科。14号菌株的致病菌其序列与标准菌株三线镰刀菌ITS序列的最高同源性仅为88%。在构建的系统发育树上,14号菌株与处于锐顶镰刀菌(F. acuminatum)和三线镰刀菌(F. tricinctum)的分支亲缘关系最近,聚为一小分支,Bootstrap的支持率仅为54%。由于其同源性小于95%,故14号菌株具体为镰刀菌属哪一种,有待于进一步研究。
虽然传统的形态学鉴定与分子鉴定和种间系统发育分析之间常常存在着不一致的情况[17 ],但在本研究中,尖孢镰刀菌、腐皮镰刀菌和锐顶镰刀菌ITS序列的同源性比较结果表明同源性对比的结果和形态学鉴定的结果是一致的,证明ITS序列对于真菌镰刀菌属种间鉴定是可行的,可以作为快速检测、鉴定镰刀菌的方法。
参考文献:
[1] 张东佳,杨永建,赵汝能. 甘肃黄芪属药用植物资源[J] . 中国野生植物资源,2005,24(1):38-40.
[2] 管青霞,李城德,李錦龙,等. 蒙古黄芪覆膜露头栽培技术规程[J]. 甘肃农业科技,2019(5):84-87.
[3] 尚虎山,杨荣洲,权小兵,等. 产地土壤养分与黄芪产量和质量的相关性分析[J]. 甘肃农业科技,2018(9):49-51.
[4] 邓成贵. 黄芪根腐病病原鉴定研究初报[J]. 中药材,2005(2):85.
[5] 丁文姣,于安芬,李瑞琴,等. 根腐病病原菌粗提物胁迫下黄芪幼根代谢变化初探[J]. 甘肃农业科技,2018(12):31-34.
[6] 丁文姣,于安芬,李瑞琴,等. 定西市黄芪根腐病优势病原菌生物学特性研究[J]. 甘肃农业科技,2018(3):33-36.
[7] LEBLOND-BOURGETN,HERVEP,IRENEM,et al. 16S rRNA and 16S to 23S internal transcribed spacer sequence analyses reveal inter and intraspecific bifidobacterium phylogeny[J]. Int. J. Syst. Bacteriol.,1996,46:102-111.
[8] 马晶晶. 板蓝根根腐病病原菌鉴定及抑菌中草药提取物的筛选[D]. 保定:河北农业大学.
[9] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
[10] 李绍兰,周 斌,杨丽源,等. 真菌DNA提取方法的改良[J]. 云南大学学报(自然科学版),2002, 24(6):471-472.
[11] WANG Y C,ZHANG Z G,ZHENG X B. Use ITS regions of rRNA gens as an additional charaeteristic inidentifieation of Phytophthora boehmeriae and P.cactotum[J]. Mycosystema,2000,19:485-91.
[12] 林清洪,黄志宏. 镰刀菌研究概述[J]. 亚热带植物通讯,1996,25(1):51-56.
[13] 梁巧兰,徐秉良,刘艳梅. 观赏百合根腐病病原菌鉴定及药剂筛选[J]. 甘肃农业大学学报,2004,39(1):25-28.
[14] 李敏权,柴兆祥,李金花,等. 定西地区苜蓿根和根颈腐烂病病原研究[J]. 草地学报,2003,11(1):83-86.
[15] 王立新,孙先荣,白全江,等. 黄芪根腐病病原菌鉴定[J]. 华北农学报,1994,9(2):107-109.
[16]RENSKE L,PAULA L,THOMW K,et a1. Appplied and environmental[J]. Microbiology,2003,69(1):327-333.
[17] KEITH L M,VELASQUEZ M E,ZEE F T. Identification and characterization of Pestalotiopsis spp. causing scab disease of guava,Psidium guajava,in Hawaii[J]. Plant Disease,2006,90(1):16-23.
(本文责编:郑立龙)
