三种化合物对海水pH值、碱度和硬度的调节效果比较
2020-11-30王充
王充
摘要:本实验选用Na2CO3、NaOH和Ca(OH)2三种化合物作为水质调节剂,进行海水pH值、碱度和硬度的调节实验,通过比较不同化合物的调节效果,筛选出对pH值、碱度和硬度具有良好调节效果且经济的化合物,为水产养殖生产的水质调控提供参考依据。实验结果表明:Ca(OH)2提高pH值、碱度和硬度效果比较理想。每增加1个pH单位需使用Ca(OH)2 78.53 g/m3;而提升碱度1 mmol/L,需使用Ca(OH)2 52.63 g/m3。Na2CO3提升pH值和碱度的能力比较低,必须高剂量使用,每增加1个pH单位需使用Na2CO3 196.84 g/m3,而且Na2CO3价格相对比较高,不适合作为提高pH和碱度的试剂。NaOH虽然能迅速提高pH和碱度,但是随着作用时间的延长,效果不如Ca(OH)2。NaOH使用剂量为100 g/m3时,水体硬度下降7.74%。
关键词:Na2CO3;NaOH;Ca(OH)2;pH值;碱度;硬度;海水
中图分类号:S959 文獻标识码:B
1 材料与方法
1.1 实验对象选择
实验于2020年7月到2020年9月在海南昱海蓝科生物科技有限公司翁田育苗基地进行。天然海水经过24h沉淀、砂滤后作为实验海水。分别采用碳酸钠[Na2CO3]、氢氧化钠[NaOH]和氢氧化钙[Ca(OH)2]三种化合物进行海水pH值、碱度和硬度的调节实验。
1.2 实验材料
1.2.1 实验试剂
工业碳酸钠[Na2CO3](山东海化,2.4元/kg)、工业氢氧化钠[NaOH](天津银桥,3.0元/kg)和农用熟石灰[氢氧化钙,Ca(OH)2](广州拓羽,0.5元/kg);邻苯二钾酸氢钾(KHC8H4O4)标准缓冲溶液(pH=6.86,25℃),磷酸二氢钾(KH2PO4,0.25 mmol/L)和磷酸氢二钠(Na2HPO4,0.25 mmol/L)混合标准缓冲溶液(pH=6.86,25℃)、四硼酸钠(Na2B4O7)标准缓冲溶液(pH=9.18,25℃)、甲基红-次甲基蓝混合指示剂、EDTA二钠标准溶液、氨性缓冲溶液、铬黑T指示剂、HCl溶液(1+1)、氨水(1+1)、标准锌溶液。
1.2.2 实验仪器
分析天平(LA230S,Sartorius)、pHS-3C型酸度计、盐度计、可见分光光度计(722S,上海棱光)、振荡摇床(ZD-9560,太仓华利达)、温度计等。
1.3 实验设计
实验根据化合物种类的不同设置为三个批次进行。结合生产上各种实验材料的用量,每一种化合物设置6个剂量梯度(0 g/m3、20 g/m3、40 g/m3、60 g/m3、80 g/m3、100 g/m3),每一剂量梯度设2个重复。将12个塑料桶(60 L)分成6组,分别加入实验用水40 L;加入不同剂量的化合物,充分搅匀,微充气,待化合物在水中完全溶解后,分别从不同梯度组中取水样测定其pH值、碱度和硬度,进行化合物剂量对海水pH值、碱度和硬度影响效果分析。每隔8 h测定一次,连续监测3天,进行化合物作用时间对海水pH值、碱度和硬度的影响效果分析。实验期间海水盐度30‰~33‰,水温变化范围为27.0℃~29.5℃。
1.4 实验数据的处理与分析
采用Excel 2003对不同剂量Na2CO3、NaOH和Ca(OH)2使用后的作用效果进行线性回归分析。
2 结果与分析
2.1 三种化合物对海水pH值的影响
2.1.1 化合物剂量对海水pH值的影响
不同剂量的化合物对海水pH值的影响。三种化合物对海水pH值上升的幅度和使用剂量呈正相关。化合物剂量相同时,pH值上升幅度从高到底依次为NaOH>Ca(OH)2>Na2CO3,说明NaOH和Ca(OH)2有较强的提高海水pH值能力,而海水中加入Na2CO3后pH值上升幅度比较小。化合物剂量为100 g/m3时,Na2CO3、NaOH和Ca(OH)2处理组pH值上升幅度分别为:0.49,1.54和1.16。以加入海水中Na2CO3、NaOH和Ca(OH)2的剂量为自变量(X,g/m3),以化合物溶解后提升海水pH值的幅度为应变量(Y),进行曲线拟合,得出方程(1)、(2)和(3):
Na2CO3:Y=-0.00001652X2 + 0.006823X + 8.21607 (R2 = 0.962,P<0.01)…(1)
NaOH:Y=-0.00006964X2 + 0.023293X + 8.18571 (R2 = 0.951,P<0.01)…(2)
Ca(OH)2:Y=-0.00005536X2 + 0.017079X + 8.22572(R2 = 0.979,P<0.01)…(3)
方程(1)中当X=196.84时Y=1,说明在本实验的条件下当Na2CO3加入量为196.84 g/m3时,能提升pH一个单位。方程(2)中而当X=56.72时Y=1,说明当NaOH加入量为56.72 g/m3时,能提升pH一个单位。方程(3)中当X=78.53时Y=1,说明当Ca(OH)2加入量为78.53 g/m3时,能提升pH一个单位。
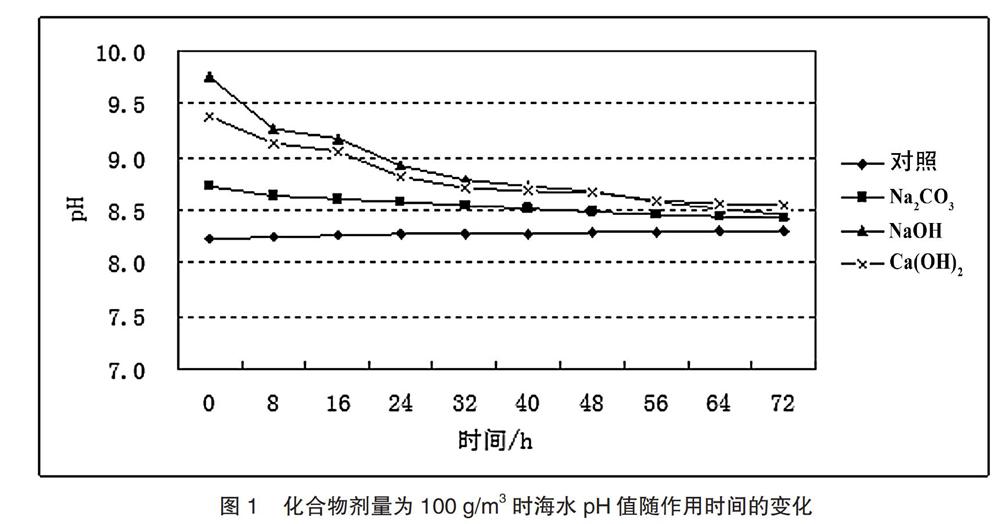
2.1.2 化合物作用时间对海水pH值的影响
从图1可以看出,本实验中三种化合物剂量为100 g/m3的情况下,随着作用时间的增加,pH值逐渐降低。化合物作用8 h后,NaOH处理组的pH值由9.77下降至9.26,Ca(OH)2处理组的pH值由9.39下降至9.13;而Na2CO3处理组pH值由8.73下降至8.64。化合物作用72 h后,NaOH、Ca(OH)2和Na2CO3处理组pH值分别下降至8.46、8.54和8.42。其中,NaOH处理组pH值下降幅度最大,达到1.31个pH值单位;其次是Ca(OH)2处理组,为0.85;Na2CO3处理组的pH值下降幅度最小,仅为0.31。未加入化合物的对照组pH值稳定在8.23~8.31。
2.2 三种化合物对海水碱度的影响
2.2.1 化合物使用剂量对海水碱度的影响
加入不同剂量的化合物后,测得各处理组中碱度的变化情况。海水中加入Na2CO3、NaOH和Ca(OH)2后碱度有明显的变化,经NaOH处理实验组的碱度上升幅度最大,而Na2CO3处理实验组的碱度上升幅度低于NaOH和Ca(OH)2。从图3可以看出,三种化合物对海水碱度上升幅度和使用剂量正相关,碱度上升幅度从高到底依次为NaOH>Ca(OH)2>Na2CO3。化合物剂量为100 g/m3时,Na2CO3、NaOH和Ca(OH)2处理组碱度上升幅度分别为:1.62 mmol/L,1.94 mmol/L和1.89 mmol/L。
以加入海水中Na2CO3、NaOH和Ca(OH)2的剂量为自变量(X,g/m3),以化合物溶解后提升海水碱度幅度为应变量(Y,mmol/L),进行曲线拟合,得出方程(4)、(5)和(6):
Na2CO3:Y=0.00000727X2 + 0.0154605X + 2.222642 (R2=0.981,P<0.01)…(4)
NaOH:Y=-0.00003451X2 + 0.0235211X + 2.190607 (R2=0.966,P<0.01)…(5)
Ca(OH)2:Y=0.00001350X2 + 0.017697X + 2.218525 (R2=0.978,P<0.01)…(6)
方程(4)中当X=67.73时Y=1 mmol/L,说明在本实验的条件下只有当加入的Na2CO3使用剂量为67.73 g/m3时,能提升碱度1 mmol/L。方程(5)中当X=49.75时Y=1 mmol/L,说明当加入的NaOH使用剂量为49.75 g/m3时,能提升碱度1 mmol/L。方程(6)中当X=52.63时Y=1 mmol/L,说明当加入的Ca(OH)2使用剂量为52.63 g/m3时,能提升碱度1 mmol/L。
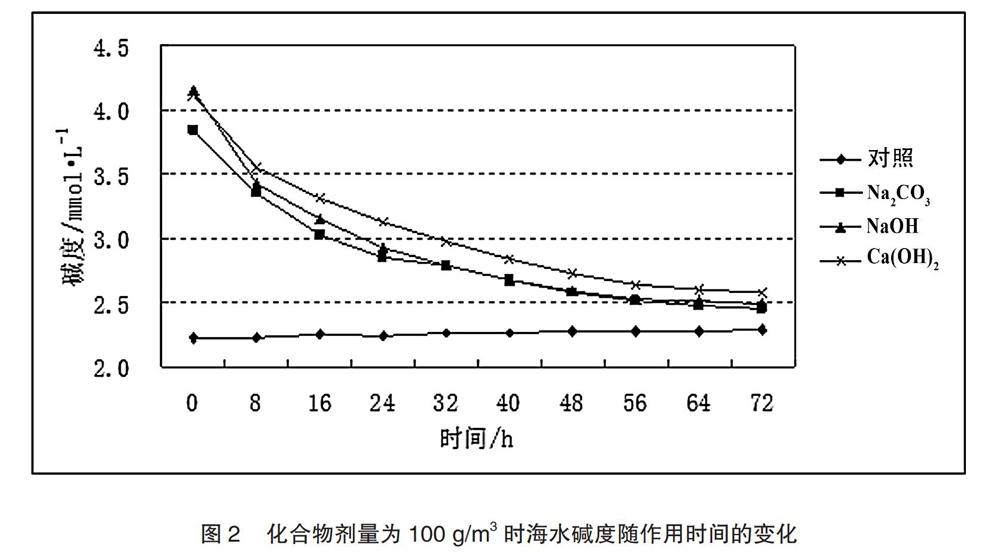
2.2.2 化合物作用时间对海水碱度的影响
从图2可以看出,本实验中三种化合物剂量为100 g/m3的情况下,随着作用时间的增加,海水碱度逐渐降低。化合物作用8 h后,NaOH处理组的碱度由4.15 mmol/L下降至3.43 mmol/L,Ca(OH)2处理组碱度由4.11 mmol/L下降至3.55 mmol/L;而Na2CO3处理组碱度由3.84 mmol/L下降至3.35 mmol/L。化合物作用72 h后,NaOH、Ca(OH)2和Na2CO3处理组碱度分别下降至2.49 mmol/L、2.57 mmol/L和2.45 mmol/L。其中,NaOH处理组碱度下降幅度最大,达到1.66mmol/L;其次是Ca(OH)2处理组,为1.54 mmol/L;Na2CO3处理组的碱度下降幅度最小,仅为1.39 mmol/L。未加入化合物的对照组碱度稳定在2.22~2.29 mmol/L。
2.3 三種化合物对海水硬度的影响
加入不同剂量的化合物后,测得各处理组中硬度的变化情况。随着Na2CO3和NaOH使用剂量的升高,海水中的硬度表现出下降趋势,化合物使用剂量最高时(100 g/m3)降幅最大。化合物使用剂量100 g/m3时,NaOH处理组下降的幅度为7.74%,而Na2CO3处理组降幅较小仅为4.04%。由于海水中的硬度很大,NaOH和Na2CO3的加入对海水硬度影响幅度相对较小。Ca(OH)2可显著提升水体的硬度,Ca(OH)2使用剂量为100 g/m3时,实验水体硬度提高18.43%。
以加入海水中Na2CO3、NaOH和Ca(OH)2的剂量为自变量(X,g/m3),以化合物溶解后提升海水硬度为应变量(Y,mmol/L),进行曲线拟合,得出方程(7)、(8)和(9):
Na2CO3:Y=0.00004509 X2 - 0.0496946 X + 104.4612 (R2=0.953,P<0.01)…(7)
NaOH:Y=-0.00005938X2 +0.0669482X + 104.1617 (R2 =0.921,P<0.01)…(8)
Ca(OH)2:Y=-0.00104107X2 + 0.3047357 X + 104.0171(R2 =0.948,P<0.01)…(9)
方程(7)中当X=24.75时Y=1,说明在本实验的水质条件下只有当加入的Na2CO3浓度为24.75 g/m3时,能降低硬度1 mmol/L。方程(8)中当X=12.24时Y=1,说明只有当加入的NaOH浓度为12.24 g/m3时,能降低硬度1 mmol/L。方程(9)中当X=8.38时Y=1,说明只有当加入的Ca(OH)2浓度为8.38 g/m3时,能提升硬度1 mmol/L。
3 讨论
3.1 NaOH对海水pH值、碱度和硬度的调节
氢氧化钠[NaOH]俗称烧碱,分子量40,是一种强碱,为强电解质。溶于水即发生完全水解:NaOH=Na+ + OH-。本实验中,三种化合物在相同使用剂量的情况下,NaOH处理组pH值和碱度的增加幅度最大,pH值增加了1.54个单位,碱度增加了1.93 mmol/L,效果明显大于Na2CO3处理组和Ca(OH)2处理组。
然而,NaOH使用后随着作用时间的延长,实验水体pH值和碱度逐渐下降。72 h后,NaOH处理组pH值下降1.31;碱度下降1.66 mmol/L。这主要是由于本实验模拟育苗生产,整个过程中水体微充气,空气中的二氧化碳(CO2)和水体中NaOH电离出的氢氧根离子(OH-)发生反应:CO3+OH-=HCO3-,引起水体氢氧根离子(OH-)减少。
随着NaOH使用剂量的升高,实验水体的硬度表现出下降趋势,化合物使用剂量最高时(100 g/m3)降幅最大,为7.74%。这主要是由于NaOH电离出的氢氧根离子(OH-)可与镁离子(Mg2+)发生反应,生成难溶于水的氢氧化镁:2HO- + Mg2+=Mg(HO)2。
3.2 Na2CO3对海水pH值、碱度和硬度的调节
碳酸钠[Na2CO3]俗称纯碱、苏打,分子量106,是一种强碱弱酸盐,为强电解质。溶于水即发生水解反应:Na2CO3=2Na+ + CO3-,CO32- + H2O=HCO3- + OH-。本实验中,三种化合物同等剂量的情况下,Na2CO3实验组pH值和碱度增加幅度比NaOH明显要小,这主要是由于Na2CO3分子量比较大,同时水分子(H2O)是弱电解质,不能完全电离,海水仍有部分碳酸根离子(CO32-)存在。
同NaOH相似,Na2CO3使用后随着作用时间的延长,实验水体pH值和碱度逐渐下降,然而其下降程度要比NaOH要低。碳酸钠电离后与水分子(H2O)发生反应生成碳酸氢根离子(HCO3-):CO32- + H2O=HCO3- + OH-,而碳酸氢根离子(HCO3-)具有稳定水体酸碱度的能力,即具有一定缓冲性:HCO3- + H+=H2CO3,HCO3- + OH-=CO32-+ H2O。因此,Na2CO3的使用对稳定水体pH值具有重要作用。
随Na2CO3使用剂量的升高海水中的硬度出现下降,这主要是由于Na2CO3电离出的碳酸根(CO32-)和钙离子(Ca2+)结合,生产难溶于水的碳酸钙(CaCO3)。然而又由于碳酸根(CO32-)可与水分子(H2O)结合转化为碳酸氢根(HCO3-),导致Na2CO3处理组实验水体硬度下降幅度低于NaOH,Na2CO3使用剂量最高时(100 g/m3)降幅为4.04%。
3.3 Ca(OH)2对海水pH值、碱度和硬度的调节
氢氧化钙[Ca(OH)2]俗称熟石灰、消石灰,分子量74,是一种强碱。Ca(OH)2微溶于水(25℃,0.155 g),本实验中,Ca(OH)2最大使用剂量为100 g/m3,远小于其溶解度,可以完全溶解。Ca(OH)2为弱电解质,可在水中发生不完全电离:Ca(OH)2=Ca2+ + 2OH-,提高水体硬度。
Ca(OH)2的碱性比NaOH强(金属活动性钙>钠),然而由于Ca(OH)2为弱电解质,虽能完全溶解,但尚未完全电离,因此Ca(OH)2处理组pH值和碱度的增加幅度均小于比NaOH。
随着作用时间的延长,Ca(OH)2处理组实验水体pH值和碱度逐渐下降,但是其下降程度要比NaOH处理组要低。這主要是由于实验水体中,二氧化碳和水体中氢氧根离子(OH-)发生反应:CO2 + OH-=HCO3-,引起水体氢氧根离子(OH-)减少,pH值和碱度逐渐降低;而溶解在实验水体中未被完全电离的Ca(OH)2因氢氧根离子的减少而增加电解程度,从而导致其pH值和碱度下降程度要比NaOH要低。
3.4 三种化合物对海水pH值、碱度和硬度的调节效果比较
本实验结果表明,Ca(OH)2可以迅速提升海水pH值、碱度,稳定性好、作用效果持久,72 h后Ca(OH)2处理组最终pH值和碱度均高于NaOH和Na2CO3。同时Ca(OH)2还可以迅速提升水体硬度,价格低廉(0.5 元/kg),因此我们认为Ca(OH)2比较适合在生产上广泛使用。当Ca(OH)2加入量为78.53 g/m3,能提高1个单位pH值;加入量为52.63 g/m3时能提高碱度1 mmol/L。Na2CO3虽然可以提升海水pH值和碱度,并具有一定缓冲性,对稳定养殖水体酸碱度具有重要意义。然而,每增加一个pH值单位需使用Na2CO3 196.84 g/m3,使用剂量是Ca(OH)2的2.51倍,并且Na2CO3价格相对比较高(2.4元/kg)。NaOH瞬间提升pH值和碱度效果比Ca(OH)2和Na2CO3好,但是其效果受作用时间影响也最大,不利于维持海水pH值和碱度的稳定。同时,NaOH使用后会产生较多的白色絮状物[主要是Mg(OH)2],对海水硬度影响比较明显,不适合在生产上使用。
参考文献
[1] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[2] 臧维玲,戴习林,朱正国,等.罗氏沼虾育苗用水中Mg2+与Ca2+含量及Mg2+/Ca2+对出苗率的影响[J].海洋与湖沼,1995,26(5):552-557.
[3] 王静,曾伯平. pH值的作用和调节措施[J].内陆水产,2006,(9):35-37.
[4] 赵凤岐,李向春.不同硬度水质对脐带龙成活率的影响[J].山西农业大学学报,2008,28(2):194-197.
[5] 郑振华,董双林,田相利. pH不同处理时间的周期性变动对凡纳滨对虾生长的影响[J]. 中国海洋大学学报,2008,38(1):45-51.
[6] 田秀环,张劲松,石峰,等.不可忽视石灰对健康养虾的作用[J].中国水产,2005,(11):50-5.
